Effect of atractylone on the viability and apoptosis of hepatoma HepG2 cells and related mechanism
-
摘要:
目的 观察苍术酮对肝癌HepG2细胞活性、凋亡的影响,并探讨其作用机制。 方法 以肝癌HepG2细胞为研究对象,分为苍术酮低、中、高剂量组(5、10、20 μmol/L),对照组加入等体积的DMSO。MMT比色法检测不同浓度苍术酮处理后HepG2细胞活性。流式细胞仪检测HepG2细胞凋亡率及线粒体膜电位。DCFH-DA荧光探针标记法检测HepG2细胞内ROS水平。Transwell实验检测苍术酮对HepG2细胞迁移能力的影响。蛋白质印迹法检测Bcl-2、Bax和Cleaved caspase-3蛋白表达水平。计量资料多组间比较采用单因素方差分析,组间的两两比较采用LSD-t检验。 结果 在苍术酮处理细胞24、48 h后,与对照组同一时间相比,苍术酮低、中、高剂量组的细胞活性呈下降趋势,且差异均有统计学意义(P值均<0.05),苍术酮处理HepG2细胞72 h的半数抑制率为26.19 μmol/L。苍术酮低、中、高剂量组的细胞凋亡率分别为14.34%、29.32%和50.12%,均高于对照组(0.32%)(P值均<0.05)。与对照组比较,苍术酮低、中、高剂量组HepG2细胞中ROS的荧光强度明显升高(P值均<0.05)。在苍术酮处理HepG2细胞48 h后,与对照组比较,苍术酮低、中、高剂量组的细胞迁移数量明显降低(132.67 ± 18.36、57.00 ± 9.26、31.00 ± 2.45 vs 258.11 ± 38.54,P值均<0.05);与对照组比较,苍术酮低、中、高剂量组能显著抑制抗凋亡因子Bcl-2的表达,促进凋亡因子Bax和Cleaved caspase-3的表达,差异均有统计学意义(P值均<0.05)。 结论 苍术酮能够诱导HepG2细胞凋亡,并抑制其迁移,为进一步开发利用苍术酮提供一定的实验基础。 Abstract:Objective To investigate the effect of atractylone on the viability and apoptosis of hepatoma HepG2 cells and its mechanism of action. Methods Hepatoma HepG2 cells were selected and divided into low-, middle-, and high-dose atractylone groups (5, 10, and 20 μmol/L), and the cells in the control group were added with an equal volume of DMSO. MTT colorimetry was used to measure the viability of HepG2 cells after treatment with different concentrations of atractylone; flow cytometry was used to measure the apoptosis rate and mitochondrial membrane potential of HepG2 cells; the DCFH-DA fluorescent probe labeling method was used to measure the level of reactive oxygen species (ROS) in HepG2 cells; Transwell assay was used to evaluate the effect of atractylone on the migration ability of HepG2 cells; Western blot was used to measure the protein expression levels of Bcl-2, Bax, and cleaved caspase-3. A one-way analysis of variance was used for comparison of continuous data between multiple groups, and the least significant difference t-test was used for comparison between two groups. Results After 24 and 48 hours of treatment with atractylone, compared with the control group, the low-, middle-, and high-dose atractylone groups had a tendency of reduction in cell viability (all P < 0.05), with a half inhibitory concentration of 26.19 μmol/L in atractylone treatment of HepG2 cells for 72 hours. The low-, middle-, and high-dose atractylone groups had a significantly higher apoptosis rate than the control group (14.34%/29.32%/50.12% vs 0.32%, all P < 0.05). Compared with the control group, the low-, middle-, and high-dose atractylone groups had a significant increase in the fluorescence intensity of ROS in HepG2 cells (all P < 0.05). After 48 hours of treatment with atractylone, compared with the control group, the low-, middle-, and high-dose atractylone groups had a significant reduction in the number of migrated cells (132.67±18.36/57.00±9.26/31.00±2.45 vs 258.11±38.54, P < 0.05). Compared with the control group, the low-, middle-, and high-dose atractylone groups had a significant reduction in the expression of the anti-apoptotic factor Bcl-2 and significant increases in the expression of the apoptotic factors Bax and cleaved caspase-3 (all P < 0.05). Conclusion Atractylone can induce the apoptosis and inhibit the migration of HepG2 cells, which provides an experimental basis for further development and utilization of atractylone. -
Key words:
- Atractylone /
- Liver Neoplasms, Experimental /
- Cellular Activity /
- Apoptosis
-
肝癌是最常见的恶性肿瘤性疾病,据统计,2020年全球新增肝癌患者90.6万人(在所有新发癌症的占比4.7%),居全部癌症发病第6位,有83万人死于肝癌(在所有癌症中占比8.3%),居全部癌症死亡第3位[1]。在我国,肝癌的发病率和死亡率均占全球总数的50%以上,占亚洲总数的70%左右[2]。近年来,尽管肝癌的早期诊断技术和治疗水平不断提高,但患者的5年生存率仍不理想[3]。早期肝癌患者治疗方法有切除、肝移植或消融治疗等,但由于肝癌起病隐匿,一旦确诊常是晚期,晚期肝癌患者由于肿瘤负荷较大(伴有血管侵犯和肝外转移),介入治疗、消融治疗和放疗效果有限,肝癌治疗指南对晚期肝癌推荐全身系统性治疗[4-6]。中医药的治疗可贯穿肝癌治疗的全过程,在改善患者临床症状,减少术后复发和转移,提高患者生存质量等方面发挥着良好的协同作用[7]。近年来,中药及中药有效成分已成为开发新型抗肝癌药物的重要来源[8]。苍术酮(Atractylone)是一种从苍术(Atractylodeslancea)和北苍术(Atractylodes chinensis)中分离出来的倍半萜类成分,现代药理表明苍术酮具有多种药理活性,如改善溃疡病灶血液循环、利尿、抗炎、抗肿瘤、保肝、降血糖、抗菌、抗病毒和调节免疫等作用[9-10]。本实验探讨苍术酮对肝癌HepG2细胞增殖和凋亡的作用及其作用机制,为苍术酮的进一步开发利用提供理论和实验依据。
1. 材料与方法
1.1 材料与仪器
1.1.1 细胞株
肝癌HepG2细胞购自中国科学院上海细胞库,目录号为SCSP-510,由上海中医药大学附属曙光医院肝病研究所负责传代,培养。
1.1.2 药物
苍术饮片购自上海华东药业公司,由浙江中医药大学鉴定,标本(编号y20141022)存放于浙江医学院药学系。
1.1.3 试剂
胎牛血清(FBS,美国Gibco公司,批号10437-028);二甲基亚枫溶液(DMSO,上海源叶生物科技公司,批号20170204);高糖培养基(DMEM),青霉素-链霉素溶液(美国Hyclone公司,批号分别为SH3002201,sv30010);RIPA裂解液,胰酶细胞消化液,BCA蛋白浓度测定试剂盒,SDS-PAGE凝胶(上海碧云天生物技术有限公司,批号分别为P0013B,C0201,P0012,P0012A);MTT试剂盒(北京索莱宝科技有限公司,货号M1020);Annexin V-FITC凋亡试剂盒(美国BD公司,批号为559763);B细胞淋巴瘤因子(Bcl-2),Bcl-2相关x蛋白(Bax),甘油醛-3-磷酸脱氢酶(GAPDH)(武汉华美生物工程有限公司,批号分别为CSB-E08853h,CSB-E09344h,CSB-E13911h);半胱氨酸蛋白酶-3(Cleaved caspase-3,英国Abcam公司,批号ab13847)。
1.1.4 仪器
多功能酶标仪,转膜仪(美国Bio-Rad公司,型号分别为iMark,1704150);odyssey红外荧光成像系统(美国LI-COR公司,型号9120);CO2培养箱(美国Thermo公司,型号51030286)。
1.2 方法
1.2.1 苍术酮的制备
采用超临界二氧化碳萃取法对苍术酮进行提取,按照本课题组前期经验进行[11]。
1.2.2 细胞培养与分组
HepG2细胞在含10%FBS和1%双抗的培养基中培养,置于37 ℃,5%CO2的培养箱中孵育,待细胞生长密度达到80%时,用胰酶消化传代培养。实验分为4组:空白对照组,苍术酮低剂量组(5 μmol/L)、中剂量组(10 μmol/L)、高剂量组(20 μmol/L)。
1.2.3 MTT法检测HepG2细胞活性
将HepG2细胞悬液以每孔100 μL接种于96孔板中(1×104/孔),孵育过夜。苍术酮用药组分别加入含有不同浓度的苍术酮(5、10、20 μmol/L)的溶液,对照组加入等体积的0.1%DMSO。分别孵育24、48、72 h,孵育结束后加入20 μL MTT溶液(5 mg/mL),在培养箱中孵育4 h。实验结束后,吸弃上清液,加入150 μL DMSO,37 ℃条件下震荡10 min溶解沉淀。使用酶标仪测定细胞在570 nm处的吸光度(OD值)。
1.2.4 流式细胞术检测HepG2细胞凋亡
将HepG2细胞悬液以每孔100 μL接种于6孔板中(1×106/孔),分组培养24 h,收集细胞并用预冷的PBS洗涤细胞2次。根据Annexin V-FITC凋亡试剂盒说明书对细胞进行染色,并通过流式细胞仪检测凋亡细胞。
1.2.5 流式细胞术检测HepG2细胞线粒体膜电位
将HepG2细胞悬液以每孔100 μL接种于6孔板中(1×106/孔),培养箱中孵育过夜。待细胞贴壁后分组培养24 h,培养结束后,使用PBS洗涤2次。加入1 mL Rhodamine 123(5 μg/mL)溶液,培养箱中孵育30 min,使用预冷的PBS洗涤细胞2次,流式细胞仪检测线粒体膜电位。
1.2.6 DCFH-DA法检测HepG2细胞内活性氧(ROS)水平
将HepG2细胞悬液以每孔100 μL接种于6孔板中(1×106/孔), 待细胞贴壁后分组培养48 h,培养结束后,使用PBS洗涤2次,更换DCFH-DA培养基,按照ROS试剂盒说明书进行后续操作,在荧光显微镜下观察细胞荧光强度。
1.2.7 蛋白质印迹法检测各组细胞中Bcl-2、Bax及Cleaved caspase-3的表达
将HepG2细胞悬液以每孔100 μL接种于6孔板中(1×106/孔),在培养箱中孵育过夜。吸弃旧液,分组培养48 h,PBS洗涤细胞2次,使用含有PMSF的RIPA裂解液提取细胞的总蛋白质,收集的细胞在4 ℃下以1000 g离心25 min。BCA试剂盒测定细胞蛋白浓度,SDS-PAGE电泳和抗体孵育,ECL化学发光试剂显色使蛋白质条带可视化,获取Bcl-2、Bax、Cleaved caspase-3和GAPDH[12]的条带图片,并在Image J系统6.0版本下进行定量分析。
1.2.8 Transwell实验检测苍术酮对HepG2细胞迁移和侵袭的影响
取对数期生长的HepG2细胞给予不同浓度的苍术酮分组培养24 h。收集细胞,离心,将HepG2细胞悬液按200 μL/室(5×104/孔)加入Transwell小室的上室,同时将500 μL含10%FBS的培养基加入到下室,于37 ℃、5%CO2培养箱内孵育24 h。吸弃培养基,并弃去上室未迁移的细胞,用预冷的95%乙醇固定10 min,0.1%结晶紫染色15 min,光学显微镜下观察,随机选择5个视野计数迁移的细胞数量。
1.3 统计学方法
应用SPSS21.0统计学软件对数据进行统计处理,计量资料以x±s表示,多样间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异具有统计学意义。
2. 结果
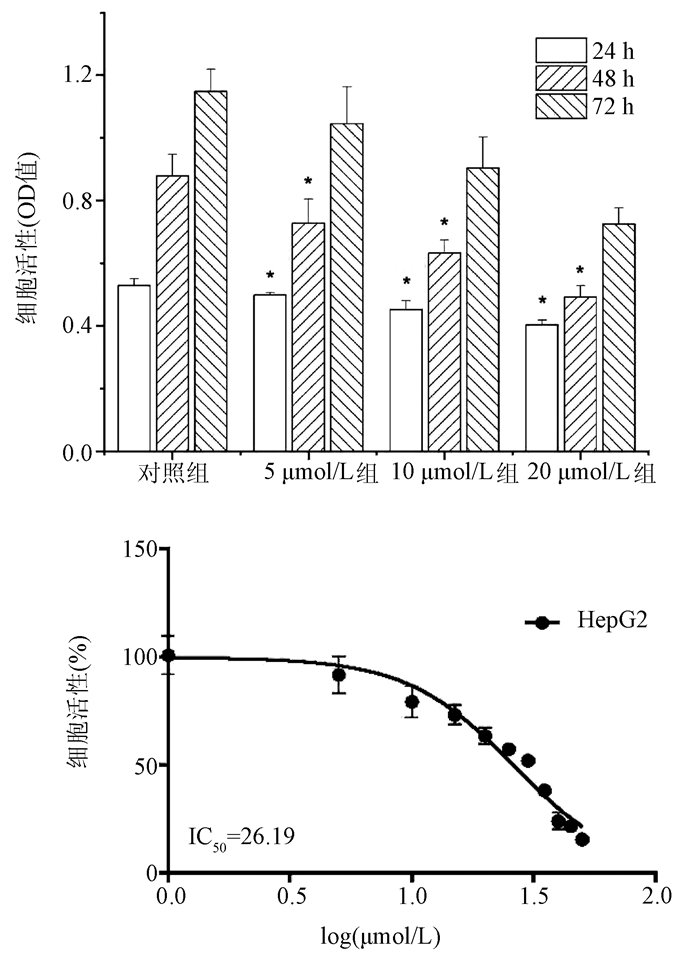
2.1 苍术酮对HepG2细胞增殖抑制的影响
苍术酮处理肝癌HepG2细胞24、48、72 h后,MTT法检测HepG2细胞活性。在苍术酮处理细胞24、48 h后,与对照组同一时间相比,苍术酮低、中、高剂量组的细胞活性呈下降趋势,且差异均有统计学意义(P值均<0.05)(图 1)。此外,苍术酮处理HepG2细胞72 h的半数抑制率(IC50值)为26.19 μmol/L(图 1)。
2.2 苍术酮对HepG2细胞凋亡的影响
对照组和苍术酮低、中、高剂量组的细胞凋亡率分别为0.32%、14.34%、29.32%和50.12%,HepG2细胞凋亡率随着苍术酮药物浓度的增加而升高,与对照组比较,差异均有统计学意义(P值均<0.05);中、高剂量组细胞的凋亡率,与低剂量组比较,差异亦有统计学意义(P值均<0.05)(图 2)。
2.3 苍术酮对HepG2细胞线粒体膜电位丢失的影响
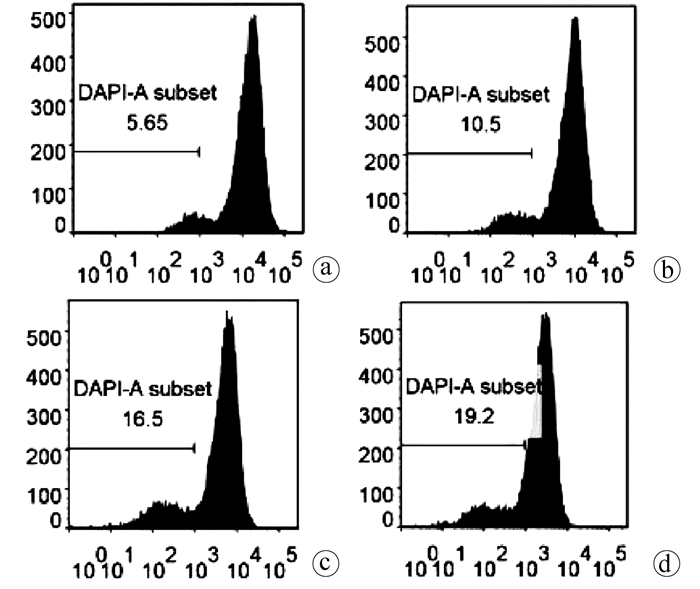
如图 3所示,对照组有5.65%的细胞丢失膜电位,苍术酮低、中、高剂量组分别有10.5%、16.5%和19.2%的细胞损失线粒体膜电位,4组间差异无统计学意义(P>0.05)。
2.4 苍术酮对HepG2细胞内ROS水平的影响
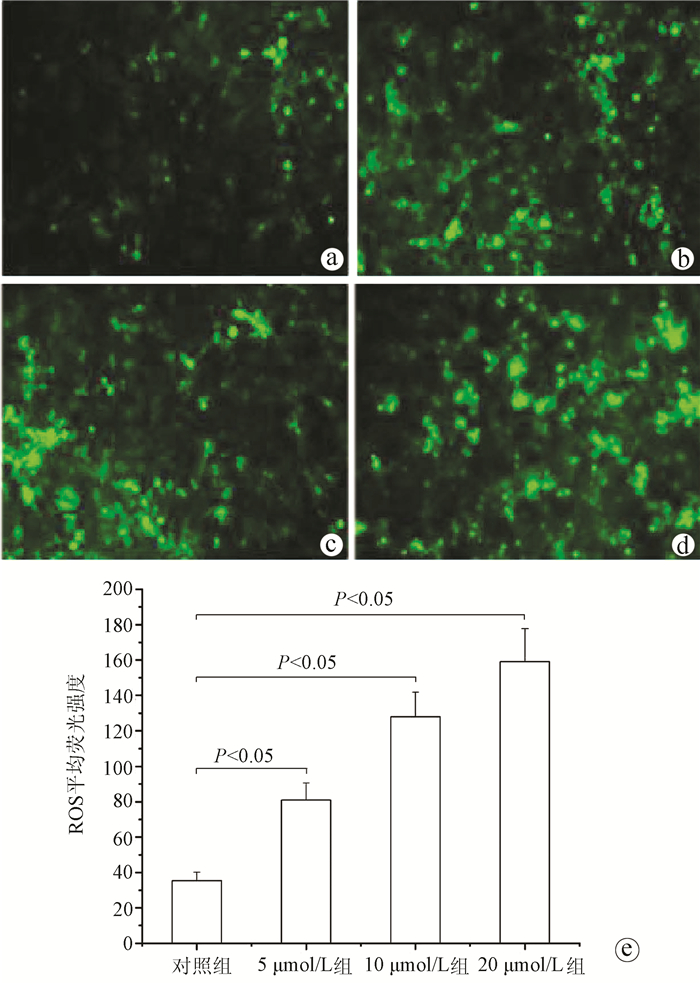
如图 4所示,对照组HepG2细胞中ROS的荧光强度较低,经不同浓度的苍术酮处理后,与对照组比较,苍术酮低、中、高剂量组HepG2细胞中ROS的荧光强度明显升高(P值均<0.05)。
2.5 苍术酮对HepG2细胞迁移的影响
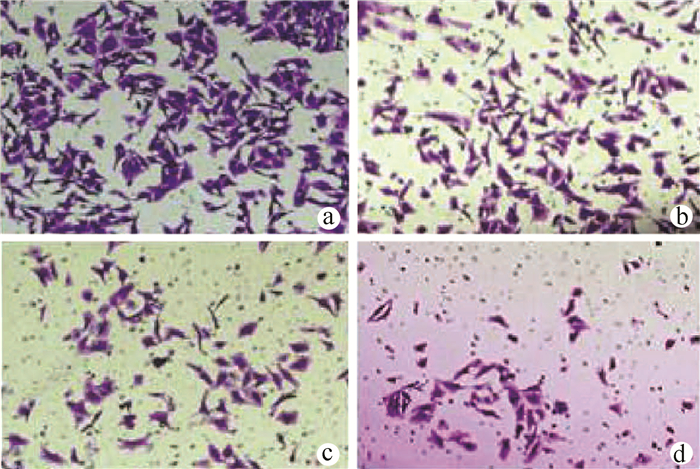
如图 5和表 1所示,在对照组中,大量的HepG2细胞从上室迁移到下室,在苍术酮处理HepG2细胞48 h后,随着苍术酮药物浓度的增加,对HepG2细胞迁移抑制效应也逐渐增加。与对照组比较,苍术酮低、中、高剂量组的细胞迁移数量明显降低(P值均<0.05);中、高剂量组的细胞迁移数量明显低于低剂量组(P值均<0.05)。
表 1 苍术酮对HepG2细胞迁移的影响组别 迁移数量 对照组 258.11±38.54 5 μmol/L组 132.67±18.361) 10 μmol/L组 57.00±9.261)2) 20 μmol/L组 31.00±2.451)2) 注:与对照组比较,1)P<0.05;与5 μmol/L组比较,2)P<0.05。 2.6 苍术酮对HepG2细胞Bcl-2,Bax和Cleaved caspase-3蛋白表达的影响
如图 6所示,与对照组比较,苍术酮低、中、高剂量组能显著抑制抗凋亡因子Bcl-2的表达,促进凋亡因子Bax和Cleaved caspase-3的表达,差异均有统计学意义(P值均<0.05)。对照组和苍术酮用药组的Bax/ Bcl-2蛋白的比率分别为0.20、0.31、1.60、3.78。
3. 讨论
古代文献并无“肝癌”病名,根据该疾病的典型特征和临床表现,可将其归属于中医“癥瘕”“胁胀”“肝积”“伏梁”“黄疸”“肝著”“积聚”等[7]。苍术是多年生菊科植物苍术的干燥根茎,味辛、苦,性温,归脾、胃、肝经,有燥湿健脾、祛风散寒、明目等功效,常用于治疗湿阻中焦、脘腹胀满、泄泻、水肿、风湿痹痛、风寒感冒、夜盲、眼干涩等病症[13],有研究[14]报道苍术对肺癌、胃癌、食管癌、胆管癌、肝癌等有抑制作用,表现出抗肿瘤的药理活性。苍术酮是从苍术中分离出来的倍半萜类化合物,是中药苍术的有效成分之一,周域等[15]研究发现苍术酮能与维甲酸β受体紧密结合,产生维甲酸样抗肿瘤作用。耿炜等[16]研究发现苍术酮能抑制结直肠癌细胞HT29细胞的增殖,并促进细胞凋亡,有抗结直肠癌的作用。本研究主要探讨苍术酮对肝癌HepG2细胞凋亡和迁移的作用和其可能作用机制,为苍术酮应用与肝癌的临床应用提供理论依据。
细胞凋亡又称为细胞程序性死亡,是由外界刺激因素诱发后,经一系列基因活化及调控细胞有序的、自主的主动死亡过程[17],细胞凋亡在细胞发育、组织稳态以及对抗有害和潜在危险细胞的防御机制中发挥着重要作用,线粒体信号通路在细胞凋亡中发挥着较为重要的作用[18]。线粒体损伤的特征是线粒体膜电位的丢失使膜通透性增加,线粒体中细胞凋亡因子如细胞色素C释放到细胞质中,在细胞质中形成凋亡复合物,诱导细胞凋亡[19]。此外,ROS可促进细胞色素C从线粒体上解离,因此ROS水平升高可进一步介导线粒体途径细胞凋亡[20]。本研究表明苍术酮可显著促进肝癌HepG2细胞凋亡,并诱导线粒体膜电位的丢失,增加肝癌HepG2细胞内ROS水平,进一步促进线粒体膜通透性增加和线粒体膜电位的丢失。
研究[21]表明,在众多的凋亡相关基因中,Bcl-2基因家族在凋亡过程中起重要调节作用,它可以在细胞周期的任何阶段直接抑制细胞凋亡,延长细胞存活周期并诱发细胞癌变[22]。在正常状态下,Bax存在于细胞质中并与Bcl-2结合形成异二聚体,从而使促凋亡蛋白稳定于细胞质中,并抑制细胞凋亡[23]。Bax/Bcl-2的比率是诱导细胞凋亡作用强弱的关键因素[24-25],若Bcl-2蛋白的含量相对下降,Bax将移位于线粒体膜上,刺激线粒体释放促凋亡因子,激活caspase级联反应,诱导细胞凋亡[26]。Caspase-3是caspase家族中参与细胞凋亡的关键蛋白酶之一,并位于细胞凋亡信号传导通路的中心位置,Cleaved caspase-3是裂解后的caspase-3,是诱导凋亡的关键因子,是反映细胞凋亡可靠的指标[27-28]。本研究表明苍术酮显著增加促凋亡蛋白Bax和Cleaved caspase-3的表达水平,降低抗凋亡蛋白Bcl-2的表达。这些结果表明,苍术酮可能是通过降低线粒体膜电位,增加细胞内ROS水平,诱导的细胞凋亡。
综上所述,本研究表明苍术酮对HepG2细胞具有体外其抑制活性、迁移的作用,并通过线粒体途径诱导细胞凋亡。该研究结果为后续苍术酮在体内对肝癌活性的研究和进一步研究其抑制肿瘤迁移的作用机制提供实验基础,并为苍术酮治疗肝癌的临床应用提供参考。
-
表 1 苍术酮对HepG2细胞迁移的影响
组别 迁移数量 对照组 258.11±38.54 5 μmol/L组 132.67±18.361) 10 μmol/L组 57.00±9.261)2) 20 μmol/L组 31.00±2.451)2) 注:与对照组比较,1)P<0.05;与5 μmol/L组比较,2)P<0.05。 -
[1] SUNG H, FERLAY J, SIEGEL RL, et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI: 10.3322/caac.21660. [2] WU YX, SHENG QS. Advances in traditional Chinese medicine therapy for primary hepatocarcinoma[J]. Guangxi Med J, 2020, 42(4): 483-485. DOI: 10.1165/j.issn.0253-4304.2020.04.26.吴玉潇, 盛庆寿. 中医药治疗原发性肝癌的研究进展[J]. 广西医学, 2020, 42(4): 483-485. DOI: 10.11675/j.issn.0253-4304.2020.04.26. [3] LI ZW. Analysis of postoperative prognosis and risk factors in patients with primary liver cancer[J]. China's Naturopathy, 2020, 28(13): 73-75. DOI: 10.19621/j.cnki.11-3555/r.2020.1334.李柱威. 原发性肝癌患者术后预后及其危险因素分析[J]. 中国民间疗法, 2020, 28(13): 73-75. DOI: 10.19621/j.cnki.11-3555/r.2020.1334. [4] FORNER A, REIG ME, de LOPE CR, et al. Current strategy for staging and treatment: The BCLC update and future prospects[J]. Semin Liver Dis, 2010, 30(1): 61-74. DOI: 10.1055/s-0030-1247133. [5] HUANG JH, HUANG ZM, ZHANG TQ, et al. Progress in comprehensive treatment of advanced liver cancer based on interventional therapy[J/CD]. Electronic J Liver Tumor, 2019, 6(4): 27-31. DOI: 10.3969/j.issn.2095-7815.2019.04.007.黄金华, 黄职妹, 张天奇, 等. 以介入治疗为基础的中晚期肝癌综合治疗进展[J/CD]. 肝癌电子杂志, 2019, 6(4): 27-31. DOI: 10.3969/j.issn.2095-7815.2019.04.007. [6] YUAN SX, ZHOU WP. Progress and hot spots of comprehensive treatment for primary liver cancer[J]. Chin J Dig Surg, 2021, 20(2): 163-170. DOI: 10.3760/cma.j.cn115610-20201211-00776.袁声贤, 周伟平. 原发性肝癌综合治疗的进展和热点[J]. 中华消化外科杂志, 2021, 20(2): 163-170. DOI: 10.3760/cma.j.cn115610-20201211-00776. [7] ZHAN YP, ZHAI XF. Study on prescription compatibility law of contemporary famous doctors of TCM in treating primary liver cancer based on data mining[J]. J Liaoning Univ Tradit Chin Med, 2018, 20(3): 159-162. DOI: 10.13194/j.issn.1673-842x.2018.03.046.占义平, 翟笑枫. 基于数据挖掘当代名中医治疗原发性肝癌用药配伍规律研究[J]. 辽宁中医药大学学报, 2018, 20(3): 159-162. DOI: 10.13194/j.issn.1673-842x.2018.03.046. [8] ZHANG Y, CHEN HG, ZHAO C, et al. Research progress on anti-hepatocellular carcinoma mechanism of active ingredients of traditional Chinese medicine[J]. China J Chin Mater Med, 2020, 45(14): 3395-3406. DOI: 10.19540/j.cnki.cjcmm.20200429.601.张宇, 陈华国, 赵超, 等. 中药有效成分抗肝癌作用机制研究进展[J]. 中国中药杂志, 2020, 45(14): 3395-3406. DOI: 10.19540/j.cnki.cjcmm.20200429.601. [9] ZHAO ZJ, XIAO SN, ZHAO YX, et al. Re-evaluation of the literature on the pharmacological effects of Atractylodes macrocephala[J]. Chin J Hosp Pharm, 2011, 31(7): 607-609. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGYZ201107035.htm赵子剑, 肖胜男, 赵永新, 等. 苍术药理作用的文献再评价[J]. 中国医院药学杂志, 2011, 31(7): 607-609. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGYZ201107035.htm [10] LIU C. Progress of medicinal research on Atractylodes macrocephala[J]. Heilongjiang Sci Technol Inform, 2013, 12: 101. DOI: 10.3969/j.issn.1673-1328.2013.12.099.刘畅. 苍术药用研究进展[J]. 黑龙江科技信息, 2013, 12: 101. DOI: 10.3969/j.issn.1673-1328.2013.12.099. [11] CHEN TY, LIU YL, HOU TL, et al. Study on the protective effect of atractylone on acute lung injury in mice[J]. Mod J Integr Tradit Chin West Med, 2018, 27(24): 2623-2626. DOI: 10.3969/j.issn.1008-8849.2018.24.001.陈天阳, 刘廷亮, 侯天禄, 等. 苍术酮对急性肺损伤小鼠保护作用的研究[J]. 现代中西医结合杂志, 2018, 27(24): 2623-2626. DOI: 10.3969/j.issn.1008-8849.2018.24.001. [12] ATHINARAYANAN S, FAN YY, WANG X, et al. Fatty acid desaturase 1 influences hepatic lipid homeostasis by modulating the PPARα-FGF21 axis[J]. Hepatol Commun, 2021, 5(3): 461-477. DOI: 10.1002/hep4.1629. [13] SUN YP, CHENG Z, WU Z, et al. Research on the inheritance, innovation and high-quality development of Chinese herbal medicine Atractylodes[J]. Hubei Agricult Sci, 2020, 59(11): 203-207. DOI: 10.14088/j.cnki.issn0439-8114.2020.11.040.孙元鹏, 程正, 吴喆, 等. 中药材苍术的传承创新与高质量发展研究[J]. 湖北农业科学, 2020, 59(11): 203-207. DOI: 10.14088/j.cnki.issn0439-8114.2020.11.040. [14] ZHANG MF, SHEN YQ. Advances in studies on anti-inflammation, antitumor, and immunoregulation of Atractylodis Rhizoma[J]. Drug Eval Res, 2016, 39(5): 885-890. DOI: 10.7501/j.issn.1674-6376.2016.05.037.张明发, 沈雅琴. 苍术抗炎、抗肿瘤和免疫调节作用的研究进展[J]. 药物评价研究, 2016, 39(5): 885-890. DOI: 10.7501/j.issn.1674-6376.2016.05.037. [15] ZHOU Y, LU JT, ZHANG XD, et al. Potential target prediction and forward molecular docking verification of atractylon[J]. J Shaoyang Uni(Natural Science Edition), 2019, 16(1): 98-104. DOI: CNKI:SUN:SYXZ.0.2019-01-013.周域, 陆建图, 张小丁, 等. 苍术酮潜在靶点预测及正向分子对接验证[J]. 邵阳学院学报(自然科学版), 2019, 16(1): 98-104. DOI: CNKI:SUN:SYXZ.0.2019-01-013. [16] GENG W, LIANG W, YE ZB, et al. Mechanism of HT29 apoptosis in colorectal cancer cells by atractylone[J]. Chin Tradit Patent Med, 2018, 40(4): 937-940. DOI: 10.3969/j.issn.1001-1528.2018.04.034.耿玮, 梁巍, 叶智斌, 等. 苍术酮对结直肠癌细胞HT29凋亡的机制[J]. 中成药, 2018, 40(4): 937-940. DOI: 10.3969/j.issn.1001-1528.2018.04.034. [17] YAO XY, DOU FF. Role of apoptosis in traditional Chinese medicine treatment of liver cancer[J]. Pract J Cancer, 2020, 35(6): 1040-1044. DOI: 10.3969/j.issn.1001-5930.2020.06.046.姚晓云, 钭方芳. 凋亡在中医药治疗肝癌中的作用研究[J]. 实用癌症杂志, 2020, 35(6): 1040-1044. DOI: 10.3969/j.issn.1001-5930.2020.06.046. [18] SHAHAR N, LARISCH S. Inhibiting the inhibitors: Targeting anti-apoptotic proteins in cancer and therapy resistance[J]. Drug Resist Updat, 2020, 52: 100712. DOI: 10.1016/j.drup.2020.100712. [19] QIAO Z, CHENG Y, LIU S, et al. Casticin inhibits esophageal cancer cell proliferation and promotes apoptosis by regulating mitochondrial apoptotic and JNK signaling pathways[J]. Naunyn Schmiedebergs Arch Pharmacol, 2019, 392(2): 177-187. DOI: 10.1007/s00210-018-1574-5. [20] ZHANG Y, WANG Y, ZHAO Y, et al. Novel camphor-based pyrimidine derivatives induced cancer cell death through a ROS-mediated mitochondrial apoptosis pathway[J]. RSC Adv, 2019, 9(51): 29711-29720. DOI: 10.1039/C9RA05900H. [21] ZHONG FR, CHENG HL, ZHANG H, et al. Effect of kaempferol on the proliferation, migration, invasion, and apoptosis of human hepatoma Bel-7402 cells[J]. J Clin Hepatol, 2020, 36(12): 2725-2729. DOI: 10.3969/j.issn.1001-5256.2020.12.017.仲富瑞, 程宦立, 张浩, 等. 山萘酚对人肝癌Bel-7402细胞增殖、迁移、侵袭及凋亡的影响[J]. 临床肝胆病杂志, 2020, 36(12): 2725-2729. DOI: 10.3969/j.issn.1001-5256.2020.12.017. [22] LI R, ZOU X, ZHU T, et al. Destruction of neutrophil extracellular traps promotesthe apoptosis and inhibits the invasion of gastric cancer cells by regulating the expression of Bcl-2, Bax and NF-κB[J]. Onco Targets Ther, 2020, 13: 5271-5281. DOI: 10.2147/OTT.S227331. [23] EDLICH F. The great migration of Bax and Bak[J]. Mol Cell Oncol, 2015, 2(3): e995029. DOI: 10.4161/23723556.2014.995029. [24] GUO DF, WANG RT, HUANG JC, et al. Curcumin derivative C086 induces the apoptosis of hepatoma HepG2 cells via the PI3K-Akt pathway[J]. Chin J Gerontol, 2021, 41(6): 1270-1274. DOI: 10.3969/j.issn.1005-9202.2021.06.042.郭登方, 王若涛, 黄建成, 等. 姜黄素衍生物C086通过PI3K-Akt通路诱导肝癌HepG2细胞凋亡[J]. 中国老年学杂志, 2021, 41(6): 1270-1274. DOI: 10.3969/j.issn.1005-9202.2021.06.042. [25] WU XY, ZHAO YN, WANG XJ, et al. Effect of galectin-3 expression suppression on expressions of Bcl-2 and Bax in gastric cancer MGC-803 cells and its promotion on apoptosis[J]. J Jilin Univ(Med Edit), 2020, 46(2): 335-339. DOI: 10.13481/j.1671-587x.20200221.吴雪艳, 赵依纳, 王小杰, 等. 半乳糖凝集素3表达抑制对人胃癌MGC-803细胞中Bcl-2和Bax表达的影响及其促凋亡作用[J]. 吉林大学学报(医学版), 2020, 46(2): 335-339, 前插3. DOI: 10.13481/j.1671-587x.20200221. [26] FU K, SUI GC, SHI JM. Inhibitory effect of triterpenoid saponins from Dioscorea gracillima on human hepatoma HepG2 cells[J/CD]. Cardiovasc Dis J Integr Tradit Chin Western Med (Electronic), 2020, 8(1): 67-68. DOI: 10.16282/j.cnki.cn11-9336/r.2020.01.052.付康, 隋广超, 史金铭. 三萜纤细薯蓣皂苷对人肝癌HepG2细胞的抑制作用研究[J/CD]. 中西医结合心血管病电子杂志, 2020, 8(1): 67-68. DOI: 10.16282/j.cnki.cn11-9336/r.2020.01.052. [27] NIE SS, LI X, ZHAO YH, et al. Effect of modified Si Junzitang drug serum on expression of apoptosis-related molecules of gastric cancer cell SGC-7901[J]. Chin J Exp Med Formul, 2019, 25(9): 25-30. DOI: 10.13422/j.cnki.syfjx.20190824.聂闪闪, 李洵, 赵玉航, 等. 加味四君子汤含药血清对胃癌细胞SGC-7901凋亡相关因子表达的影响[J]. 中国实验方剂学杂志, 2019, 25(9): 25-30. DOI: 10.13422/j.cnki.syfjx.20190824. [28] MAO M, HUA Y, JIANG X, et al. Expression of tumor necrosis factor alpha and neuronal apoptosis in the developing rat brain after neonatal stroke[J]. Neurosci Lett, 2006, 403(3): 227-232. DOI: 10.1016/j.neulet.2006.03.078. 期刊类型引用(16)
1. 李志豪,王小嘉,赵寒,许向前,周子朋,郑福增. 平胃散药理及临床应用研究进展. 中医学报. 2025(02): 366-376 .  百度学术
百度学术2. 南洋,饶凌峰,王卉. 基于数据挖掘探讨苍术-厚朴药治疗新冠肺炎的作用机制. 生物技术. 2025(01): 37-43 .  百度学术
百度学术3. 刘百坤,王志茹,赵文静. 五倍子酸对肝癌HepG2细胞索拉非尼化疗增敏作用. 临床肝胆病杂志. 2025(02): 292-299 .  本站查看
本站查看4. 刘棣文,何莉莉,崔娜,王秋红. 白术化学成分、药理作用研究进展及质量标志物预测. 中医药信息. 2024(01): 65-78 .  百度学术
百度学术5. 李春沁,凌海燕,开拓,杨安东,杨军. 白术高效液相色谱指纹图谱及多指标成分含量测定研究. 中药新药与临床药理. 2024(03): 419-426 .  百度学术
百度学术6. 严世豪,黎红,赵蓓蓓,龚文慧,辛力,郭静英,郑郁清,张金莲. 苍术中有效成分抗肿瘤作用机制研究进展. 中草药. 2024(11): 3916-3926 .  百度学术
百度学术7. 许悦,吴浩嘉,李睿思,徐晓颖,黄海堂,吕晓娟,廖楚,叶俊秋,李恒飞. 苍术酮联合厚朴酚有效抑制HepG2增殖:从回顾性分析到实验研究. 时珍国医国药. 2024(08): 2040-2043 .  百度学术
百度学术8. 秦晨歌,岳利多,李明,范理宏. 黄精-苍术药对通过Apex1/STAT3轴调控肺癌进展机制. 中华中医药杂志. 2024(10): 5519-5523 .  百度学术
百度学术9. 唐凌,陈莉,张聪. 基于Notch1通路探讨苍术酮对肝癌细胞化疗耐药的作用机制研究. 中医药导报. 2023(04): 11-16 .  百度学术
百度学术10. 郭秀丽,宋成程,肖扬鑫,董妍,成焕波,涂济源,刘艳菊. 麸炒茅苍术及其不同物化形式标准汤剂中挥发油的量质传递规律分析. 中国实验方剂学杂志. 2023(12): 168-174 .  百度学术
百度学术11. 秦聪聪,杜沁圆,张义敏,孙美灵,展照双,王加锋. 苍术挥发油化学成分及药理作用研究进展. 中成药. 2023(06): 1944-1952 .  百度学术
百度学术12. 孙鹏,王汉,张炜崧,桑子淇,刘玉茹,叶桐,刘铁军. 基于网络药理学预测肝爽颗粒治疗肝癌的作用机制. 特产研究. 2023(04): 47-56+68 .  百度学术
百度学术13. 高晨峰,刘斌,陈小凤,廖卫国,黄小杰,杨腾,于立明,兰青. JS-K对口腔鳞状细胞癌H157和CAL-27细胞增殖与凋亡的影响及机制实验研究. 陕西医学杂志. 2023(12): 1631-1641+1647 .  百度学术
百度学术14. 麦静愔,陈澍,柯碧莲,何青青,王浩艺,平键,陈建杰,成扬. 苍术酮对肝癌荷瘤小鼠肿瘤生长、上皮-间充质转化和凋亡标志物表达的影响. 中医药信息. 2022(06): 28-32 .  百度学术
百度学术15. 徐辉,焦响乐,郑玉宽,杨静,郭慧,李晓天. 穿心莲内酯对人肝癌HepG2细胞增殖、凋亡和迁移的影响. 中医研究. 2022(08): 65-69 .  百度学术
百度学术16. 韦柳婷,胡振斌,高松林,韦湘红,黄玲珊,吴凡. 基于网络药理学和分子对接的五苓散治疗肝硬化腹水作用机制探讨. 中国现代中药. 2022(12): 2391-2399 .  百度学术
百度学术其他类型引用(9)
-




 PDF下载 ( 4218 KB)
PDF下载 ( 4218 KB)


 下载:
下载:





 下载:
下载:


 百度学术
百度学术







