微波消融与手术切除治疗肝细胞癌合并肝硬化效果及安全性的Meta分析
DOI: 10.12449/JCH240915
Efficacy and safety of microwave ablation versus hepatic resection in treatment of hepatocellular carcinoma with liver cirrhosis: A Meta-analysis
-
摘要:
目的 通过Meta分析系统评价微波消融(MWA)和手术切除(HR)在肝细胞癌(HCC)合并肝硬化中的有效性及安全性。 方法 本研究根据PRISMA指南完成,PROSPERO注册号:CRD42024509185。检索PubMed、Cochrane Library、EMBASE、Web of Science、中国知网、维普、万方数据库,时间均为从建库至2023年11月,搜索MWA对比HR治疗HCC合并肝硬化的随机对照试验(RCT)和队列研究,采用Stata 12.0软件进行Meta分析。 结果 共纳入3项RCT和5项回顾性队列研究,共953例患者。Meta分析显示:MWA的1/2/3/5年总生存率(OS)与HR相比无统计学差异(P值均>0.05)。MWA的1/2/5年复发率与HR相比无统计学差异(P值均>0.05)。MWA的3年复发率高于HR(RR=1.59,95%CI:1.08~2.33,P=0.017)。MWA的1/3/5年无复发生存率(DFS)低于HR(RR=0.94,95%CI:0.89~0.99,P=0.018,I2=0.0%;RR=0.84,95%CI:0.72~0.98,P=0.023,I2=25.4%;RR=0.75,95%CI:0.58~0.98,P=0.032,I2=34.6%)。但亚组分析表明,在RCT组,MWA的1/2/3年OS和1/3年DFS与HR相比无统计学差异(P值均>0.05)。MWA的术中出血量、手术时间、住院时间、不良反应及肝功能均优于HR(SMD=-2.31,95%CI:-2.64~-1.97,P<0.001,I2=3.1%;SMD=-3.38,95%CI:-4.05~-2.71,P<0.001,I2=73.8%;SMD=-2.54,95%CI:-3.27~-1.80,P<0.001,I2=92.8%;RR=0.42,95%CI:0.30~0.59,P<0.001,I2=0.0%;SMD=-1.43,95%CI:-1.89~-0.97,P<0.001)。 结论 MWA与HR在局部复发、DFS及OS方面无明显差异。MWA术中出血量更少,手术时间更短,不良反应更少,对肝功能影响更小,住院时间更短。 Abstract:Objective To investigate the efficacy and safety of microwave ablation (MWA) versus hepatic resection (HR) in the treatment of hepatocellular carcinoma (HCC) with liver cirrhosis using a meta-analysis. Methods This study was conducted according to the PRISMA guideline, with a PROSPERO registration number of CRD42024509185. PubMed, the Cochrane Library, EMBASE, Web of Science, CNKI, VIP, and Wanfang Data were searched for randomized controlled trials (RCTs) and cohort studies on MWA versus HR in the treatment of HCC with liver cirrhosis published up to November 2023, and Stata 12.0 was used to perform the meta-analysis. Results A total of 3 RCTs and 5 retrospective cohort studies were included, with 953 patients in total. The meta-analysis showed that there were no differences between MWA and HR in 1-, 2-, 3-, and 5-year overall survival (OS) rates (all P>0.05) and 1-, 2-, and 5-year recurrence rates (all P>0.05). Compared with HR, MWA had a significantly higher 3-year recurrence rate (risk ratio [RR]=1.59, 95% confidence interval [CI]: 1.08 — 2.33, P=0.017) and significantly lower 1-, 3-, and 5-year disease-free survival (DFS) rates (1-year DFS rate: RR=0.94, 95%CI: 0.89 — 0.99, P=0.018, I2=0.0%; 3-year DFS rate: RR=0.84, 95%CI: 0.72 — 0.98, P=0.023, I2=25.4%; 5-year DFS rate: RR=0.75, 95%CI: 0.58 — 0.98, P=0.032, I2=34.6%). However, subgroup analysis showed that there were no significant differences between MWA and HR in 1-, 2-, and 3-year OS rates and 1- and 3-year DFS rates in the RCT subgroup (all P>0.05). Compared with HR, MWA had significantly better intraoperative blood loss (standardized mean difference [SMD]=-2.31, 95%CI: -2.64 to -1.97, P<0.001, I2=3.1%), time of operation (SMD=-3.38, 95%CI: -4.05 to -2.71, P<0.001, I2=73.8%), length of hospital stay (SMD=-2.54, 95%CI: -3.27 to -1.80, P<0.001, I2=92.8%), adverse reactions (RR=0.42, 95%CI: 0.30 — 0.59, P<0.001, I2=0.0%), and liver function (SMD=-1.43, 95%CI: -1.89 — -0.97, P<0.001). Conclusion There are no significant differences between MWA and HR in local recurrence, DFS, and OS, but MWA tends to have a less intraoperative blood loss, a shorter time of operation, fewer adverse reactions, a less impact on liver function, and a shorter length of hospital stay. -
Key words:
- Carcinoma, Hepatocellular /
- Liver Cirrhosis /
- Meta-Analysis
-
肝细胞癌(HCC)是全球引起肿瘤相关死亡的第三大原因[1-3],目前,肝移植是HCC的最佳治疗方案[4-6],但仅少数患者能够接受肝移植[7-8]。因此,肝切除(hepatic resection,HR)仍然是HCC的首选方案[9-10]。但遗憾的是,HR后3年复发率高达50%,5年总生存率(OS)只有40%~60%[11-13]。微波消融(microwave ablation,MWA)与HR相比具有类似的疗效,但其具有创伤小、不良反应少、对肝功能影响小等特点[14-16]。
然而,HR与MWA的疗效仍存在争议[17-20]。HCC多由肝硬化发展而来,这意味着患者肝功能储备更差,疗效更具不确定性,且肝硬化是影响HCC复发的独立因素[21-23],所以,MWA与HR治疗HCC合并肝硬化的效果及安全性更具有争议,且无相关Meta分析。近年来,关于MWA与HR疗效对比的临床研究越来越丰富[24-31],因此,本研究旨在收集MWA和HR治疗HCC合并肝硬化的相关文献,系统评价其临床疗效及安全性,为临床决策提供依据。
1. 资料与方法
1.1 规程与注册
本研究根据PRISMA指南完成,PROSPERO注册号:CRD42024509185。
1.2 检索策略
计算机检索PubMed、Cochrane Library、EMBASE、Web of Science、中国知网、维普、万方数据库,时间均为从建库至2023年11月。同时手工检索已发表的会议论文等。采用主题词+自由词的方式,英文检索词:resection、hepatectomy、surgery、ablation、liver cancer、liver neoplasm、primary hepatic carcinoma、hepatocellular carcinoma、cirrhosis、cirrhotic、hepatocirrhosis。中文检索词:微波消融、热消融、肝癌、肝肿瘤、原发性肝癌、肝细胞癌、肝硬化、外科切除、切除。
1.3 纳入标准
1.3.1 研究类型
随机对照试验(randomized controlled trial,RCT)或回顾性队列研究(retrospective cohort study,RCS)或前瞻性队列研究。
1.3.2 研究对象
HCC合并肝硬化患者。
1.3.3 干预措施
观察组采用MWA,对照组采用HR。
1.3.4 结局指标
(1)OS;(2)局部复发(local recurrence,LR);(3)无复发生存率(DFS);(4)肝功能;(5)不良反应;(6)手术时间;(7)出血量;(8)住院时间。
1.4 排除标准
(1)转移性肝癌或复发性肝癌;(2)不同语言撰写的同一篇文章;(3)个案报道;(4)无法提取结局指标的文献;(5)单臂研究。
1.5 文献筛选与资料提取
由两名研究者独立筛选文献、提取资料并交叉核对,如有分歧,则由第三方协商解决。提取(1)一般信息:第一作者、年份、类型、国家、干预措施;(2)临床数据:患者年龄、男女比例、病例数、肝功能、肿瘤大小等基线信息、随访时间、上述结局指标。
1.6 偏倚风险及质量评估
两名研究者独立进行文献质量评价、讨论,直至获得一致的结果。非RCT使用Newcastle-Ottawa量表(NOS)评价[32]:≥8分为高质量,6~7分为中等质量,<6分为低质量。RCT采用Cochrane系统评价员手册5.1.0推荐的RCT偏倚风险评估工具[33]。
1.7 统计学方法
应用Stata 12.0软件进行Meta分析。计数资料采用相对危险度(RR)为效应量,计量资料采用标准化均数差(SMD)为效应指标,各效应量均给出其点估计值和95%CI。通过χ2和I2检验评估异质性,P<0.1和I2≥50%提示有异质性,采用随机效应模型评估效应量,否则采用固定效应模型。如存在异质性,通过亚组分析对异质性来源进行探讨。采用Egger和Begg检验及剪补法进行发表偏倚评估。P<0.05为差异有统计学意义。
2. 结果
2.1 文献检索
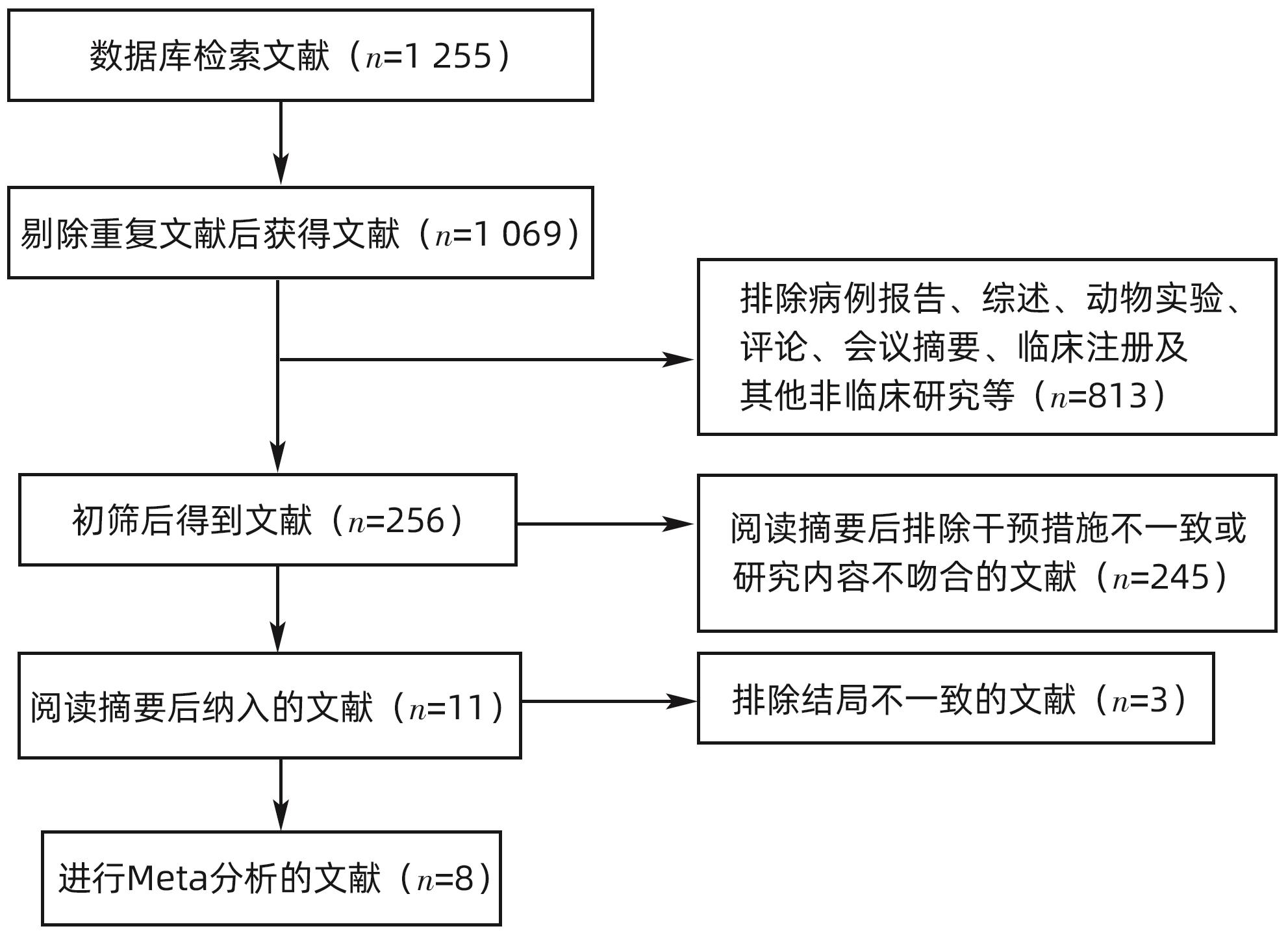
初检获得1 255篇文献,经逐层筛选后,根据纳入和排除标准等,最终纳入8篇文献[24-31],文献筛选流程见图1。
2.2 纳入研究基本特征
纳入研究共953例患者,其中3项RCT,5项RCS,经皮MWA(PMWA)4篇,经腹腔镜MWA(LMWA)1篇,未分类3篇,最长随访时间为104个月,单发肿瘤最大直径≤5 cm,多发肿瘤个数≤3且最大直径≤3 cm。纳入文献特征见表1。
表 1 纳入文献的基本特征Table 1. The characteristics of studies纳入研究 国家 例数
(T/C)
研究类型 年龄(岁)
(T/C)
男女比例
(T/C)
MWA方式 HBsAg阳性率(T/C,%) Child-Pugh分级 肿瘤个数及大小(cm) 随访时间(月) 结局指标 NOS(分) Zhang等2017[24] 中国 31/42 RCS 51.2±6.93/
54.1±7.23
20∶11/
29∶13
PMWA 45.2/61.9 A或B 单发且直径≤5或3个且最大直径≤3 >60 ①④ 6 Zhang等2016[25] 中国 68/122 RCS 55.4±9.9/
49.5±8.6
57∶11/
111∶11
PMWA 92.6/91.8 A 单个且直径<3 9~104 ①②③④⑧ 7 杨藩等2016[26] 中国 98/152 RCS 55.4±7.9/
52.5±8.0
82∶16/
133∶19
PMWA 91.8/91.4 A或B 单发且直径≤3 9~96 ①③④⑧ 8 黄炎等2017[27] 中国 26/24 RCS 57.6±6.0/
58.1±5.5
15∶11/
15∶9
LMWA - A或B 2.36±0.41/2.46±0.36;个数≤2 13~63/16~65 ①②④⑤⑥⑦⑧ 8 廖凌峰等2018[28] 中国 40/68 RCT 52.36±8.62/
52.20±8.60
28∶12/
50∶18
PMWA 90.00/88.24 A或B 2.32±0.64/
2.12±0.60
12~36 ①③④ 陈红健等2018[29] 中国 46/46 RCT 29~78 68∶24 UNK 100 A或B 单发且直径≤3或2个且直径之和≤3 24 ①④⑤⑥⑦⑧ 王辉坡等2019[30] 中国 45/45 RCT 53.8±3.2/
54.3±2.9
23∶22/
18∶27
UNK - - - - ⑥⑦⑧ 黄志明等2016[31] 中国 47/53 RCS 60.0±12.4/
55.8±11.3
42∶5/
48∶5
UNK - A或B 单发且直径≤3或3个且最大直径≤3 3~44 ①②④⑥⑧ 9 注:T,MWA组;C,HR组;UNK,未分类或未确定。①OS;②LR;③DFS;④不良反应;⑤肝功能;⑥手术时间;⑦术中出血量;⑧住院时间。-,未提供数据。
2.3 偏倚风险及质量评估
3项RCT中,1项报告了具体随机方法[30],3项研究结果数据完整[28-30],2项未选择性报告研究结果[28-29],1项不清楚[30],所有研究分配隐藏不清楚、其他偏倚来源不清楚。5项RCS中,NOS评分提示3项研究≥8分,2项研究≥6分,超过50%为高分(表1)。
2.4 Meta分析结果
2.4.1 OS
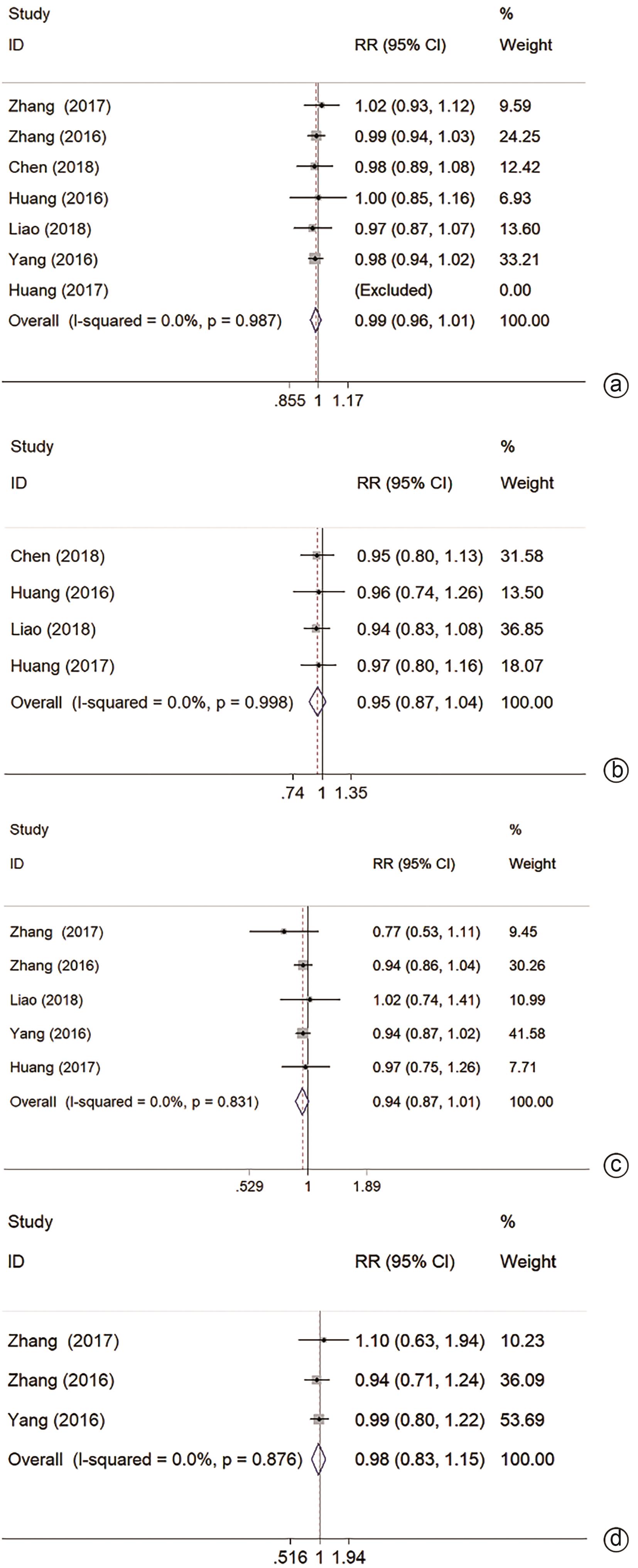
分别有7/4/5/3项研究报道1/2/3/5年OS,结果表明MWA与HR均无统计学差异(RR=0.99,95%CI:0.96~1.01,P=0.308,I2=0.0%;RR=0.95,95%CI:0.87~1.04,P=0.284,I2=0.0%;RR=0.94,95%CI:0.87~1.01,P=0.069,I2=0.0%;RR=0.98,95%CI:0.83~1.15,P=0.822,I2=0.0%)(图2a~d)。
2.4.2 LR
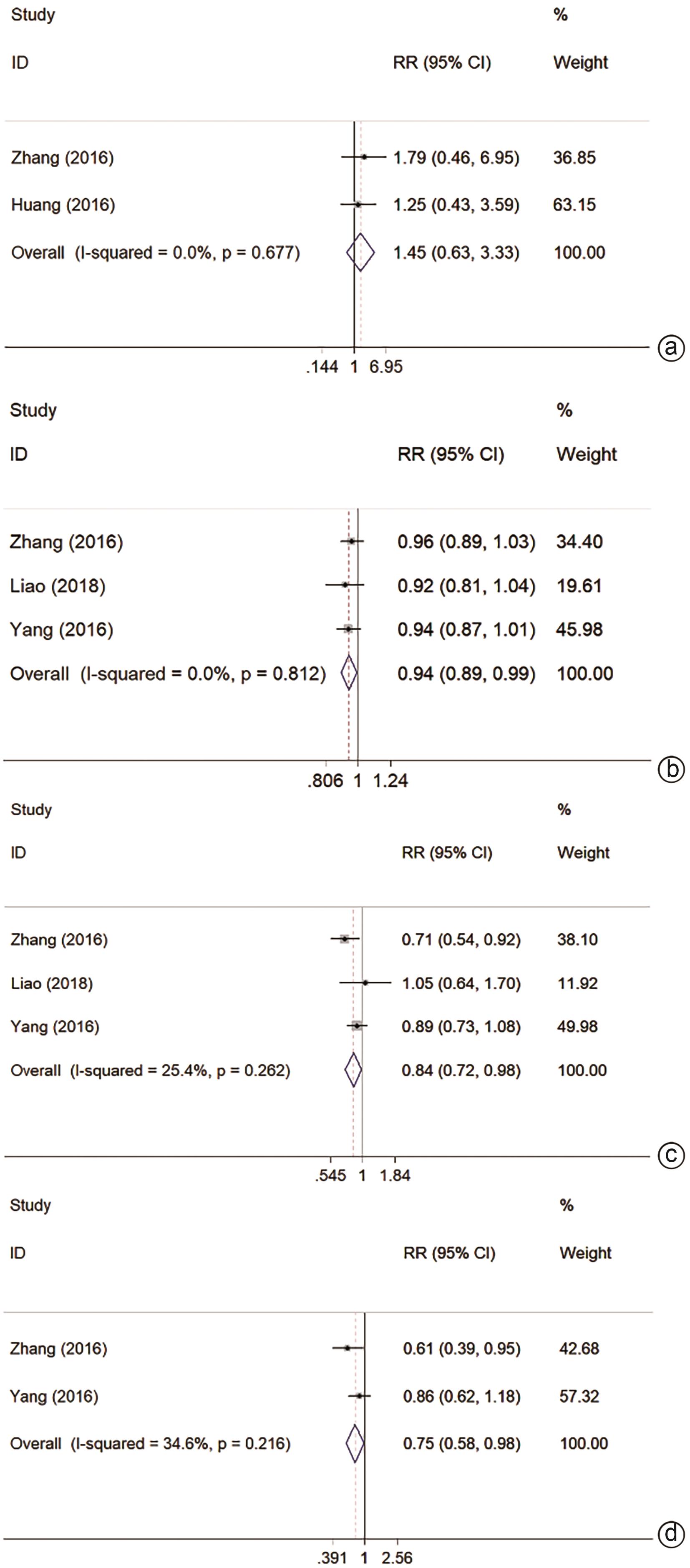
有2项研究报道1年LR,结果表明MWA与HR无统计学差异(RR=1.45,95%CI:0.63~3.33,P=0.383,I2=0.0%)(图3a)。各有1项研究报道2/3/5年LR,结果表明MWA与HR 2/5年LR无统计学差异[27,31](P>0.05);MWA 3年LR高于HR[25](RR=1.59,95%CI:1.08~2.33,P=0.017)。
2.4.3 DFS
分别有3/3/2项研究报道1/3/5年DFS,结果表明MWA 1、3、5年DFS均低于HR(RR=0.94,95%CI:0.89~0.99,P=0.018,I2=0.0%;RR=0.84,95%CI:0.72~0.98,P=0.023,I2=25.4%;RR=0.75,95%CI:0.58~0.98,P=0.032,I2=34.6%)(图3b~d)。1项研究[28]报道了2年DFS,MWA与HR无统计学差异(P>0.05)。
2.4.4 肝功能
分别有2/2/2项研究报道ALT、AST和Alb,结果表明MWA与HR无统计学差异(SMD=-2.02,95%CI:-0.45~0.01,P=0.051,I2=95.7%;SMD=-3.66,95%CI:-9.15~1.82,P=0.191,I2=98.8%;SMD=1.11,95%CI:-0.52~2.75,P=0.183,I2=94.1%)(图4a~c)。1项研究[29]报道TBil,MWA对TBil的影响低于HR(SMD=-1.43,95%CI:-1.89~-0.97,P=0.001)。
2.4.5 不良反应
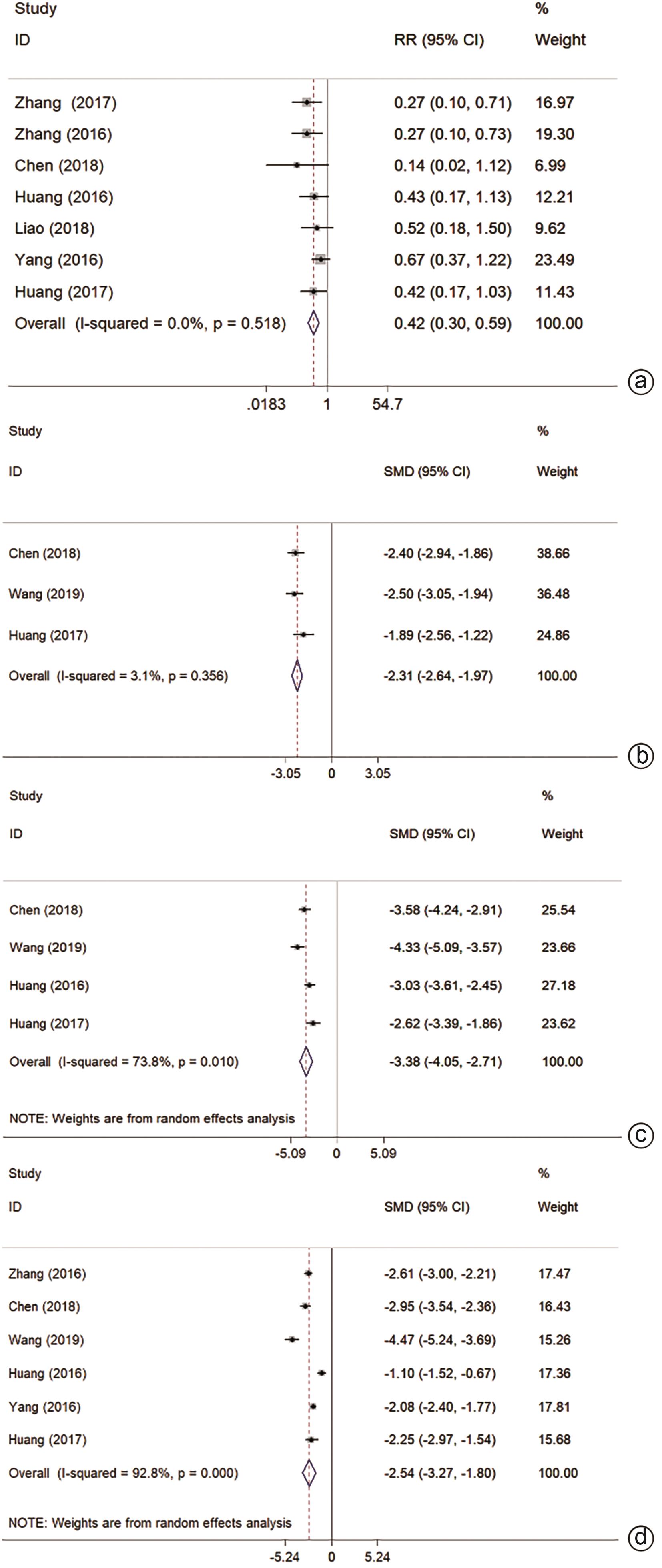
7项研究报道不良反应,主要表现为胸水、腹水、出血、疼痛、胆瘘、肺部感染、肝脓肿、肝包膜下积液、短暂性心律失常、切口感染等。结果显示MWA不良反应率低于HR(RR=0.42,95%CI:0.30~0.59,P<0.001,I2=0.0%)(图5a)。
2.4.6 其他
分别有3/4/6项研究报道术中出血量/手术时间/住院时间,结果显示MWA上述指标均优于HR(SMD=-2.31,95%CI:-2.64~-1.97,P<0.001,I2=3.1%;SMD=-3.38,95%CI:-4.05~-2.71,P<0.001,I2=73.8%;SMD=-2.54,95%CI:-3.27~-1.80,P<0.001,I2=92.8%)(图5b~d)。
2.5 亚组分析
2.5.1 消融方式亚组分析
消融方式分为PMWA、LMWA、未分类。结果显示(表2):在PMWA和未分类组,MWA 1年LR与HR无统计学差异(P值均>0.05)。在PMWA、LMWA和未分类组,MWA 1/2年OS与HR均无统计学差异(P值均>0.05)。在PMWA和LMWA组,MWA 3年OS与HR无统计学差异(P值均>0.05)。在PMWA和未分类组,MWA不良反应低于HR(P值均<0.05),在LMWA组,两者无统计学差异(P>0.05)。在LMWA和未分类组,MWA手术时间短于HR(P值均<0.05)。在PMWA、LMWA和未分类组,MWA住院时间短于HR(P值均<0.05)。在LMWA和未分类组,MWA术中出血量少于HR(P值均<0.05)。在LMWA和未分类组,MWA对ALT和AST的影响低于HR(P值均<0.05)。在LMWA组,MWA对Alb的影响低于HR(P<0.05),在未分类组,两者无统计学差异(P>0.05)。
表 2 消融方式的亚组分析Table 2. Subgroup analysis-method of ablation亚组 结局指标 纳入研究数量 效应值[RR或SMD (95%CI)] 异质性(I2) P值 优势组 PMWA 1年OS 4 0.99(0.96~1.01) 0.0% 0.326 2年OS 1 0.94(0.83~1.08) 0.406 3年OS 4 0.93(0.97~1.00) 0.0% 0.067 1年LR 1 1.79(0.46~6.95) 0.397 不良反应 4 0.44(0.29~0.66) 24.0% <0.001 MWA 住院时间 2 -2.33(-2.84~-1.82) 75.4% <0.001 MWA LMWA 1年OS 1 - - 2年OS 1 0.97(0.80~1.16) 0.704 3年OS 1 0.97(0.75~1.26) 0.813 ALT 1 -0.99(-1.58~-0.40) 0.001 MWA AST 1 -0.88(-1.46~-0.30) 0.003 MWA Alb 1 1.97(1.29~2.65) <0.001 MWA 不良反应 1 0.42(0.17~1.03) 0.059 手术时间 1 -2.62(-3.39~-1.86) <0.001 MWA 住院时间 1 -2.25(-2.97~-1.54) <0.001 MWA 术中出血量 1 -1.89(-2.56~-1.22) <0.001 MWA 未分类 1年OS 2 0.98(0.91~1.07) 0.0% 0.711 2年OS 2 0.95(0.83~1.10) 0.0% 0.529 1年LR 1 1.25(0.43~3.59) 0.683 ALT 1 -3.06(-3.67~-2.45) <0.001 MWA AST 1 -6.48(-7.51~-5.45) <0.001 MWA Alb 1 0.30(-0.11~0.71) 0.153 不良反应 2 0.33(0.14~0.77) 0.0% 0.011 MWA 手术时间 3 -3.61(-4.34~-2.89) 71.8% <0.001 MWA 住院时间 3 -2.82(-4.73~-0.90) 96.9% 0.004 MWA 术中出血量 2 -2.45(-2.83~-2.06) 0.0% <0.001 MWA 2.5.2 研究类型亚组分析
研究类型分为RCT和RCS。结果显示(表3),在RCT和RCS组,MWA 1/2年OS与HR均无统计学差异(P值均>0.05)。在RCS组,MWA 3年OS低于HR(P<0.05),但在RCT组,二者无统计学差异(P>0.05)。在RCT和RCS组,MWA 1年DFS与HR无统计学差异(P值均>0.05),MWA 3年DFS在RCS组低于HR(P<0.05),但在RCT组二者无统计学差异(P>0.05)。关于手术时间、术中出血量、住院时间、不良反应、ALT、AST,在RCT和RCS组,MWA均优于HR(P值均<0.05)。关于Alb,在RCS组MWA优于HR(P<0.05),但在RCT组,二者无统计学差异(P>0.05)。
表 3 研究类型的亚组分析Table 3. Subgroup analysis-type of research亚组 结局指标 纳入研究数量 效应值[RR或SMD (95%CI)] 异质性(I2) P值 优势组 RCT 1年OS 2 0.97(0.91~1.04) 0.0% 0.437 2年OS 2 0.95(0.85~1.06) 0.0% 0.324 3年OS 1 1.02(0.74~1.41) 0.904 1年DFS 1 0.92(0.81~1.04) 0.175 3年DFS 1 1.05(0.64~1.70) 0.855 ALT 1 -3.06(-3.67~-2.45) <0.001 MWA AST 1 -6.48(-7.51~-5.45) <0.001 MWA Alb 1 0.30(-0.11~0.71) 0.153 不良反应 2 0.36(0.15~0.90) 20.4% 0.029 MWA 手术时间 2 -3.93(-4.67~-3.19) 53.2% <0.001 MWA 术中出血量 2 -2.45(-2.83~-2.06) 0.0% <0.001 MWA 住院时间 2 -3.69(-5.17~-2.20) 89.1% <0.001 MWA RCS 1年OS 5 0.99(0.96~1.02) 0.0% 0.495 2年OS 2 0.96(0.83~1.13) 0.0% 0.652 3年OS 4 0.93(0.87~0.99) 0.0% 0.026 HR 1年DFS 2 0.95(0.89~1.00) 0.0% 0.050 3年DFS 2 0.81(0.69~0.95) 45.4% 0.009 HR ALT 1 -0.99(-1.58~-0.40) 0.001 MWA AST 1 -0.88(-1.46~-0.30) 0.003 MWA Alb 1 1.97(1.29~2.65) <0.001 MWA 不良反应 5 0.43(0.29~0.62) 0.0% <0.001 MWA 手术时间 2 -2.88(-3.34~-2.42) 0.0% <0.001 MWA 术中出血量 1 -1.89(-2.56~-1.22) <0.001 MWA 住院时间 4 -2.00(-2.65~-1.35) 89.1% <0.001 MWA 2.6 发表偏倚
除不良反应外,其余指标用Egger和Begg检验均无发表偏倚。Egger法提示不良反应存在偏倚,但剪补法显示结果稳定,提示不存在发表偏倚。
3. 讨论
MWA及HR是除肝移植外HCC最有效的治疗手段[6,9],目前认为HR适用于CNLCⅠa、Ⅰb、Ⅱa期肝癌,Ⅱb、Ⅲa期肝癌不宜首选HR,MWA适用于CNLCⅠa及部分Ⅰb期肝癌,且两者疗效无显著差异[34]。但HCC合并肝硬化的肝脏储备功能更差,二者是否同样有效?目前尚无相关Meta分析。因此,作者进行了该项研究,并获得了有价值的数据。
本Meta分析发现,MWA 1/3/5年DFS低于HR,MWA 1/2/5年LR、1/2/3/5年OS与HR均无差异。该结果与熊琨等[35](HCC未合并肝硬化)的研究结果相反,考虑与肝硬化是HCC复发的独立因素有关[21-23]。Zhang等[36]研究发现射频消融LR高于HR,3/5年OS低于HR,与本结果相反,考虑与MWA比射频消融具有更高的功率及单位时间肿瘤灭活率相关[37]。在手术时间、出血量、不良反应及住院时间方面,MWA显著优于HR。在肝功能方面,MWA后TBil更低,与既往研究[16]基本一致。MWA对ALT、AST和Alb的影响与HR无差异,与既往研究[16]不一致,从理论来讲,MWA时间更短,出血量更少,MWA对它们的影响应该更小,可能与纳入文献较少有关。但后续的亚组分析表明MWA对ALT等的影响更小,与既往研究[16]一致。因此,对于年龄≥75岁,或伴有高血压、糖尿病、心脏病等基础疾病的患者,MWA为HCC合并肝硬化的首选方案。
为了进一步更全面地了解MWA与HR的临床疗效及安全性,本研究根据MWA方式进行了亚组分析,结果表明:无论是PMWA还是LMWA,MWA LR、OS与HR均无差异,结果未改变。在LMWA组,MWA不良反应和HR无差异,与亚组前结论相反,据此,本研究建议MWA方式首选PMWA。亚组后,MWA对ALT、AST、Alb的影响小于HR,故MWA后患者肝功能更好。
同时本研究根据研究类型进行了亚组分析,结果表明:在RCT和RCS组,MWA 1/2年OS和HR无差异,与亚组前结论一致。在RCS组,HR 3年OS和3年DFS优于MWA,与亚组前结论一致,但在RCT组,二者无差异,与亚组前结论相反。考虑RCT比RCS有更高的方法学质量和证据等级,本研究更相信RCT结果,故认为MWA OS和DFS与HR无差异。对于手术时间、出血量、不良反应及住院时间,亚组后结论与亚组前一致。在RCT和RCS组,MWA的ALT、AST均优于HR。
另外,Meta分析表明住院时间、手术时间、ALT、AST、Alb存在异质性,亚组分析表明MWA方式、研究类型不是异质性来源。本研究认为异质性与以下因素密切相关:(1)患者特征存在差异,如肿瘤大小、个数、部位,是否合并乙型肝炎、丙型肝炎,肝功能等级,是否合并腹水等不完全一致,而该类差异会直接影响HCC的预后。(2)手术能力、设备差异等均影响术后恢复。(3)RCT占比较少。(4)文献相对少,并受样本量及提取数据的限制,本研究未能进行更深入的亚组分析。以上也是本研究的局限性。
因此,未来将进一步设计更好的研究来解决上述不足。多中心、大样本、包含更长随访时间及具有统一的患者和肿瘤特征的高质量RCT应该被开展,以帮助更全面和准确地了解MWA与HR的疗效及安全性,最终更好地指导临床应用。
综上所述,MWA与HR在LR、DFS、OS方面无明显差异。MWA术中出血量更少,手术时间更短,不良反应更少,对肝功能影响更小,住院时间更短,尤其适合年龄大、基础疾病多、肝功能差的患者。然而,上述结论仍需高质量的临床研究进一步验证。
-
表 1 纳入文献的基本特征
Table 1. The characteristics of studies
纳入研究 国家 例数
(T/C)
研究类型 年龄(岁)
(T/C)
男女比例
(T/C)
MWA方式 HBsAg阳性率(T/C,%) Child-Pugh分级 肿瘤个数及大小(cm) 随访时间(月) 结局指标 NOS(分) Zhang等2017[24] 中国 31/42 RCS 51.2±6.93/
54.1±7.23
20∶11/
29∶13
PMWA 45.2/61.9 A或B 单发且直径≤5或3个且最大直径≤3 >60 ①④ 6 Zhang等2016[25] 中国 68/122 RCS 55.4±9.9/
49.5±8.6
57∶11/
111∶11
PMWA 92.6/91.8 A 单个且直径<3 9~104 ①②③④⑧ 7 杨藩等2016[26] 中国 98/152 RCS 55.4±7.9/
52.5±8.0
82∶16/
133∶19
PMWA 91.8/91.4 A或B 单发且直径≤3 9~96 ①③④⑧ 8 黄炎等2017[27] 中国 26/24 RCS 57.6±6.0/
58.1±5.5
15∶11/
15∶9
LMWA - A或B 2.36±0.41/2.46±0.36;个数≤2 13~63/16~65 ①②④⑤⑥⑦⑧ 8 廖凌峰等2018[28] 中国 40/68 RCT 52.36±8.62/
52.20±8.60
28∶12/
50∶18
PMWA 90.00/88.24 A或B 2.32±0.64/
2.12±0.60
12~36 ①③④ 陈红健等2018[29] 中国 46/46 RCT 29~78 68∶24 UNK 100 A或B 单发且直径≤3或2个且直径之和≤3 24 ①④⑤⑥⑦⑧ 王辉坡等2019[30] 中国 45/45 RCT 53.8±3.2/
54.3±2.9
23∶22/
18∶27
UNK - - - - ⑥⑦⑧ 黄志明等2016[31] 中国 47/53 RCS 60.0±12.4/
55.8±11.3
42∶5/
48∶5
UNK - A或B 单发且直径≤3或3个且最大直径≤3 3~44 ①②④⑥⑧ 9 注:T,MWA组;C,HR组;UNK,未分类或未确定。①OS;②LR;③DFS;④不良反应;⑤肝功能;⑥手术时间;⑦术中出血量;⑧住院时间。-,未提供数据。
表 2 消融方式的亚组分析
Table 2. Subgroup analysis-method of ablation
亚组 结局指标 纳入研究数量 效应值[RR或SMD (95%CI)] 异质性(I2) P值 优势组 PMWA 1年OS 4 0.99(0.96~1.01) 0.0% 0.326 2年OS 1 0.94(0.83~1.08) 0.406 3年OS 4 0.93(0.97~1.00) 0.0% 0.067 1年LR 1 1.79(0.46~6.95) 0.397 不良反应 4 0.44(0.29~0.66) 24.0% <0.001 MWA 住院时间 2 -2.33(-2.84~-1.82) 75.4% <0.001 MWA LMWA 1年OS 1 - - 2年OS 1 0.97(0.80~1.16) 0.704 3年OS 1 0.97(0.75~1.26) 0.813 ALT 1 -0.99(-1.58~-0.40) 0.001 MWA AST 1 -0.88(-1.46~-0.30) 0.003 MWA Alb 1 1.97(1.29~2.65) <0.001 MWA 不良反应 1 0.42(0.17~1.03) 0.059 手术时间 1 -2.62(-3.39~-1.86) <0.001 MWA 住院时间 1 -2.25(-2.97~-1.54) <0.001 MWA 术中出血量 1 -1.89(-2.56~-1.22) <0.001 MWA 未分类 1年OS 2 0.98(0.91~1.07) 0.0% 0.711 2年OS 2 0.95(0.83~1.10) 0.0% 0.529 1年LR 1 1.25(0.43~3.59) 0.683 ALT 1 -3.06(-3.67~-2.45) <0.001 MWA AST 1 -6.48(-7.51~-5.45) <0.001 MWA Alb 1 0.30(-0.11~0.71) 0.153 不良反应 2 0.33(0.14~0.77) 0.0% 0.011 MWA 手术时间 3 -3.61(-4.34~-2.89) 71.8% <0.001 MWA 住院时间 3 -2.82(-4.73~-0.90) 96.9% 0.004 MWA 术中出血量 2 -2.45(-2.83~-2.06) 0.0% <0.001 MWA 表 3 研究类型的亚组分析
Table 3. Subgroup analysis-type of research
亚组 结局指标 纳入研究数量 效应值[RR或SMD (95%CI)] 异质性(I2) P值 优势组 RCT 1年OS 2 0.97(0.91~1.04) 0.0% 0.437 2年OS 2 0.95(0.85~1.06) 0.0% 0.324 3年OS 1 1.02(0.74~1.41) 0.904 1年DFS 1 0.92(0.81~1.04) 0.175 3年DFS 1 1.05(0.64~1.70) 0.855 ALT 1 -3.06(-3.67~-2.45) <0.001 MWA AST 1 -6.48(-7.51~-5.45) <0.001 MWA Alb 1 0.30(-0.11~0.71) 0.153 不良反应 2 0.36(0.15~0.90) 20.4% 0.029 MWA 手术时间 2 -3.93(-4.67~-3.19) 53.2% <0.001 MWA 术中出血量 2 -2.45(-2.83~-2.06) 0.0% <0.001 MWA 住院时间 2 -3.69(-5.17~-2.20) 89.1% <0.001 MWA RCS 1年OS 5 0.99(0.96~1.02) 0.0% 0.495 2年OS 2 0.96(0.83~1.13) 0.0% 0.652 3年OS 4 0.93(0.87~0.99) 0.0% 0.026 HR 1年DFS 2 0.95(0.89~1.00) 0.0% 0.050 3年DFS 2 0.81(0.69~0.95) 45.4% 0.009 HR ALT 1 -0.99(-1.58~-0.40) 0.001 MWA AST 1 -0.88(-1.46~-0.30) 0.003 MWA Alb 1 1.97(1.29~2.65) <0.001 MWA 不良反应 5 0.43(0.29~0.62) 0.0% <0.001 MWA 手术时间 2 -2.88(-3.34~-2.42) 0.0% <0.001 MWA 术中出血量 1 -1.89(-2.56~-1.22) <0.001 MWA 住院时间 4 -2.00(-2.65~-1.35) 89.1% <0.001 MWA -
[1] MURAI H, KODAMA T, MAESAKA K, et al. Multiomics identifies the link between intratumor steatosis and the exhausted tumor immune microenvironment in hepatocellular carcinoma[J]. Hepatology, 2023, 77( 1): 77- 91. DOI: 10.1002/hep.32573. [2] LI BH, LI YZ, ZHOU HJ, et al. Multiomics identifies metabolic subtypes based on fatty acid degradation allocating personalized treatment in hepatocellular carcinoma[J]. Hepatology, 2024, 79( 2): 289- 306. DOI: 10.1097/HEP.0000000000000553. [3] SANKAR K, GONG J, OSIPOV A, et al. Recent advances in the management of hepatocellular carcinoma[J]. Clin Mol Hepatol, 2024, 30( 1): 1- 15. DOI: 10.3350/cmh.2023.0125. [4] HILL A, OLUMBA F, CHAPMAN W. Transplantation for hepatocellular carcinoma[J]. Surg Clin North Am, 2024, 104( 1): 103- 111. DOI: 10.1016/j.suc.2023.09.002. [5] YILMA M, MEHTA N. Optimal liver transplantation criteria for hepatocellular carcinoma[J]. Surg Oncol Clin N Am, 2024, 33( 1): 133- 142. DOI: 10.1016/j.soc.2023.06.011. [6] TRAN NH, MUÑOZ S, THOMPSON S, et al. Hepatocellular carcinoma downstaging for liver transplantation in the era of systemic combined therapy with anti-VEGF/TKI and immunotherapy[J]. Hepatology, 2022, 76( 4): 1203- 1218. DOI: 10.1002/hep.32613. [7] KARDASHIAN A, FLORMAN SS, HAYDEL B, et al. Liver transplantation outcomes in a U.S. multicenter cohort of 789 patients with hepatocellular carcinoma presenting beyond Milan criteria[J]. Hepatology, 2020, 72( 6): 2014- 2028. DOI: 10.1002/hep.31210. [8] IVANICS T, CLAASEN MPAW, SAMSTEIN B, et al. Living donor liver transplantation for hepatocellular carcinoma within and outside traditional selection criteria: A multicentric North American experience[J]. Ann Surg, 2024, 279( 1): 104- 111. DOI: 10.1097/SLA.0000000000006049. [9] CHOI J, JO C, LIM YS. Tenofovir versus entecavir on recurrence of hepatitis B virus-related hepatocellular carcinoma after surgical resection[J]. Hepatology, 2021, 73( 2): 661- 673. DOI: 10.1002/hep.31289. [10] ZHU P, LIAO W, ZHANG WG, et al. A prospective study using propensity score matching to compare long-term survival outcomes after robotic-assisted, laparoscopic, or open liver resection for patients with BCLC stage 0-a hepatocellular carcinoma[J]. Ann Surg, 2023, 277( 1): e103- e111. DOI: 10.1097/SLA.0000000000005380. [11] RASIC G, de GEUS SWL, BEAULIEU-JONES B, et al. A nationwide propensity score analysis comparing ablation and resection for hepatocellular carcinoma[J]. J Surg Oncol, 2023, 127( 7): 1125- 1134. DOI: 10.1002/jso.27232. [12] XU JB, QI FZ, XU G, et al. Adjuvant interferon therapy after surgical treatment for hepatitis B/C virus-related hepatocellular carcinoma: A meta-analysis[J]. Hepatol Res, 2014, 44( 2): 209- 217. DOI: 10.1111/hepr.12109. [13] YANG S, LIN Q, LIN W, et al. Effect of adjuvant interferon therapy on hepatitis B virus-related hepatocellular carcinoma: A systematic review[J]. World J Surg Oncol, 2016, 14( 1): 159. DOI: 10.1186/s12957-016-0912-7. [14] ADWAN H, HAMMANN L, VOGL TJ. Microwave ablation of recurrent hepatocellular carcinoma after curative surgical resection[J]. J Clin Med, 2023, 12( 7): 2560. DOI: 10.3390/jcm12072560. [15] RYU T, TAKAMI Y, WADA Y, et al. Combined hepatectomy and microwave ablation for multifocal hepatocellular carcinoma: Long-term outcomes and prognostic factors[J]. Asian J Surg, 2021, 44( 1): 186- 191. DOI: 10.1016/j.asjsur.2020.05.008. [16] WANG Z, LIU M, ZHANG DZ, et al. Microwave ablation versus laparoscopic resection as first-line therapy for solitary 3-5-cm HCC[J]. Hepatology, 2022, 76( 1): 66- 77. DOI: 10.1002/hep.32323. [17] WICKS JS, DALE BS, RUFFOLO L, et al. Comparable and complimentary modalities for treatment of small-sized HCC: Surgical resection, radiofrequency ablation, and microwave ablation[J]. J Clin Med, 2023, 12( 15): 5006. DOI: 10.3390/jcm12155006. [18] LIU KW, ZHENG H, SUI XZ, et al. Microwave ablation versus surgical resection for subcapsular hepatocellular carcinoma: A propensity score-matched study of long-term therapeutic outcomes[J]. Eur Radiol, 2023, 33( 3): 1938- 1948. DOI: 10.1007/s00330-022-09135-1. [19] DING WZ, YU J, LIU FY, et al. Percutaneous microwave ablation versus robot-assisted hepatectomy for early hepatocellular carcinoma: A real-world single-center study[J]. Dig Liver Dis, 2022, 54( 2): 243- 250. DOI: 10.1016/j.dld.2021.04.008. [20] TONG Y, CAI R, LI JX, et al. Liver resection versus microwave ablation for hepatocellular carcinoma in ideal candidates for ablation per Barcelona Clinic Liver Cancer staging: A propensity score matching and inverse probability of treatment weighting analysis[J]. Aliment Pharmacol Ther, 2022, 56( 11-12): 1602- 1614. DOI: 10.1111/apt.17263. [21] WANG WQ, LV X, LI J, et al. Repeat hepatectomy versus microwave ablation for solitary and small(≤3 cm) recurrent hepatocellular carcinoma with early or late recurrence: A propensity score matched study[J]. Eur J Surg Oncol, 2023, 49( 5): 1001- 1008. DOI: 10.1016/j.ejso.2022.12.016. [22] LIN YZ, SHI HY, MU XH. Diagnosis of small primary liver cancer under the background of liver cirrhosis by dual-source CT hepatic artery three-phase scanning and enhanced perfusion scanning[J]. J Pract Hepatol, 2023, 26( 3): 412- 415. DOI: 10.3969/j.issn.1672-5069.2023.03.028.林永祝, 史红媛, 穆西虎. 双源CT肝动脉三期扫描和增强灌注扫描诊断肝硬化背景下小原发性肝癌价值研究[J]. 实用肝脏病杂志, 2023, 26( 3): 412- 415. DOI: 10.3969/j.issn.1672-5069.2023.03.028. [23] HE J, CHEN WQ, SHEN HB, et al. China guideline for liver cancer screening(2022, Beijing)[J]. J Clin Hepatol, 2022, 38( 8): 1739- 1758. DOI: 10.3969/j.issn.1001-5256.2022.08.007.赫捷, 陈万青, 沈洪兵, 等. 中国人群肝癌筛查指南(2022, 北京)[J]. 临床肝胆病杂志, 2022, 38( 8): 1739- 1758. DOI: 10.3969/j.issn.1001-5256.2022.08.007. [24] ZHANG QB, ZHANG XG, JIANG RD, et al. Microwave ablation versus hepatic resection for the treatment of hepatocellular carcinoma and oesophageal variceal bleeding in cirrhotic patients[J]. Int J Hyperthermia, 2017, 33( 3): 255- 262. DOI: 10.1080/02656736.2016.1257824. [25] ZHANG EL, YANG F, WU ZB, et al. Therapeutic efficacy of percutaneous microwave coagulation versus liver resection for single hepatocellular carcinoma ≤3 cm with Child-Pugh A cirrhosis[J]. Eur J Surg Oncol, 2016, 42( 5): 690- 697. DOI: 10.1016/j.ejso.2016.02.251. [26] YANG F, ZHANG EL, XIAO ZY, et al. Therapeutic outcomes of surgical resection versus percutaneous microwave coagulation therapy for single small hepatocellular carcinoma with cirrhosis(250 cases)[J]. Acta Med Univ Sci Technol Huazhong, 2016, 45( 2): 185- 189. DOI: 10.3870/j.issn.1672-0741.2016.02.014.杨藩, 张二雷, 肖震宇, 等. 经皮微波消融与手术切除治疗合并肝硬化的单发小肝癌的疗效比较(附250例)[J]. 华中科技大学学报(医学版), 2016, 45( 2): 185- 189. DOI: 10.3870/j.issn.1672-0741.2016.02.014. [27] HUANG Y, CHEN J, LIU XS. Clinical efficacy of laparoscopic microwave ablation in the treatment of small hepatocellular carcinoma with cirrhosis[J]. Chin J Minim Invasive Surg, 2017, 17( 6): 504- 508. DOI: 10.3969/j.issn.1009-6604.2017.06.008.黄炎, 陈坚, 刘绪舜. 腹腔镜微波消融治疗小肝癌合并肝硬化的临床疗效[J]. 中国微创外科杂志, 2017, 17( 6): 504- 508. DOI: 10.3969/j.issn.1009-6604.2017.06.008. [28] LIAO LF, XUE JZ, LI SK. Survival analysis of percutan eous microwave ablation for patients with small hepatocellular carcinoma with underlying liver cirrhosis[J]. J Pract Hepatol, 2018, 21( 2): 257- 260. DOI: 10.3969/j.issn.1672-5069.2018.02.025.廖凌峰, 薛建章, 李士坤. 经皮微波消融术治疗合并肝硬化的原发性小肝癌患者生存分析[J]. 实用肝脏病杂志, 2018, 21( 2): 257- 260. DOI: 10.3969/j.issn.1672-5069.2018.02.025. [29] CHEN HJ, CHEN Y, ZHANG SQ, et al. Comparison of microwave ablation and surgical resection in the treatment of 92 cases of small hepatocellular carcinoma complicated with cirrhosis[J]. Med J Commun, 2018, 32( 2): 163- 165.陈红健, 陈橼, 张素青, 等. 微波消融与手术切除治疗小肝癌合并肝硬化92例效果比较[J]. 交通医学, 2018, 32( 2): 163- 165. [30] WANG HP, JIA J. Comparative analysis of microwave ablation and surgical resection in the treatment of 90 cases of small hepatocellular carcinoma complicated with cirrhosis[J/CD]. Electron J Clin Med Lit, 2019, 6( 94): 52. DOI: 10.16281/j.cnki.jocml.2019.94.043.王辉坡, 贾静. 微波消融与手术切除治疗小肝癌合并肝硬化90例效果对比分析[J/CD]. 临床医药文献电子杂志, 2019, 6( 94): 52. DOI: 10.16281/j.cnki.jocml.2019.94.043. [31] HUANG ZM, ZHU CH, LI J. Clinical observation of microwave ablation and surgical resection in the treatment of small hepatocellular carcinoma with resectable cirrhosis[J]. Shenzhen J Integr Tradit Chin West Med, 2016, 26( 23): 16- 18, 199. DOI: 10.16458/j.cnki.1007-0893.2016.23.008.黄志明, 朱灿华, 李君. 微波消融与手术切除治疗可切除肝硬化型初治小肝癌的疗效观察[J]. 深圳中西医结合杂志, 2016, 26( 23): 16- 18, 199. DOI: 10.16458/j.cnki.1007-0893.2016.23.008. [32] WELLS G, SHEA B, O’CONNELL D, et al. The Newcastle-Ottawa Scale(NOS) for assessing the quality of nonrandomised studies in meta-analyses[EB/OL]. http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp. http: //www.ohri.ca/programs/clinical_epidemiology/oxford.asp [33] HIGGINS J, THOMAS J, CHANDLER J, et al. Cochrane Handbook for Systematic Reviews of Interventions Version 6.3, 2022[EB/OL]. http://training.cochrane.org/handbook/current. http: //training.cochrane.org/handbook/current [34] General Office of National Health Commission. Standard for diagnosis and treatment of primary liver cancer(2022 edition)[J]. J Clin Hepatol, 2022, 38( 2): 288- 303. DOI: 10.3969/j.issn.1001-5256.2022.02.009.国家卫生健康委办公厅. 原发性肝癌诊疗指南(2022年版)[J]. 临床肝胆病杂志, 2022, 38( 2): 288- 303. DOI: 10.3969/j.issn.1001-5256.2022.02.009. [35] XIONG K, ZHU LP, LU Y, et al. Network Meta-analysis on the efficacy and safety of surgical resection and thermal ablations for hepatocellular carcinoma in China[J]. Chin J Hepatobiliary Surg, 2019, 25( 11): 823- 827. DOI: 10.3760/cma.j.issn.1007-8118.2019.11.007.熊琨, 朱莉萍, 陆勇, 等. 我国肝细胞癌手术切除与热消融疗效和安全性比较的网络荟萃分析[J]. 中华肝胆外科杂志, 2019, 25( 11): 823- 827. DOI: 10.3760/cma.j.issn.1007-8118.2019.11.007. [36] ZHANG T, HU H, JIA YS, et al. Efficacy and safety of radiofrequency ablation and surgery for hepatocellular carcinoma in patients with cirrhosis: A meta-analysis[J]. Medicine, 2022, 101( 52): e32470. DOI: 10.1097/MD.0000000000032470. [37] WANG WX, ZHANG FZ, XU XX, et al. Comparison on efficacy of TACE combined with radiofrequency ablation or microwave ablation for primary hepatocellular carcinoma: Meta-analysis[J]. Chin J Interv Imag Ther, 2023, 20( 8): 467- 472. DOI: 10.13929/j.issn.1672-8475.2023.08.005.王文轩, 张福洲, 徐晓雪, 等. 对比TACE联合射频消融与联合微波消融治疗原发性肝细胞癌效果:Meta分析[J]. 中国介入影像与治疗学, 2023, 20( 8): 467- 472. DOI: 10.13929/j.issn.1672-8475.2023.08.005. -




 PDF下载 ( 2928 KB)
PDF下载 ( 2928 KB)


 下载:
下载:





 下载:
下载: