Wnt信号通路与肝再生的关系及其在肝脏疾病中的作用
DOI: 10.12449/JCH240529
The relationship between the Wnt signaling pathway and liver regeneration and its role in liver diseases
-
摘要: Wnt信号通路在维持肝脏内稳态和肝脏再生过程中扮演重要角色,在成熟的健康肝脏中,Wnt信号通路大多是不活跃的,但在细胞更新或再生过程中,以及在某些病理条件、疾病、癌前状态和癌症中,Wnt信号通路被持续过度激活。持续的肝细胞损伤常常会导致慢性肝病,如肝纤维化、肝硬化及肝癌等。本文概述了Wnt信号通路的基本结构特点,详细分析了其在多种肝脏疾病病理进展所扮演的重要角色,希望为临床防治肝脏疾病提供新思路。Abstract: The Wnt signaling pathway plays an important role in maintaining liver homeostasis and liver regeneration. In healthy livers, the Wnt signaling pathway is mostly inactive, but it is continuously overactivated during cell renewal or regeneration processes, as well as in certain pathological conditions, diseases, precancerous states, and cancers. Persistent liver cell injury often leads to chronic liver diseases such as liver fibrosis, liver cirrhosis, and liver cancer. This article summarizes the basic structural features of the Wnt signaling pathway and analyzes its important role in the pathological progression of various liver diseases, so as to provide new ideas for the prevention and treatment of liver diseases in clinical practice.
-
Key words:
- Liver Diseases /
- Liver Regeneration /
- Wnt Signaling Pathway /
- beta Catenin
-
肝脏不仅是维持人体生命正常活动的重要器官,也是一个具有强大再生能力的器官,具有调节营养物质和化学药物的代谢、合成和分解蛋白质、调节全身血容量、解毒、调节免疫等多种功能[1]。肝脏疾病是指由内外等多种致病因素引起的肝脏病变,在很大程度上影响人体的正常生理功能,如病毒感染、酗酒、营养不良、药物、化学试剂、酸碱失衡等[2-3]。根据不同的病因和发病机制,肝脏疾病分为急性肝损伤、病毒性肝炎、酒精性肝病、非酒精性脂肪性肝病(NAFLD)、药物性肝损伤、肝纤维化、肝硬化和肝细胞癌(HCC)[4]。由于生活环境等变化,近年来世界范围内肝病患者的数量不断增加,并逐渐发展成为一个全球性的公共卫生问题。根据流行病学统计,全球每年因病毒性肝炎、肝硬化和HCC等肝病导致的死亡人数高达200万[5]。肝脏具有显著的再生能力,调控肝再生是治疗肝病的一个重要方向。健康的肝脏中细胞有丝分裂是静止的,但在肝脏受损或部分切除后,各种信号通路刺激G0期肝细胞增殖,以恢复肝脏的体积及生理功能。而Wnt信号通路在肝脏再生过程中起着关键作用,调控Wnt信号通路可能成为针对这些肝脏疾病开发新疗法的靶点,故本文就Wnt信号通路在肝再生和肝脏疾病发生中的作用展开综述。
1. Wnt信号通路概述
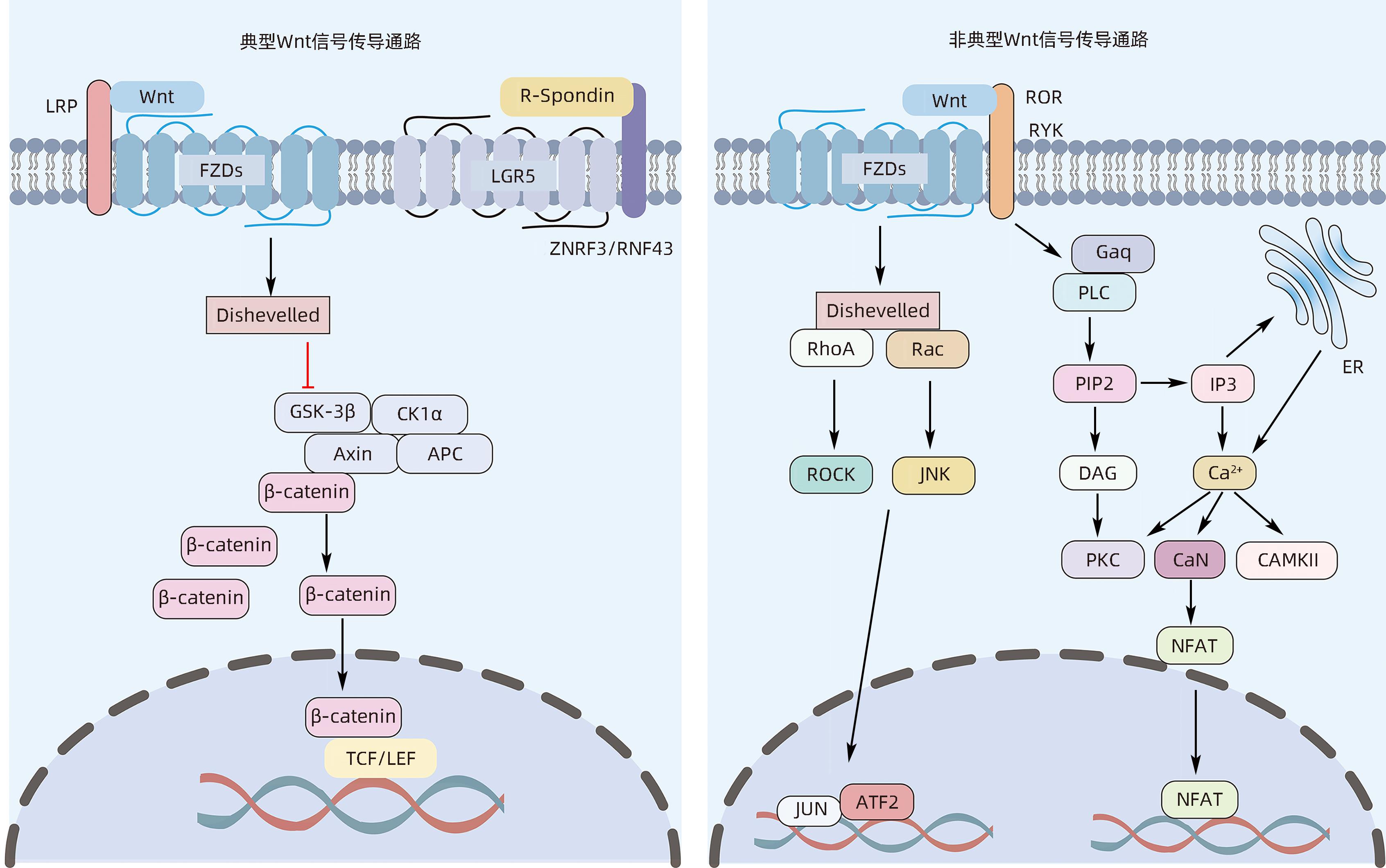
Wnt是一种生长刺激因子,在不同的点影响细胞周期,包括细胞增殖、分化、迁移、极性、干细胞和谱系可塑性[6]。与其他生长刺激因子相比,Wnt信号传导的独特之处在于诱导细胞增殖的同时赋予生长组织形状的能力,并且在该过程中充当定向生长因子[7]。因此,Wnt信号通路在器官发生、组织稳态、组织再生和肿瘤发生中起着关键作用[8-11]。Wnt配体和FZD受体结合激活Wnt信号通路,基因组测序显示,哺乳动物有19个Wnt配体和10个FZD受体[6],这决定了Wnt信号通路的复杂性和特异性。Wnt信号传导通路通常分为典型传导通路(β-catenin介导)和非典型(β-catenin非依赖性)传导通路。在典型的Wnt/β-catenin途径中,酪蛋白激酶1(CK1)、糖原合成酶激酶3(GSK3)、结肠腺瘤性息肉病蛋白(APC)和轴抑制蛋白(AXIN)与β-catenin相互作用参与基因表达的调控。在缺乏Wnt配体的稳定状态下,β-catenin和CK1相互作用,依次被CK1和GSK3磷酸化,被E3泛素连接酶复合物β-TrCP泛素化,最后被蛋白酶体降解。在有Wnt配体的情况下,Wnt与细胞表面存在的两种蛋白质组成的受体复合物相互作用:即FZD和LDL受体相关蛋白5/6(LRP5/6),并通过募集胞质蛋白Dishevelled、阻断或破坏Axin/GSK3/APC复合物的形成来激活Wnt信号,从而抑制β-catenin的降解,导致β-catenin在细胞质中积累。然后,积聚的胞质β-catenin移位到细胞核内,与转录因子T淋巴细胞因子/淋巴增强因子1(TCF/LEF1)结合,启动Wnt靶基因的表达。此外,含亮氨酸重复G蛋白偶联受体5(LGR5)与R-Spondin结合抑制ZNRF3和RNF43 E3连接酶泛素化,增加了细胞对Wnt配体的敏感性,从而促进Wnt信号传导。非典型Wnt信号通路包括Wnt/PCP信号通路(调控细胞骨架控制细胞形状)和Wnt/Ca2+通路(调控细胞内钙离子的浓度)[6,12](图1)。
2. 肝再生中的Wnt信号通路
肝脏是人体内具有快速再生能力的器官,即使手术切除了几乎2/3的肝脏,剩下的肝脏也能在短期之内恢复到原来的大小。Wnt/β-catenin刺激G0期肝细胞增殖,可以修复组织并恢复肝脏的生理功能[13]。研究[14]发现,在大鼠中进行切除2/3肝脏手术(PHx),数天后可以观察到剩余的肝叶增大,其机制主要通过细胞增生和细胞肥大来代替损失的肝脏体积。Wnt/β-catenin信号是PHx模型中肝再生的重要驱动因素,在建立PHx大鼠模型后的几分钟内,β-catenin瞬时增加,并迅速转移至细胞核[15]。细胞核β-catenin的增加有助于通过靶基因的表达促进肝细胞增殖,如细胞周期蛋白D1,在建立PHx模型后的6 h表达即有所增加[16]。敲除大鼠肝脏中的β-catenin后,在进行PHx后40 h,大鼠肝脏中增殖的肝细胞减少了1/2,这表明β-catenin的缺失导致PHx后肝再生延迟。然而,有意思的是,持续观察PHx模型3天后,肝细胞增殖又开始增加,这表明存在代偿信号通路的激活[17]。同样,肝细胞中缺乏Wnt共受体LRP5和LRP6的小鼠在PHx后表现出相似的肝再生延迟,肝细胞中缺乏LGR4和LGR5的小鼠也是如此[18]。研究[19]还表明,肝损伤时,肝细胞中LGR5和AXIN2的表达上调。LGR5是Wnt驱动的自我更新组织中活跃分裂的干细胞和祖细胞的标志,AXIN2是由β-catenin反式激活的Wnt下游靶基因[20],和AXIN1一样,AXIN2与其他破坏复合成分结合降解β- catenin,作为Wnt信号的负反馈调节因子[21]。除了Wnt信号传导的核心成分之外,Wnt信号传导的其他调节因子也与肝再生有关,研究[22]发现,跨膜蛋白9 (TMEM9)基因的敲除抑制了Wnt/β-catenin信号传导的活性,但β- catenin反式激活了TMEM9,导致Wnt/β-catenin信号传导的过度激活。
3. Wnt信号通路与肝脏疾病的相关性
Wnt/β-catenin信号通路除了在肝再生中的作用,其信号通路的持续激活与慢性肝病的进展和肝脏恶性肿瘤发生发展有关,包括慢性肝病,如肝纤维化、NAFLD、胆汁淤积性肝病以及肝癌等。
3.1 Wnt信号通路与慢性肝病的相关性
3.1.1 Wnt信号通路与肝纤维化
纤维化组织的形成,其定义为细胞外基质(ECM)成分如胶原和纤连蛋白的过度积累,是所有器官组织修复的正常和重要阶段。当组织受伤时,局部组织成纤维细胞被激活并增加其收缩性、炎症介质的分泌和ECM成分的合成[23]。肝纤维化是绝大部分不同病因的慢性肝病所具有的病理特征。活化的肝星状细胞(HSC)是纤维化的关键效应器,其通过增加纤维ECM的沉积并释放细胞因子、趋化因子和其他介质,与炎性细胞一起建立对肝实质再生有负面影响的促纤维化环境[24]。Wnt/β-catenin通路在HSC激活过程中被激活,但其在纤维化形成中的作用仍有争议。一方面,Wnt信号通路的激活会促进肝纤维化,β-catenin在纤维化的肝组织中上调,大鼠HSC中β-catenin水平的增加与ECM的产生和增殖相关[25]。另外,在体外大鼠HSC转分化过程中以及在CCl4诱导的肝纤维化大鼠模型中,Wnt/β-catenin信号通路成分的表达水平发生了改变,即Wnt5a和FZD2在活化的大鼠HSC中表达水平上调,尽管没有检测到β-catenin位置的改变,这表明非典型Wnt信号也可能在HSC活化中起作用[26]。对Wnt/β-catenin通路实施不同干扰可以调节肝纤维化,如Wnt3a配体的存在,刺激体外人HSC活化[27]。相反,沉默配体Wnt5a减少大鼠HSC增殖和促纤维化基因表达[26]。使用Wnt拮抗剂和小分子抑制剂抑制Wnt/β-catenin信号传导,可减少体外啮齿类HSC活化和/或体内肝纤维化[28]。在慢性肝损伤小鼠模型中,Wnt配体的缺失会加重纤维化[29]。在肝脏特异性CTNNB1基因敲除小鼠中,与对照组动物相比,铁超负荷饮食诱导的炎症、脂肪变性、纤维化和肝恶性肿瘤的发生与进展,这与肝脏氧化应激增加和促进生存机制激活有关[30]。综上,适度调控Wnt信号通路可为改善肝纤维化的临床治疗提供新思路和新方向。
3.1.2 Wnt信号通路与NAFLD
NAFLD是一种以肝细胞内脂肪蓄积为特征的慢性疾病,最初表现为脂肪肝,但可进展为非酒精性脂肪性肝炎[31]。NAFLD通常与肥胖、糖尿病和代谢综合征有关,但它也可能影响非肥胖者,其患病率在世界范围内不断上升,是逐渐成为HCC发生的原因之一。Wnt信号通路参与了NAFLD的发生和发展,包括其并发症,如胰岛素抵抗、2型糖尿病和脂肪生成,但其机制尚未完全阐明[32]。根据相关实验[33]报道,Wnt信号通路可以通过调节其他细胞因子,如sRBP-1c、Fas和PPAR家族来调节肝脏的脂质合成代谢。癌症相关脂肪变性的小鼠模型显示激活Wnt信号通路增强了肿瘤起始细胞的生长,其中,肝脏浸润的巨噬细胞似乎是癌症相关脂肪变性小鼠脂肪肝相关致癌作用中Wnt配体的来源[34]。相反,在小鼠模型中,Wnt信号通路可保护肝脏免受酒精相关脂肪变性的影响[35]。此外,LRP6功能缺失的小鼠会出现高脂血症,体内给予Wnt3a后可以降低血脂水平[36]。儿童NAFLD也与Wnt信号通路失调有关。二十二碳六烯酸是一种膳食N-3长链多不饱和脂肪酸,对儿童NAFLD有益,经这种化合物治疗后,患者的巨噬细胞数量和Wnt3a表达水平均上调,巨噬细胞Wnt3a表达与肝祖细胞中的β-catenin磷酸化以及对肝祖细胞向肝细胞分化有关[37]。因此,Wnt信号通路在NAFLD中承担着重要角色,靶向Wnt信号通路可能成为未来治疗NAFLD的新策略。
3.1.3 Wnt信号通路与胆汁淤积性肝病
胆汁淤积性肝病是指肝内外各种原因造成胆汁形成、分泌和排泄障碍,胆汁不能正常流入十二指肠而进入血液,引起的一系列器质性损害、代谢失调和功能紊乱的肝胆系统疾病,其特征是胆汁流量减少,往往会导致胆汁酸等有毒亲胆物质的积聚[38]。越来越多的证据[39]表明,Wnt信号通路参与了胆汁流量的调节,肝脏特异性CTNNB1基因缺失的小鼠的胆汁酸稳态受损,血清和肝脏中的化合物水平升高,与此同时,与野生型动物相比,喂食初级胆汁酸会加剧胆汁淤积、肝纤维化和炎症。β-catenin的组成型活性致癌变异体(CTNNBΔCAhep)可诱导小鼠胆汁淤积和肝纤维化,与其影响了小鼠胆汁酸代谢和运输有关[40]。在原发性胆管炎和原发性硬化性胆管炎这两种慢性胆汁淤积性肝病中,Wnt/β-catenin信号通路的几个成分均上调,包括Wnt5a、Wnt13、Frzb和CTNNB1[41-42]。然而,Wnt信号通路也与胆汁淤积后的再生反应有关,特异性CTNNB1基因敲除的小鼠在胆汁淤积损伤后卵圆细胞活化减少[15],与此相似的是,过度表达β-catenin的转基因小鼠在胆汁淤积后显示出卵圆细胞再生能力的提高,从而改善了组织修复[43]。在以胆汁淤积为特征的硬化性胆管炎动物模型中,Wnt信号通路被认为通过诱导肝细胞向胆管细胞的转化来促进细胞再生[44]。此外,与野生型小鼠相比,Foxl1基因敲除小鼠在胆管结扎后胆管细胞和肝细胞的坏死程度和增殖受损程度更高,这一表型与胆管细胞中Wnt3a、Wnt7b和Cyclin D1的表达减少有关[45]。由此可知,Wnt信号通路与胆汁淤积性肝病关系密切,深入研究两者之间的关系可为胆汁淤积性肝病的治疗提供新的突破口。
3.2 Wnt信号通路与肝肿瘤的相关性
3.2.1 Wnt信号通路与HCC
HCC是肝脏恶性肿瘤中最常见的病理类型,第六大最常见的癌症,也是2020年全球癌症死亡的第三大原因[46]。Wnt/β-catenin级联的激活与早期HCC的发生有关,同时也与肿瘤进展有关。基因组研究[47]显示,在HCC中,30%~40%的肿瘤表现出Wnt/β-catenin级联的异常激活。大多数研究表明CTNNB1突变是一个有利的预后标志。例如,Wang等[48]利用荟萃分析得出结论:CTNNB1突变的HCC患者显示出更长的总生存期。Ding等[49]的一项研究也得出了类似的结果。研究[50]发现,Wnt信号通路还与HCC的干细胞分化、进展、转移和耐药性有关。一方面,β-catenin的过表达增加了HCC癌症干细胞的自我更新和体内致瘤性[51]。另一方面,激活的Wnt/β-catenin也与HCC患者对索拉非尼和瑞格非尼的耐药性有关[52]。这些研究发现都表明了Wnt信号通路在HCC发生的各个环节中的关键作用。在小鼠实验中发现,激活的β-catenin过度表达的转基因小鼠会发生肝肿大,但不会发生肝癌[53]。这个结果表明,Wnt信号通路单独激活可能不足以推动肝癌的发生,需要第二个信号与激活的β-catenin合作才能诱导肝癌的发生。在HCC中,大约10%的样本中发现了原癌基因c-Met和β-catenin的协同激活[54]。c-Met的过表达或激活的β-catenin单独通过流体动力注射不能促进小鼠HCC的形成,但是c-Met和激活的β-catenin共同通过流体动力注射后6~8周内诱导了肝癌的发生[55]。综上,深层次的研究分析Wnt信号通路在HCC病程中的作用机制,可有助于Wnt信号通路在HCC治疗领域提供有效的解决方案。
3.2.2 Wnt信号通路与胆管癌(cholangiocarcinoma,CCA)
CCA是一组具有胆道分化标志物表达的不同类型的恶性肿瘤,其中肝内胆管癌是仅次于HCC的第二常见的肝脏恶性肿瘤,其发病率在全球范围内呈上升趋势,具有侵袭性、诊断晚、难治性等特点,病死率高[56]。与HCC相似,Wnt/β-catenin信号通路的激活在CCA中非常普遍,并与肿瘤细胞的增殖和生存有关[57]。研究发现,在人类CCA细胞系中,Wnt2或CTNNB1的实验性敲除降低了CCA细胞的增殖,促进了细胞的凋亡[58],此外,β-catenin核定位的增加和质膜蛋白水平的降低与CCA恶性程度相关[59]。CCA的特点是具有高度促进结缔组织增生的间质,其中激活的巨噬细胞是Wnt配体的来源,并刺激CCA细胞中β-catenin的激活,从而促进CCA细胞的增殖[60]。其中,尤其是Wnt7b在人类CCA肿瘤以及转基因和化学诱导的CCA动物模型中上调[60],在这种情况下,巨噬细胞被确认为Wnt7b配体的主要来源,在CCA小鼠模型中,这些细胞的耗尽可以阻止CCA的生长。此外,Wnt/β-catenin抑制剂的使用也减少了小鼠和大鼠模型中的肿瘤生长[61]。然而,Wnt/β-catenin信号转导也会导致CCA的难治性,例如,CCA的多药耐药表型以β-catenin和P-糖蛋白上调为特征,P-糖蛋白是一种质膜泵,对包括化疗药物在内的药物发挥作用至关重要,沉默β-catenin可以下调P-糖蛋白从而逆转多药耐药细胞系[62]。一些基因通过与Wnt/β-catenin信号通路的相互作用对CCA的生长、迁移和化疗耐药发挥促肿瘤作用,例如,维甲酸受体γ(RARγ)在人CCA组织中表达上调,并与肿瘤分化差、预后差等临床特征有关。CCA RARγ高表达患者术后总生存率低于CCA RARγ低表达患者(中位生存期:9.2个月 vs 27.6个月,累积3年生存率:0 vs 36%,P<0.05)[63]。RARγ通过促进β-catenin的核转位来刺激CCA肿瘤细胞的增殖、迁移、侵袭和化疗耐药性[63]。因此,调控Wnt信号通路可能是阻止CCA进一步发展的可行策略。
3.2.3 Wnt信号通路与肝母细胞瘤(hepatoblastoma,HB)
HB是最常见的发生于儿童的肝脏恶性肿瘤,Wnt/β-catenin信号的异常构成了肝母细胞瘤的主要标志[64]。HB是人类癌症中CTNNB1突变率最高的(>50%)[65],在HB中,AXIN1/AXIN2、APC和LGR6功能缺失突变的发生率分别为4.5%、20.5%和12.5%[65]。HB根据基因表达特征不同分为C1型和C2型,C1型HB重现了胚胎晚期小鼠肝脏中观察到的基因表达,而C2型HB则更不成熟,类似于主要的胚胎型组织类型[66-67]。C2型HB是一种低分化、高增殖和侵袭性的肿瘤,高表达肝祖细胞标志物如AFP和CK19。与C2型HB相比,C1型HB的癌细胞增殖程度较低,成熟肝细胞标志物的表达水平较高。另外,与C2型HB相比,C1型HB患者的临床结果更好[67]。虽然C1型和C2型HB中β-catenin的突变率相似,但有关该蛋白的亚细胞位置具有重要差异,在未分化的C2型HB中,β-catenin主要位于细胞核,在C1型HB中主要靠近质膜[67],这种不同的定位导致了下游靶点的不同激活:C1型HB显示肝脏静脉周围区域相关的基因过度表达,如GLUL、RHBG、CYP2E1和CYP1A1。相反,C2型HB显示MYCN、BIRC5(编码抗凋亡蛋白Survivin)、NPM1、HDAC2和干细胞相关基因的表达增加,包括EpCAM、GJA1和SUZ12[67]。值得注意的是,在C2型HB中观察到MYCN、其他MYC基因的过度表达和丰富的MYC靶基因。与这些发现一致的是,MYC诱导的小鼠HB样肿瘤与人类C2亚型惊人地相似,在HB细胞中抑制MYC基因阻碍了体内的肿瘤形成[67]。此外,β-catenin与HB中的其他通路如Hippo信号通路合作,伴随着β-catenin和Hippo信号通路关键蛋白YAP1在小鼠体内的过度表达,导致了肿瘤的快速发展[68]。Wnt信号通路在抗肿瘤方面有着重要作用,深入分析其中的分子机制,利用这一过程可能是治疗HB的有效方法。
4. 治疗方法
鉴于Wnt信号在维持肝脏再生和动态平衡中起着关键作用,广谱Wnt信号抑制剂会对正常细胞产生不利影响,因此,特异性的Wnt/β-catenin信号调节因子是未来治疗肝脏疾病的一个重要方向。目前正在探索的旨在调节Wnt/β-catenin信号通路治疗肝脏疾病方法包括用单抗或小分子靶向Wnt配体和受体,抑制CK1、GSK3、APC、AXIN和Dishevelled蛋白相互作用,稳定CK11、GSK3、APC和AXIN,阻断β-连环蛋白与其核辅助因子相互作用(表1)。
表 1 针对Wnt/β-catenin信号传导的药物临床试验Table 1. Clinical trials of agents targeting Wnt/β-catenin signalling药物 类型 靶点 作用 阶段 临床试验记录 LGK974(WNT974) 融合蛋白 Wnt配体 FZD8融合蛋白与FZD8竞争结合Wnt配体 Ⅰ期 NCT01608867,NCT02050178, NCT02069145,NCT02092363 OMP-131R10 单抗 R-spondin 3 抑制 RSPO-LGR-ZNRF3/RNF43复合体 Ⅰ期 NCT02482441 OTSA101 单抗 FZD10 抗FZD10型单抗 Ⅰ期 NCT01469975 OMP-18R5 单抗 FZD受体 抗FZD受体型单抗 Ⅰ期 NCT01345201,NCT01957007, NCT01973309,NCT02005315 DKN-01 单抗 DKK1 抗DKK1型单抗,抑制非典型β-catenin传导途径 Ⅰ期, Ⅱ期 NCT01457417,NCT01711671, NCT02013154,NCT02375880 BHQ880 单抗 DKK1 抗DKK1型单抗,抑制非典型β-catenin传导途径 Ⅰ期, Ⅱ期 NCT00741377,NCT01302886, NCT01337752 Foxy-5 小肽 FZD受体 Wnt 5a类似物 Ⅰ期 NCT02020291,NCT02655952 PRI 724 小分子 β-catenin, CREB结合蛋白 下调β-catenin反应基因 Ⅰ期, Ⅱ期 NCT01302405,NCT01606579, NCT01764477,NCT02195440 SM08502 小分子 未知 抑制β-catenin传导途径 Ⅰ期 NCT03355066 5. 总结与展望
越来越多的证据表明,Wnt信号通路在肝脏再生、慢性肝病和肝脏恶性肿瘤中起着关键作用,可以促进疾病的发展。因此,深入探索Wnt信号通路在各类肝脏疾病发生发展过程中扮演的角色,可为推动靶向干预Wnt信号通路以防治肝脏疾病的临床应用提供可能性和可行性。然而,由于Wnt信号通路的复杂性,成功的治疗调控变得复杂,该通路由19个Wnt配体和15个受体、非典型的Wnt信号和与其他通路的串扰等可供选择的机制组成。正在进行的针对Wnt/β-catenin信号转导的药物临床试验还处于早期阶段,其中包括HCC和/或CCA患者在内的临床试验很少,没有一项试验涉及HB或其他形式的肝病患者,表明未来还需要进一步研究。然而,鉴于该途径在肝脏内稳态和再生中的关键作用,尤其是在慢性肝病患者中,必须谨慎评估Wnt/β-catenin靶向治疗。更深入地了解构成Wnt/β-Catenin通路的众多成分,以及它在肝脏健康和疾病中协调的复杂相互作用网络,将为临床治疗肝脏疾病提供更多的可能性。
-
表 1 针对Wnt/β-catenin信号传导的药物临床试验
Table 1. Clinical trials of agents targeting Wnt/β-catenin signalling
药物 类型 靶点 作用 阶段 临床试验记录 LGK974(WNT974) 融合蛋白 Wnt配体 FZD8融合蛋白与FZD8竞争结合Wnt配体 Ⅰ期 NCT01608867,NCT02050178, NCT02069145,NCT02092363 OMP-131R10 单抗 R-spondin 3 抑制 RSPO-LGR-ZNRF3/RNF43复合体 Ⅰ期 NCT02482441 OTSA101 单抗 FZD10 抗FZD10型单抗 Ⅰ期 NCT01469975 OMP-18R5 单抗 FZD受体 抗FZD受体型单抗 Ⅰ期 NCT01345201,NCT01957007, NCT01973309,NCT02005315 DKN-01 单抗 DKK1 抗DKK1型单抗,抑制非典型β-catenin传导途径 Ⅰ期, Ⅱ期 NCT01457417,NCT01711671, NCT02013154,NCT02375880 BHQ880 单抗 DKK1 抗DKK1型单抗,抑制非典型β-catenin传导途径 Ⅰ期, Ⅱ期 NCT00741377,NCT01302886, NCT01337752 Foxy-5 小肽 FZD受体 Wnt 5a类似物 Ⅰ期 NCT02020291,NCT02655952 PRI 724 小分子 β-catenin, CREB结合蛋白 下调β-catenin反应基因 Ⅰ期, Ⅱ期 NCT01302405,NCT01606579, NCT01764477,NCT02195440 SM08502 小分子 未知 抑制β-catenin传导途径 Ⅰ期 NCT03355066 -
[1] TREFTS E, GANNON M, WASSERMAN DH. The liver[J]. Curr Biol, 2017, 27( 21): R1147- R1151. DOI: 10.1016/j.cub.2017.09.019. [2] BAJAJ JS. Alcohol, liver disease and the gut microbiota[J]. Nat Rev Gastroenterol Hepatol, 2019, 16( 4): 235- 246. DOI: 10.1038/s41575-018-0099-1. [3] MANDATO C, di NUZZI A, VAJRO P. Nutrition and liver disease[J]. Nutrients, 2017, 10( 1): 9. DOI: 10.3390/nu10010009. [4] XIAO J, WANG F, WONG NK, et al. Global liver disease burdens and research trends: Analysis from a Chinese perspective[J]. J Hepatol, 2019, 71( 1): 212- 221. DOI: 10.1016/j.jhep.2019.03.004. [5] ASRANI SK, DEVARBHAVI H, EATON J, et al. Burden of liver diseases in the world[J]. J Hepatol, 2019, 70( 1): 151- 171. DOI: 10.1016/j.jhep.2018.09.014. [6] NUSSE R, CLEVERS H. Wnt/β-catenin signaling, disease, and emerging therapeutic modalities[J]. Cell, 2017, 169( 6): 985- 999. DOI: 10.1016/j.cell.2017.05.016. [7] LOH KM, van AMERONGEN R, NUSSE R. Generating cellular diversity and spatial form: Wnt signaling and the evolution of multicellular animals[J]. Dev Cell, 2016, 38( 6): 643- 655. DOI: 10.1016/j.devcel.2016.08.011. [8] NAPOLITANO T, SILVANO S, AYACHI C, et al. Wnt pathway in pancreatic development and pathophysiology[J]. Cells, 2023, 12( 4): 565. DOI: 10.3390/cells12040565. [9] RASLAN AA, YOON JK. WNT signaling in lung repair and regeneration[J]. Mol Cells, 2020, 43( 9): 774- 783. DOI: 10.14348/molcells.2020.0059. [10] STEINHART Z, ANGERS S. Wnt signaling in development and tissue homeostasis[J]. Development, 2018, 145( 11): dev146589. DOI: 10.1242/dev.146589. [11] ZHAN T, RINDTORFF N, BOUTROS M. Wnt signaling in cancer[J]. Oncogene, 2017, 36( 11): 1461- 1473. DOI: 10.1038/onc.2016.304. [12] CLEVERS H, NUSSE R. Wnt/β-catenin signaling and disease[J]. Cell, 2012, 149( 6): 1192- 1205. DOI: 10.1016/j.cell.2012.05.012. [13] MONGA SP, PEDIADITAKIS P, MULE K, et al. Changes in WNT/beta-catenin pathway during regulated growth in rat liver regeneration[J]. Hepatology, 2001, 33( 5): 1098- 1109. DOI: 10.1053/jhep.2001.23786. [14] CHEN TY, OH S, GREGORY S, et al. Single-cell omics analysis reveals functional diversification of hepatocytes during liver regeneration[J]. JCI Insight, 2020, 5( 22): e141024. DOI: 10.1172/jci.insight.141024. [15] APTE U, THOMPSON MD, CUI SS, et al. Wnt/beta-catenin signaling mediates oval cell response in rodents[J]. Hepatology, 2008, 47( 1): 288- 295. DOI: 10.1002/hep.21973. [16] NELSEN CJ, RICKHEIM DG, TIMCHENKO NA, et al. Transient expression of cyclin D1 is sufficient to promote hepatocyte replication and liver growth in vivo[J]. Cancer Res, 2001, 61( 23): 8564- 8568. [17] TAN XP, BEHARI J, CIEPLY B, et al. Conditional deletion of beta-catenin reveals its role in liver growth and regeneration[J]. Gastroenterology, 2006, 131( 5): 1561- 1572. DOI: 10.1053/j.gastro.2006.08.042. [18] PLANAS-PAZ L, ORSINI V, BOULTER L, et al. The RSPO-LGR4/5-ZNRF3/RNF43 module controls liver zonation and size[J]. Nat Cell Biol, 2016, 18( 5): 467- 479. DOI: 10.1038/ncb3337. [19] SUN TL, PIKIOLEK M, ORSINI V, et al. AXIN2+ pericentral hepatocytes have limited contributions to liver homeostasis and regeneration[J]. Cell Stem Cell, 2020, 26( 1): 97- 107. e 6. DOI: 10.1016/j.stem.2019.10.011. [20] JHO EH, ZHANG T, DOMON C, et al. Wnt/beta-catenin/Tcf signaling induces the transcription of Axin2, a negative regulator of the signaling pathway[J]. Mol Cell Biol, 2002, 22( 4): 1172- 1183. DOI: 10.1128/MCB.22.4.1172-1183.2002. [21] LUSTIG B, JERCHOW B, SACHS M, et al. Negative feedback loop of Wnt signaling through upregulation of conductin/axin2 in colorectal and liver tumors[J]. Mol Cell Biol, 2002, 22( 4): 1184- 1193. DOI: 10.1128/MCB.22.4.1184-1193.2002. [22] JUNG YS, JUN S, KIM MJ, et al. TMEM9 promotes intestinal tumorigenesis through vacuolar-ATPase-activated Wnt/β-catenin signalling[J]. Nat Cell Biol, 2018, 20( 12): 1421- 1433. DOI: 10.1038/s41556-018-0219-8. [23] HENDERSON NC, RIEDER F, WYNN TA. Fibrosis: From mechanisms to medicines[J]. Nature, 2020, 587( 7835): 555- 566. DOI: 10.1038/s41586-020-2938-9. [24] SEKI E, SCHWABE RF. Hepatic inflammation and fibrosis: Functional links and key pathways[J]. Hepatology, 2015, 61( 3): 1066- 1079. DOI: 10.1002/hep.27332. [25] GE WS, WANG YJ, WU JX, et al. β-catenin is overexpressed in hepatic fibrosis and blockage of Wnt/β-catenin signaling inhibits hepatic stellate cell activation[J]. Mol Med Rep, 2014, 9( 6): 2145- 2151. DOI: 10.3892/mmr.2014.2099. [26] XIONG WJ, HU LJ, JIAN YC, et al. Wnt5a participates in hepatic stellate cell activation observed by gene expression profile and functional assays[J]. World J Gastroenterol, 2012, 18( 15): 1745- 1752. DOI: 10.3748/wjg.v18.i15.1745. [27] MYUNG SJ, YOON JH, GWAK GY, et al. Wnt signaling enhances the activation and survival of human hepatic stellate cells[J]. FEBS Lett, 2007, 581( 16): 2954- 2958. DOI: 10.1016/j.febslet.2007.05.050. [28] TOKUNAGA Y, OSAWA Y, OHTSUKI T, et al. Selective inhibitor of Wnt/β-catenin/CBP signaling ameliorates hepatitis C virus-induced liver fibrosis in mouse model[J]. Sci Rep, 2017, 7( 1): 325. DOI: 10.1038/s41598-017-00282-w. [29] IRVINE KM, CLOUSTON AD, GADD VL, et al. Deletion of Wntless in myeloid cells exacerbates liver fibrosis and the ductular reaction in chronic liver injury[J]. Fibrogenesis Tissue Repair, 2015, 8: 19. DOI: 10.1186/s13069-015-0036-7. [30] PREZIOSI ME, SINGH S, VALORE EV, et al. Mice lacking liver-specific β-catenin develop steatohepatitis and fibrosis after iron overload[J]. J Hepatol, 2017, 67( 2): 360- 369. DOI: 10.1016/j.jhep.2017.03.012. [31] GEH D, ANSTEE QM, REEVES HL. NAFLD-associated HCC: Progress and opportunities[J]. J Hepatocell Carcinoma, 2021, 8: 223- 239. DOI: 10.2147/JHC.S272213. [32] MONGA SP. β-catenin signaling and roles in liver homeostasis, injury, and tumorigenesis[J]. Gastroenterology, 2015, 148( 7): 1294- 1310. DOI: 10.1053/j.gastro.2015.02.056. [33] SEO MH, LEE JM, HONG SW, et al. Exendin-4 inhibits hepatic lipogenesis by increasing β-catenin signaling[J]. PLoS One, 2016, 11( 12): e0166913. DOI: 10.1371/journal.pone.0166913. [34] DEBEBE A, MEDINA V, CHEN CY, et al. Wnt/β-catenin activation and macrophage induction during liver cancer development following steatosis[J]. Oncogene, 2017, 36( 43): 6020- 6029. DOI: 10.1038/onc.2017.207. [35] LIU SG, YEH TH, SINGH VP, et al. β-catenin is essential for ethanol metabolism and protection against alcohol-mediated liver steatosis in mice[J]. Hepatology, 2012, 55( 3): 931- 940. DOI: 10.1002/hep.24766. [36] GO GW, SRIVASTAVA R, HERNANDEZ-ONO A, et al. The combined hyperlipidemia caused by impaired Wnt-LRP6 signaling is reversed by Wnt3a rescue[J]. Cell Metab, 2014, 19( 2): 209- 220. DOI: 10.1016/j.cmet.2013.11.023. [37] CARPINO G, NOBILI V, RENZI A, et al. Macrophage activation in pediatric nonalcoholic fatty liver disease(NAFLD) correlates with hepatic progenitor cell response via Wnt3a pathway[J]. PLoS One, 2016, 11( 6): e0157246. DOI: 10.1371/journal.pone.0157246. [38] Chinese Society of Hepatology, Chinese Medical Association. Guideline on the management of cholestasis liver diseases[J]. J Clin Hepatol, 2022, 38( 1): 62- 69. DOI: 10.3760/cma.j.cn112138-20211112-00795.中华医学会肝病学分会. 胆汁淤积性肝病管理指南(2021年)[J]. 临床肝胆病杂志, 2022, 38( 1): 62- 69. DOI: 10.3760/cma.j.cn112138-20211112-00795. [39] YEH TH, KRAULAND L, SINGH V, et al. Liver-specific β-catenin knockout mice have bile canalicular abnormalities, bile secretory defect, and intrahepatic cholestasis[J]. Hepatology, 2010, 52( 4): 1410- 1419. DOI: 10.1002/hep.23801. [40] LEMBERGER UJ, FUCHS CD, KARER M, et al. Hepatocyte specific expression of an oncogenic variant of β-catenin results in cholestatic liver disease[J]. Oncotarget, 2016, 7( 52): 86985- 86998. DOI: 10.18632/oncotarget.13521. [41] SHACKEL NA, MCGUINNESS PH, ABBOTT CA, et al. Identification of novel molecules and pathogenic pathways in primary biliary cirrhosis: CDNA array analysis of intrahepatic differential gene expression[J]. Gut, 2001, 49( 4): 565- 576. DOI: 10.1136/gut.49.4.565. [42] TANAKA A, LEUNG PS, KENNY TP, et al. Genomic analysis of differentially expressed genes in liver and biliary epithelial cells of patients with primary biliary cirrhosis[J]. J Autoimmun, 2001, 17( 1): 89- 98. DOI: 10.1006/jaut.2001.0522. [43] THOMPSON MD, AWUAH P, SINGH S, et al. Disparate cellular basis of improved liver repair in beta-catenin-overexpressing mice after long-term exposure to 3, 5-diethoxycarbonyl-1, 4-dihydrocollidine[J]. Am J Pathol, 2010, 177( 4): 1812- 1822. DOI: 10.2353/ajpath.2010.100173. [44] OKABE H, YANG J, SYLAKOWSKI K, et al. Wnt signaling regulates hepatobiliary repair following cholestatic liver injury in mice[J]. Hepatology, 2016, 64( 5): 1652- 1666. DOI: 10.1002/hep.28774. [45] SACKETT SD, GAO Y, SHIN S, et al. Foxl1 promotes liver repair following cholestatic injury in mice[J]. Lab Invest, 2009, 89( 12): 1387- 1396. DOI: 10.1038/labinvest.2009.103. [46] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68( 6): 394- 424. DOI: 10.3322/caac.21492. [47] GILES RH, van ES JH, CLEVERS H. Caught up in a Wnt storm: Wnt signaling in cancer[J]. Biochim Biophys Acta, 2003, 1653( 1): 1- 24. DOI: 10.1016/s0304-419x(03)00005-2. [48] WANG Z, SHENG YY, GAO XM, et al. β-catenin mutation is correlated with a favorable prognosis in patients with hepatocellular carcinoma[J]. Mol Clin Oncol, 2015, 3( 4): 936- 940. DOI: 10.3892/mco.2015.569. [49] DING X, YANG Y, HAN BD, et al. Transcriptomic characterization of hepatocellular carcinoma with CTNNB1 mutation[J]. PLoS One, 2014, 9( 5): e95307. DOI: 10.1371/journal.pone.0095307. [50] LIAO X, SONG G, XU ZH, et al. Oxaliplatin resistance is enhanced by saracatinib via upregulation Wnt-ABCG1 signaling in hepatocellular carcinoma[J]. BMC Cancer, 2020, 20( 1): 31. DOI: 10.1186/s12885-019-6480-9. [51] LEUNG HW, LEUNG CON, LAU EY, et al. EPHB2 activates β-catenin to enhance cancer stem cell properties and drive sorafenib resistance in hepatocellular carcinoma[J]. Cancer Res, 2021, 81( 12): 3229- 3240. DOI: 10.1158/0008-5472.CAN-21-0184. [52] KARABICICI M, AZBAZDAR Y, OZHAN G, et al. Changes in Wnt and TGF-β signaling mediate the development of regorafenib resistance in hepatocellular carcinoma cell line HuH7[J]. Front Cell Dev Biol, 2021, 9: 639779. DOI: 10.3389/fcell.2021.639779. [53] CADORET A, OVEJERO C, SAADI-KHEDDOUCI S, et al. Hepatomegaly in transgenic mice expressing an oncogenic form of beta-catenin[J]. Cancer Res, 2001, 61( 8): 3245- 3249. [54] ZHAN N, MICHAEL AA, WU KY, et al. The effect of selective c-MET inhibitor on hepatocellular carcinoma in the MET-active, β-catenin-mutated mouse model[J]. Gene Expr, 2018, 18( 2): 135- 147. DOI: 10.3727/105221618X15174108894682. [55] PATIL MA, LEE SA, MACIAS E, et al. Role of cyclin D1 as a mediator of c-met- and beta-catenin-induced hepatocarcinogenesis[J]. Cancer Res, 2009, 69( 1): 253- 261. DOI: 10.1158/0008-5472.CAN-08-2514. [56] BANALES JM, CARDINALE V, CARPINO G, et al. Expert consensus document: Cholangiocarcinoma: Current knowledge and future perspectives consensus statement from the European Network for the Study of Cholangiocarcinoma(ENS-CCA)[J]. Nat Rev Gastroenterol Hepatol, 2016, 13( 5): 261- 280. DOI: 10.1038/nrgastro.2016.51. [57] TOKUMOTO N, IKEDA S, ISHIZAKI Y, et al. Immunohistochemical and mutational analyses of Wnt signaling components and target genes in intrahepatic cholangiocarcinomas[J]. Int J Oncol, 2005, 27( 4): 973- 980. [58] ZHANG KS, ZHOU Q, WANG YF, et al. Inhibition of Wnt signaling induces cell apoptosis and suppresses cell proliferation in cholangiocarcinoma cells[J]. Oncol Rep, 2013, 30( 3): 1430- 1438. DOI: 10.3892/or.2013.2560. [59] SUGIMACHI K, TAGUCHI K, AISHIMA S, et al. Altered expression of beta-catenin without genetic mutation in intrahepatic cholangiocarcinoma[J]. Mod Pathol, 2001, 14( 9): 900- 905. DOI: 10.1038/modpathol.3880409. [60] LOILOME W, BUNGKANJANA P, TECHASEN A, et al. Activated macrophages promote Wnt/β-catenin signaling in cholangiocarcinoma cells[J]. Tumour Biol, 2014, 35( 6): 5357- 5367. DOI: 10.1007/s13277-014-1698-2. [61] BOULTER L, GUEST RV, KENDALL TJ, et al. WNT signaling drives cholangiocarcinoma growth and can be pharmacologically inhibited[J]. J Clin Invest, 2015, 125( 3): 1269- 1285. DOI: 10.1172/JCI76452. [62] SHEN DY, ZHANG W, ZENG X, et al. Inhibition of Wnt/β-catenin signaling downregulates P-glycoprotein and reverses multi-drug resistance of cholangiocarcinoma[J]. Cancer Sci, 2013, 104( 10): 1303- 1308. DOI: 10.1111/cas.12223. [63] HUANG GL, LUO Q, RUI G, et al. Oncogenic activity of retinoic acid receptor γ is exhibited through activation of the Akt/NF-κB and Wnt/β-catenin pathways in cholangiocarcinoma[J]. Mol Cell Biol, 2013, 33( 17): 3416- 3425. DOI: 10.1128/MCB.00384-13. [64] KOCH A, DENKHAUS D, ALBRECHT S, et al. Childhood hepatoblastomas frequently carry a mutated degradation targeting box of the beta-catenin gene[J]. Cancer Res, 1999, 59( 2): 269- 273. [65] FORBES SA, BEARE D, BOUTSELAKIS H, et al. COSMIC: Somatic cancer genetics at high-resolution[J]. Nucleic Acids Res, 2017, 45( D1): D777- D783. DOI: 10.1093/nar/gkw1121. [66] ARMENGOL C, CAIRO S, FABRE M, et al. Wnt signaling and hepatocarcinogenesis: The hepatoblastoma model[J]. Int J Biochem Cell Biol, 2011, 43( 2): 265- 270. DOI: 10.1016/j.biocel.2009.07.012. [67] CAIRO S, ARMENGOL C, DE REYNIÈS A, et al. Hepatic stem-like phenotype and interplay of Wnt/beta-catenin and Myc signaling in aggressive childhood liver cancer[J]. Cancer Cell, 2008, 14( 6): 471- 484. DOI: 10.1016/j.ccr.2008.11.002. [68] TAO JY, CALVISI DF, RANGANATHAN S, et al. Activation of β-catenin and Yap1 in human hepatoblastoma and induction of hepatocarcinogenesis in mice[J]. Gastroenterology, 2014, 147( 3): 690- 701. DOI: 10.1053/j.gastro.2014.05.004. -




 PDF下载 ( 936 KB)
PDF下载 ( 936 KB)


 下载:
下载:

 下载:
下载: