基于孟德尔随机化的肝功能和脂质代谢水平与睡眠障碍的因果关联分析
DOI: 10.12449/JCH241020
Causal association of liver function and lipid metabolism levels with sleep disorders based on Mendelian randomization
-
摘要:
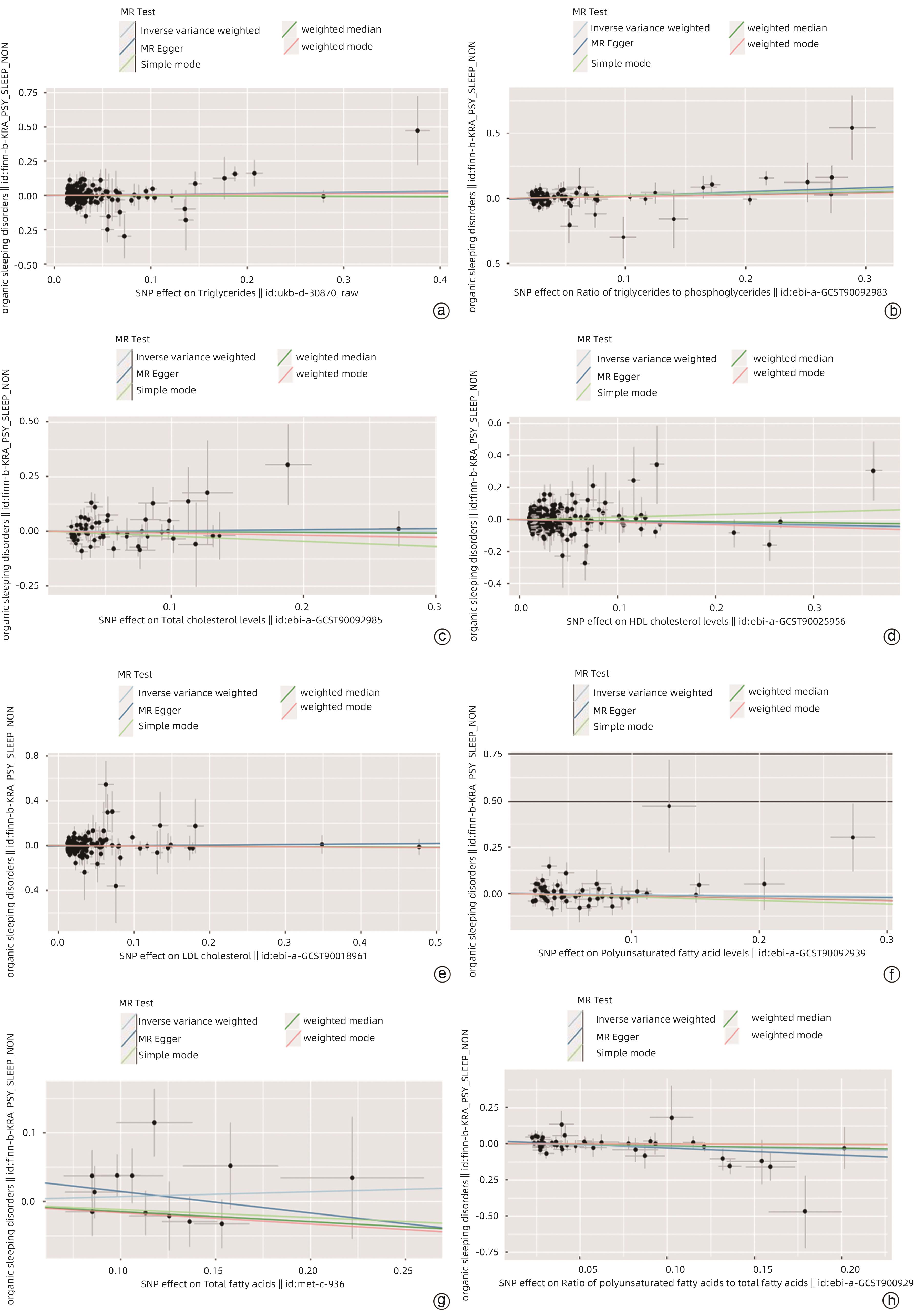
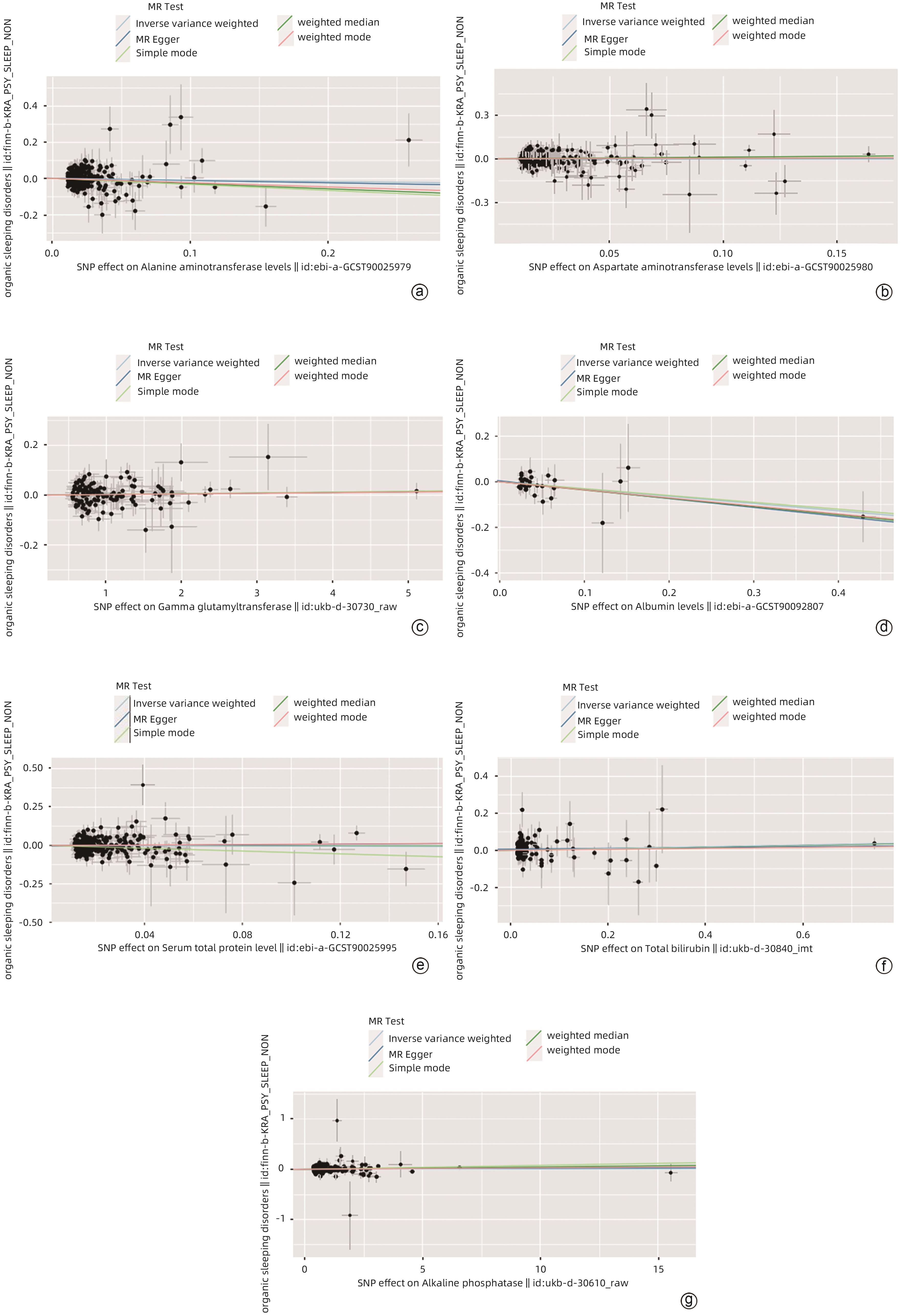
目的 采用孟德尔随机化分析肝功能和脂质代谢水平与睡眠障碍的因果关联。 方法 对GWAS进行分析,暴露因素为肝功能和脂质代谢水平[ALT、AST、GGT、Alb、血清总蛋白(TP)、TBil、ALP、TG、TG与磷酸甘油酯的比例(TG/G3P)、TC、HDL-C、LDL-C、多不饱和脂肪酸(PUFA)、总脂肪酸(TFA)、PUFA/TFA],结局因素为睡眠障碍(非器质性)。采用逆方差加权法(IVW)、MR-Egger法、Simple Mode法、加权中位数法和Weighted Mode法等回归模型进行孟德尔随机化分析。 结果 血清Alb(OR=0.728,95%CI:0.535~0.989,P<0.05),HDL-C(OR=0.879,95%CI:0.784~0.986,P<0.05)和PUFA/TFA(OR=0.800,95%CI:0.642~0.998,P<0.05)与睡眠障碍呈负相关。TG/G3P(OR=1.222,95%CI:1.044~1.431,P<0.05)与睡眠障碍呈正相关。孟德尔随机化结果未显示ALT、AST、GGT、TP、TBil、ALP、TG、TC、LDL-C、PUFA、TFA与睡眠障碍有因果关系(P值均>0.05)。ME-Egger截距测试结果表明分析结果不存在多效性(P>0.05),孟德尔随机化在本研究中为因果推断的有效方法。 结论 根据孟德尔随机化分析结果,肝功能和脂质代谢水平与睡眠障碍之间存在显著关联。在预测睡眠障碍的发生风险以及干预方面,可以考虑利用肝功能和脂质代谢水平作为睡眠障碍发生风险以及干预的指标。 Abstract:Objective To investigate the causal association of liver function and lipid metabolism levels with sleep disorders based on the Mendelian randomization analysis. Methods The analysis was conducted using the data from genome-wide association studies, with the exposure factors of liver function and lipid metabolism levels (alanine aminotransferase [ALT], aspartate aminotransferase [AST], gamma-glutamyl transpeptidase [GGT], albumin [Alb], serum total protein [TP], total bilirubin [TBil], alkaline phosphatase [ALP], triglyceride [TG], triglyceride-to-glycerol-3-phosphate [TG/G3P] ratio, total cholesterol [TC], high-density lipoprotein cholesterol [HDL-C], low-density lipoprotein cholesterol [LDL-C], poly-unsaturated fatty acids [PUFA], total fatty acids [TFA], PUFA/TFA ratio) and the outcome factor of sleep disorders (nonorganic). The regression models including inverse variance weighted, MR-Egger, Simple mode, weighted median, and Weighted mode were used to perform the Mendelian randomization analysis. Results Serum Alb (odds ratio [OR]=0.728, 95% confidence interval [CI]: 0.535 — 0.989, P<0.05), HDL-C (OR=0.879, 95%CI: 0.784 — 0.986, P<0.05), and PUFA/TFA ratio (OR=0.800, 95%CI: 0.642 — 0.998, P<0.05) were negatively associated with sleep disorders, while TG/G3P ratio (OR=1.222, 95%CI: 1.044 — 1.431, P<0.05) was positively associated with sleep disorders. The results of Mendelian randomization did not show a causal association of ALT, AST, GGT, TP, TBil, ALP, TG, TC, LDL-C, PUFA, and TFA with sleep disorders (all P>0.05). The results of the MR-Egger intercept test showed no pleiotropy (P>0.05), and Mendelian randomization was a valid method for causal inference in this study. Conclusion According to the results of the Mendelian randomization analysis, liver function and lipid metabolism show significant association with sleep disorders. Liver function and lipid metabolism can be used as indicators for predicting the risk of sleep disorders and performing intervention. -
Key words:
- Liver Function /
- Lipid Metabolism /
- Sleep Disorders /
- Mendelian Randomization Analysis
-
表 1 样本数据基本信息
Table 1. Basic information of sample data
数据名称 年份 人群 SNP数量 GWASID ALT 2021 欧洲人 4 231 965 ebi-a-GCST90025979 AST 2021 欧洲人 4 231 525 ebi-a-GCST90025980 GGT 2018 欧洲人 13 586 026 ukb-d-30730_raw Alb 2022 欧洲人 11 590 399 ebi-a-GCST90092807 TP 2021 欧洲人 4 218 824 ebi-a-GCST90025995 TBil 2018 欧洲人 13 585 986 ukb-d-30840_irnt ALP 2018 欧洲人 13 586 006 ukb-d-30610_raw TG 2018 欧洲人 13 586 007 ukb-d-30870_raw TG/G3P 2022 欧洲人 11 590 399 ebi-a-GCST90092983 TC 2022 欧洲人 13 586 006 ebi-a-GCST90092985 HDL-C 2021 欧洲人 4 218 934 ebi-a-GCST90025956 LDL-C 2021 欧洲人 19 037 976 ebi-a-GCST90018961 PUFA 2022 欧洲人 11 590 399 ebi-a-GCST90092939 TFA 2016 欧洲人 11 412 092 met-c-936 PUFA/TFA 2022 欧洲人 11 590 399 ebi-a-GCST90092941 睡眠障碍 2021 欧洲人 16 380 466 Finn-KRA_PSY_SLEEP_NONORG 表 2 孟德尔随机化结果
Table 2. Mendelian Randomization Results
暴露因素 分析方法 B值 P值 OR 95%CI P多效性 P异质性 ALT IVW -0.084 0.388 0.919 0.759~1.113 0.781 0.255 AST IVW -0.026 0.774 0.974 0.817~1.162 0.926 0.640 GGT IVW 0.003 0.300 1.003 0.997~1.008 0.614 0.976 Alb IVW -0.318 0.042 0.728 0.535~0.989 0.721 0.986 TP IVW -0.043 0.646 0.957 0.795~1.153 0.410 0.551 TBil IVW 0.051 0.181 1.052 0.998~1.134 0.085 0.859 ALP IVW <-0.001 0.864 1.005 0.996~1.005 0.598 0.407 TG IVW <0.001 0.864 1.000 0.996~1.005 0.598 0.407 TG/G3P IVW 0.201 0.013 1.222 1.044~1.431 0.257 0.865 TC IVW -0.003 0.976 0.997 0.801~1.241 0.784 0.117 HDL-C IVW -0.129 0.027 0.879 0.784~0.986 0.696 0.221 LDL-C IVW -0.034 0.656 0.966 0.831~1.124 0.207 0.446 PUFA IVW 0.062 0.502 0.940 0.784~1.123 0.901 0.277 TFA IVW 0.071 0.480 1.073 0.882~1.307 0.348 0.402 PIFA/TFA IVW -0.223 0.047 0.800 0.642~0.998 0.087 0.757 -
[1] SATEIA MJ. International classification of sleep disorders-third edition: Highlights and modifications[J]. Chest, 2014, 146( 5): 1387- 1394. DOI: 10.1378/chest.14-0970. [2] ZHANG JH, ZHANG XQ, ZHANG KX, et al. An updated of meta-analysis on the relationship between mobile phone addiction and sleep disorder[J]. J Affect Disord, 2022, 305: 94- 101. DOI: 10.1016/j.jad.2022.02.008. [3] JAHRAMI HA, ALHAJ OA, HUMOOD AM, et al. Sleep disturbances during the COVID-19 pandemic: A systematic review, meta-analysis, and meta-regression[J]. Sleep Med Rev, 2022, 62: 101591. DOI: 10.1016/j.smrv.2022.101591. [4] NIE QR, SHEN Y, LUO MQ, et al. Analysis of sleep for the American population: Result from NHANES database[J]. J Affect Disord, 2024, 347: 134- 143. DOI: 10.1016/j.jad.2023.11.082. [5] CHU XM, LIU L, YE J, et al. Insomnia affects the levels of plasma bilirubin and protein metabolism: An observational study and GWGEIS in UK Biobank cohort[J]. Sleep Med, 2021, 85: 184- 190. DOI: 10.1016/j.sleep.2021.05.040. [6] CHEN LD, HUANG JF, CHEN GP, et al. Association and gender difference analysis of obstructive sleep apnea hypopnea syndrome and liver injury[J]. Natl Med J China, 2022, 102( 8): 550- 554. DOI: 10.3760/cma.j.cn112137-20210617-01371.陈理达, 黄杰凤, 陈公平, 等. 阻塞性睡眠呼吸暂停低通气综合征与肝损伤的关联及性别差异分析[J]. 中华医学杂志, 2022, 102( 8): 550- 554. DOI: 10.3760/cma.j.cn112137-20210617-01371. [7] PAN QY, LI HQ, GAN XY, et al. Relationship between slow-wave sleep and serum γ-glutamine transaminase in non-obese men with obstructive sleep apnea-hypopnea syndrome[J]. Schlaf Atmung, 2023, 27( 5): 1717- 1724. DOI: 10.1007/s11325-022-02775-z. [8] PROCHAZKOVA P, SONKA K, ROUBALOVA R, et al. Investigation of anti-neuronal antibodies and disparity in central hypersomnias[J]. Sleep Med, 2024, 113: 220- 231. DOI: 10.1016/j.sleep.2023.11.039. [9] SÖKÜCÜ SN, AYDıN Ş, SATıCı C, et al. Triglyceride-glucose index as a predictor of obstructive sleep apnoea severity in the absence of traditional risk factors[J]. Arq Neuropsiquiatr, 2023, 81( 10): 891- 897. DOI: 10.1055/s-0043-1776411. [10] LI LM, YOU WY, REN W. The ZJU index is a powerful index for identifying NAFLD in the general Chinese population[J]. Acta Diabetol, 2017, 54( 10): 905- 911. DOI: 10.1007/s00592-017-1024-8. [11] WANG LP, NIE GQ, YAN FQ, et al. The ZJU index is associated with the risk of obstructive sleep apnea syndrome in Chinese middle-aged and older people: A cross-sectional study[J]. Lipids Health Dis, 2023, 22( 1): 207. DOI: 10.1186/s12944-023-01974-1. [12] YU TQ, XU WT, SU YN, et al. Mendelian randomization: The basic principles, methods and limitations[J]. Chin J Evid Based Med, 2021, 21( 10): 1227- 1234. DOI: 10.7507/1672-2531.202107008.于天琦, 徐文涛, 苏雅娜, 等. 孟德尔随机化研究基本原理、方法和局限性[J]. 中国循证医学杂志, 2021, 21( 10): 1227- 1234. DOI: 10.7507/1672-2531.202107008. [13] HE SM, ZHANG Y, PENG LQ, et al. Research progress of propensity score and Mendelian randomization in China[J]. Chin J Dis Contr Prev, 2022, 26( 3): 325- 330. DOI: 10.16462/j.cnki.zhjbkz.2022.03.014.和思敏, 张雨, 彭刘庆, 等. 倾向性评分与孟德尔随机化国内研究现状[J]. 中华疾病控制杂志, 2022, 26( 3): 325- 330. DOI: 10.16462/j.cnki.zhjbkz.2022.03.014. [14] WANG J, ZHANG GY, CHENG S. Good practices in Mendelian randomization: Common designs, key challenges, and optimization in Mendelian randomization analysis[J]. J Cap Med Univ, 2023, 9( 6): 1087- 1094.王晶, 张国燕, 程杉. 孟德尔随机化的良好实践: 孟德尔随机化分析的常见设计、关键挑战及优化[J]. 首都医科大学学报, 2023, 9( 6): 1087- 1094. [15] PINGAULT JB, O’REILLY PF, SCHOELER T, et al. Using genetic data to strengthen causal inference in observational research[J]. Nat Rev Genet, 2018, 19( 9): 566- 580. DOI: 10.1038/s41576-018-0020-3. [16] ELSWORTH B, LYON M, ALEXANDER T, et al. The MRC IEU OpenGWAS data infrastructure[J]. bioRxiv, 2020. DOI: 10.1101/2020.08.10.244293 [17] HEMANI G, ZHENG J, ELSWORTH B, et al. The MR-Base platform supports systematic causal inference across the human phenome[J]. Elife, 2018, 7: e34408. DOI: 10.7554/eLife.34408. [18] BARTON AR, SHERMAN MA, MUKAMEL RE, et al. Whole-exome imputation within UK Biobank powers rare coding variant association and fine-mapping analyses[J]. Nat Genet, 2021, 53( 8): 1260- 1269. DOI: 10.1038/s41588-021-00892-1. [19] SAKAUE S, KANAI M, TANIGAWA Y, et al. A cross-population atlas of genetic associations for 220 human phenotypes[J]. Nat Genet, 2021, 53( 10): 1415- 1424. DOI: 10.1038/s41588-021-00931-x. [20] RICHARDSON TG, LEYDEN GM, WANG Q, et al. Characterising metabolomic signatures of lipid-modifying therapies through drug target Mendelian randomisation[J]. PLoS Biol, 2022, 20( 2): e3001547. DOI: 10.1371/journal.pbio.3001547. [21] Genetics TREHEARNE A., lifestyle and environment. UK Biobank is an open access resource following the lives of 500, 000 participants to improve the health of future generations[J]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz, 2016, 59( 3): 361- 367. DOI: 10.1007/s00103-015-2297-0. [22] OLLIER W, SPROSEN T, PEAKMAN T. UK Biobank: From concept to reality[J]. Pharmacogenomics, 2005, 6( 6): 639- 646. DOI: 10.2217/14622416.6.6.639. [23] KETTUNEN J, DEMIRKAN A, WÜRTZ P, et al. Genome-wide study for circulating metabolites identifies 62 loci and reveals novel systemic effects of LPA[J]. Nat Commun, 2016, 7: 11122. DOI: 10.1038/ncomms11122. [24] FERINI-STRAMBI L, LIGUORI C, LUCEY BP, et al. Role of sleep in neurodegeneration: The consensus report of the 5th Think Tank World Sleep Forum[J]. Neurol Sci, 2024, 45( 2): 749- 767. DOI: 10.1007/s10072-023-07232-7. [25] ZHAI XJ, ZHAO HY, YANG M, et al. Relationship between abnormal lipid metabolism and insomnia in elderly hypertensive patients[J]. Clin J Med Offic, 2022, 50( 9): 972- 974. DOI: 10.16680/j.1671-3826.2022.09.28.翟晓君, 赵会颖, 杨萌, 等. 老年高血压患者脂质代谢异常与失眠关系研究[J]. 临床军医杂志, 2022, 50( 9): 972- 974. DOI: 10.16680/j.1671-3826.2022.09.28. [26] SANG D, LIN KT, YANG YN, et al. Prolonged sleep deprivation induces a cytokine-storm-like syndrome in mammals[J]. Cell, 2023, 186( 25): 5500- 5516. e 21. DOI: 10.1016/j.cell.2023.10.025. [27] MOSTAFA AM, HAFEZ SM, ABDULLAH NM, et al. Fatigue, depression, and sleep disorders are more prevalent in patients with metabolic-associated fatty liver diseases[J]. Eur J Gastroenterol Hepatol, 2024, 36( 5): 665- 673. DOI: 10.1097/MEG.0000000000002752. [28] LEE CH, MURRELL CE, CHU A, et al. Circadian regulation of apolipoproteins in the brain: Implications in lipid metabolism and disease[J]. Int J Mol Sci, 2023, 24( 24): 17415. DOI: 10.3390/ijms242417415. [29] CHU YX, ZHANG YJ, LIU JX, et al. An integrated liver, hippocampus and serum metabolomics based on UPLC-Q-TOF-MS revealed the therapeutical mechanism of Ziziphi Spinosae Semen in p-chlorophenylalanine-induced insomnia rats[J]. Biomed Chromatogr, 2024, 38( 3): e5796. DOI: 10.1002/bmc.5796. -



 PDF下载 ( 2416 KB)
PDF下载 ( 2416 KB)

 下载:
下载: