肝硬化合并脓毒症患者短期住院死亡的Cox比例风险预测模型建立及评价
DOI: 10.3969/j.issn.1001-5256.2023.05.014
Establishment and evaluation of a multivariate Cox proportional-hazards prediction model for mortality during short-term hospitalization in patients with liver cirrhosis and sepsis
-
摘要:
目的 构建肝硬化合并脓毒症患者短期住院死亡的Cox比例风险预测模型。 方法 回顾性收集2012年1月—2022年8月昆明市第三人民医院收治的336例肝硬化合并脓毒症患者的临床资料。依据患者短期住院期间是否死亡,分为死亡组(n=40)和生存组(n=296)。收集人口学资料、合并症及临床生化指标,比较各观察指标在两组中的差异。计量资料呈正态分布两组间比较采用成组t检验;计量资料呈偏态分布两组间比较采用Mann-Whitney U检验;计数资料两组间比较采用χ2检验。采用Cox多因素分析筛选变量,据此构建Cox比例风险预测模型并计算风险比(HR)及95%CI。计算C指数来检验其预测精度。绘制列线图可视化展示Cox比例风险预测模型,绘制校准曲线以观察模型预测结果与实际情况的符合程度。 结果 336例患者中男261例(77.7%),女75例(22.3%),平均年龄(50.0±10.6)岁。其中死亡40例,住院时间8.2~23.0天,平均住院时间(16.8±11.3)天。与生存组相比较,死亡组的年龄(≥60岁)、近2周有创操作史、消化道出血、HE、HRS、改良MEWS评分、PT、APTT、INR、D-D、CD4/CD8、Lac、WBC、NE、TBil、IL-6、PCT、hsCRP、BUN、Cr水平均较高,差异具有统计学意义(P值均<0.05);RBC、Hb、TP、白蛋白(Alb)、TC、LDL、HDL水平均较低,差异均有统计学意义(P值均<0.05)。多因素Cox回归分析,年龄(HR=2.602;95%CI:1.277~5.303,P=0.008)、HE(HR=2.516;95%CI:1.258~5.033,P=0.009)、HRS(HR=2.324;95%CI:1.010~5.349,P=0.047)、hsCRP(HR=1.008;95%CI:1.003~1.013,P=0.004)、改良早期预警评分(MEWS)(HR=1.205;95%CI:1.022~1.422,P=0.027)、PT(HR=1.076,95%CI:1.030~1.124,P=0.027)是肝硬化合并脓毒症患者死亡的独立影响因素。C-指数为0.857(95%CI:0.815~0.920),提示模型的预测准确性较高。绘制校准图提示模型预测风险与实际发生风险的一致性较好。 结论 构建的肝硬化合并脓毒症患者短期住院死亡Cox比例风险预测模型可用于预测新诊断肝硬化合并脓毒症患者在短期住院期间发生死亡的风险,从而指导临床医护人员采取针对性的干预措施,最终避免或降低患者发生死亡的可能性。 Abstract:Objective To establish a Cox proportional-hazards prediction model for mortality during short-term hospitalization in patients with liver cirrhosis and sepsis. Methods A retrospective analysis was performed for the clinical data of 336 patients with liver cirrhosis and sepsis who were admitted to The Third People's Hospital of Kunming from January 2012 to August 2022, and according to whether the patient died during short-term hospitalization, they were divided into death group with 40 patients and survival group with 296 patients. Demographic data, comorbidities, and clinical biochemical parameters were collected and compared between the two groups. The independent-samples t test was used for comparison of normally distributed continuous data between two groups, and the Mann-Whitney U test was used for comparison of non-normally distributed continuous data between two groups; the chi-square test was used for comparison of categorical data between two groups. The multivariate Cox analysis was used for screening of variables, then a Cox proportional-hazards prediction model was established, and hazard ratio (HR) and its 95% confidence interval [CI] were calculated; C-index index was used to evaluate the prediction accuracy of the model. The Cox proportional-hazards prediction model was visualized by a nomogram, and calibration curve was plotted to evaluate the consistency between the prediction results of the model and the actual condition. Results Among the 336 patients, there were 261 male patients (77.7%) and 75 female patients (22.3%), with a mean age of 50.0±10.6 years, and 40 patients died, with a mean hospital stay of 16.8±11.3 days (range 8.2-23.0 days). Compared with the survival group, the death group had a significantly higher proportion of patients with an age of ≥60 years, a history of invasive operation within the past two weeks, gastrointestinal bleeding, hepatic encephalopathy (HE) or hepatorenal syndrome (HRS), a significantly higher Modified Early Warning Score (MEWS) score, and significantly higher levels of prothrombin time (PT), activated partial thromboplastin time, international normalized ratio, D-dimer, CD4/CD8 ratio, lactate, white blood cell count, norepinephrine, total bilirubin, interleukin-6, procalcitonin, high-sensitivity C-reactive protein (hsCRP), blood urea nitrogen, and creatinine (all P < 0.05), as well as significantly lower levels of red blood cell count, hemoglobin, albumin, total cholesterol, low-density lipoprotein, and high-density lipoprotein (all P < 0.05). The multivariate Cox regression analysis showed that age (HR=2.602, 95%CI: 1.277-5.303, P=0.008), HE (HR=2.516, 95%CI: 1.258-5.033, P=0.009), HRS (HR=2.324, 95%CI: 1.010-5.349, P=0.047), hsCRP (HR=1.008, 95%CI: 1.003-1.013, P=0.004), MEWS score (HR=1.205, 95%CI: 1.022-1.422, P=0.027), and PT (HR=1.076, 95%CI: 1.030-1.124, P=0.027) were independent influencing factors for death in patients with liver cirrhosis and sepsis. The model showed a C-index of 0.857 (95%CI: 0.815-0.920), suggesting that the model had relatively high prediction accuracy, and the calibration curve showed good consistency between the predicted risk and the actual risk. Conclusion The Cox proportional-hazards prediction model established for death during short-term hospitalization in patients with liver cirrhosis and sepsis can be used to predict the risk of death during short-term hospitalization in patients with liver cirrhosis and sepsis, thereby guiding clinical medical staff to take targeted intervention measures to avoid or reduce the possibility of death in patients. -
Key words:
- Liver Cirrhosis /
- Sepsis /
- Risk Factors /
- Proportional Hazards Models
-
一直以来,脓毒症是重症医学领域研究的热点和难点,也是临床医生工作中面临的巨大挑战[1]。与健康人相比,肝硬化患者更容易发生脓毒症,预后更差[2]。此外,由于肝硬化患者的免疫功能低下,即使合并严重的感染,其临床症状如发热、腹痛等并不一定出现[3];且临床现在使用的感染标志物在肝硬化合并脓毒症患者中精确度和敏感度并不高[4]。一直以来,肝硬化合并脓毒症患者的及时诊治都是临床治疗中的重要问题[5]。因此,准确预测肝硬化合并脓毒症患者短期住院的预后,对疾病的预防和控制以及确定治疗方案具有重要的指导作用。本研究回顾性分析肝硬化合并脓毒症患者的临床资料,应用Cox比例风险预测模型分析结局的可能影响因素,为临床医师对肝硬化合并脓毒症患者诊治提供参考。
1. 资料与方法
1.1 研究对象
回顾性收集2012年1月—2022年8月昆明市第三人民医院收治的336例肝硬化合并脓毒症患者的临床资料。纳入标准:(1)年龄>18周岁;(2)符合《丙型肝炎防治指南(2019年版)》[6],《慢性乙型肝炎防治指南(2010年版)》[7],《酒精性肝病防治指南(2018年更新版)》[8],《原发性胆汁性胆管炎的诊断和治疗指南(2021)》[9],《自身免疫性肝硬化诊断和治疗共识(2015)》[10]等。本研究中乙型/丙型肝炎肝硬化指既有HBV感染史又有HCV感染史,两种因素所致的肝硬化;(3)符合脓毒症诊断[11-12]。排除标准:(1)恶性肿瘤、白血病、淋巴瘤、免疫缺陷综合征;(2)入院不足24 h;(3)近6个月使用激素治疗。
1.2 观察指标
收集患者入院24 h内的一般资料,包括性别、年龄;合并症包括糖尿病、高血压、腹水、消化道出血、肝性脑病(HE)、肝肾综合征(HRS);临床资料包括输注人血白蛋白、质子泵抑制剂、近2周有创操作史、改良早期预警评分(MEWS)、住院时间;实验室资料包括凝血酶原时间(PT)、凝血酶时间(TT)、部分凝血酶时间(APTT)、国际标准化比值(INR)、D-二聚体(D-D)、CD4/CD8、血小板计数(PLT)、乳酸(Lac)、白细胞计数(WBC)、中性粒细胞计数(NE)、淋巴细胞计数(LYM)、红细胞计数(RBC)、血红蛋白(Hb)、总胆红素(TBil)、丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、总蛋白(TP)、前白蛋白(PAB)、降钙素原(PCT)、超敏C反应蛋白(hsCRP)、补体C1(C1q)、尿素氮(BUN)、血肌酐(Cr)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)和高密度脂蛋白(HDL)。入院后对患者的随访时间截至出院,了解患者住院期间生存情况,随访终点为出院(生存组)或住院期间死亡(死亡组)。本研究为短期住院患者,不存在删失数据。
1.3 统计学方法
使用SPSS 26.0和R 4.0.4软件进行数据整理和统计分析。计量资料呈正态分布以x±s表示,两组间比较采用成组t检验;计量资料呈偏态分布以M(P25~P75)表示,两组间比较采用Mann-Whitney U检验;计数资料两组间比较采用χ2检验。采用Cox多因素分析筛选变量,据此构建Cox比例风险预测模型并计算风险比(HR)及95%CI。计算C指数来检验其预测精度。绘制列线图可视化展示Cox比例风险预测模型,绘制校准曲线以观察模型预测结果与实际情况的符合程度。P<0.05为差异有统计学意义。
2. 结果
2.1 肝硬化情况
经医院电子病历系统提取,2012年1月—2022年8月住院的肝硬化患者24 313例,其中乙型肝炎肝硬化11 929例(49.19%),丙型肝炎肝硬化7 674例(31.56%),酒精性肝硬化2 675例(11.00%),原发性胆汁性肝硬化1 353例(5.56%),自身免疫性肝硬化321例(1.32%),药物性肝硬化84例(0.35%),血吸虫性肝硬化26例(0.11%),心源性肝硬化17例(0.07%),非酒精性脂肪性肝硬化15例(0.06%),其他原因所致肝硬化219例(0.89%)。
2.2 基线特征和单因素分析结果
本研究共纳入336例患者,其中男261例,女75例,平均年龄(50.0±10.6)岁。丙型肝炎肝硬化212例(未行抗病毒治疗197例,抗病毒不规范15例),平均病毒载量(5.22±1.65)×104 IU/mL;乙型肝炎肝硬化81例(未行抗病毒治疗70例,抗病毒不规范11例),平均病毒载量(3.11±1.04)×104 IU/mL;酒精性肝硬化24例;原发性胆汁性肝硬化9例;乙型丙型肝炎肝硬化7例(未行抗病毒治疗4例,抗病毒规范治疗2例,抗病毒不规范1例);自身免疫性肝硬化3例。近2周有创操作史158例,单一有创操作112例(腹腔穿刺引流术62例、导尿17例、胃镜下治疗13例、中心静脉置管术11例、脾部分栓塞术3例、腹水浓缩回输4例、灌肠致痔疮出血1例、气管插管1例),两种及以上46例。
生存组296例,死亡组40例。与生存组比较,死亡组的年龄(≥60岁)、近2周有创操作史、消化道出血、HE、HRS、改良MEWS评分、PT、APTT、INR、D-D、CD4/CD8、Lac、WBC、NE、TBil、IL-6、PCT、hsCRP、BUN、Cr水平均较高,差异具有统计学意义(P值均<0.05);RBC、Hb、TP、Alb、TC、LDL、HDL水平均较低,差异具有统计学意义(P值均<0.05)(表 1)。
表 1 两组基线特征的单因素分析Table 1. Univariate analysis of baseline characteristics of general data项目 生存组(n=296) 死亡组(n=40) 统计值 P值 性别[例(%)] χ2=0.19 0.665 男 231(78.0) 30(75.0) 女 65(22.0) 10(25.0) 年龄[例(%)] χ2=10.03 0.002 ≥60岁 49(16.6) 15(37.5) <60岁 247(83.4) 25(62.5) 糖尿病[例(%)] 38(12.8) 9(22.5) χ2=2.73 0.098 高血压[例(%)] 48(16.2) 5(12.5) χ2=0.37 0.545 输注人血白蛋白[例(%)] 143(48.3) 19(47.5) χ2=0.01 0.923 质子泵抑制剂[例(%)] 133(44.9) 15(37.5) χ2=0.79 0.374 近2周有创操作史[例(%)] 132(44.6) 26(65.0) χ2=5.10 0.024 腹水[例(%)] 131(44.3) 19(47.5) χ2=0.15 0.699 消化道出血[例(%)] 64(21.6) 18 (45.0) χ2=9.21 0.002 HE[例(%)] 40(13.5) 18(45.0) χ2=24.46 <0.001 HRS[例(%)] 14(4.7) 9(22.5) χ2=17.45 <0.001 改良MEWS评分 1.0(0.0 ~ 2.0) 3.0(0.0~5.0) Z=-3.36 0.001 PT(s) 17.0(14.6~20.5) 24.3(17.9~30.6) Z=-4.91 <0.001 TT(s) 19.6(17.7~21.1) 20.8(18.4~22.9) Z=-1.79 0.073 APTT(s) 41.2(35.9~46.2) 47.6(39.7~56.3) Z=-3.78 <0.001 INR 1.5(1.2~1.7) 2.1(1.5~2.5) Z=-4.60 <0.001 D-D(ug/mL) 9.7(5.3~9.7) 17.5(7.7~18.3) Z=-4.31 <0.001 CD4/CD8 1.9(1.6~1.9) 2.3(2.3~2.3) Z=-4.87 <0.001 PLT(×109/L) 83.0(55.0~132.5) 83.0(59.0~140.3) Z=-0.47 0.637 Lac (mmol/L) 3.3(2.3~3.3) 9.0(3.8~9.0) Z=-6.56 <0.001 WBC(×109/L) 5.3(3.7~7.6) 7.5(4.7~13.5) Z=-2.91 0.004 NE(×109/L) 3.4(2.2~5.9) 6.3(3.2~11.8) Z=-3.77 <0.001 LYM(×109/L) 1.0(0.5~1.5) 0.9(0.5~1.3) Z=-1.09 0.276 RBC(×109/L) 3.5(2.8~4.5) 3.2(2.5~3.9) Z=-2.36 0.018 Hb(g/L) 119.5(87.3~145.0) 107.5(73.3~127.8) Z=-2.50 0.013 TBil(μmol /L) 33.4(17.4~79.5) 74.8(34.0~206.0) Z=-3.04 0.002 ALT(U/L) 38.0(22.0~69.0) 43.0(24.8~76.0) Z=-0.58 0.559 AST(U/L) 53.0(34.0~99.7) 77.0(40.3~121.3) Z=-1.72 0.085 TP(g/L) 62.9(54.8~70.6) 56.2(48.1~65.5) Z=-3.29 0.001 Alb(g/L) 29.1(23.8~36.0) 23.8(20.2~29.4) Z=-3.87 <0.001 PAB(mg/L) 104.8(58.7~136.5) 90.2(60.9~112.4) Z=-1.59 0.111 IL-6(pg/mL) 52.7(17.6~952.8) 1 951.5(197.8~5 414.3) Z=-5.86 <0.001 PCT(ng/mL) 1.1(0.1~4.8) 2.8(0.4~14.0) Z=-3.07 0.002 hsCRP(mg/L) 14.6(2.5~29.8) 60.7(15.4~106.3) Z=-4.91 <0.001 C1q(mg/L) 176.1(138.9~194.8) 170.7(127.0~200.0) Z=-0.92 0.359 BUN(mmol/L) 5.8(4.1~9.1) 15.1(6.3~24.6) Z=-5.07 <0.001 Cr(mmol/L) 73.0(57.0~103.8) 130.5(73.5~235.0) Z=-4.36 <0.001 TG(mmol/L) 1.1(0.7~3.1) 2.2(0.7~2.4) Z=-0.87 0.385 TC(mmol/L) 2.9(2.0~3.3) 2.3(1.4~2.9) Z=-2.73 0.006 LDL(mmol/L) 1.6(1.0~1.9) 1.3(0.7~1.6) Z=-2.06 0.039 HDL(mmol/L) 0.7(0.4~1.0) 0.4(0.2~0.4) Z=-4.62 <0.001 2.3 多重共线性检验
由于WBC和NE性质相同,只取NE;RBC和Hb性质相同,只取Hb;TP和Alb性质相同,只取Alb。由于涉及到出凝血功能的多项指标,改良MEWS评分亦包括血压、体温、呼吸、心率等,且变量较多,为排除多重共线性,对单因素分析有意义的指标进行了多重共线性检验,结果显示,各个变量(年龄、近2周有创操作史、消化道出血、HE、HRS、改良MEWS评分、PT、APTT、INR、D-D、CD4/CD8、Lac、NE、Hb、TBil、Alb、IL-6、PCT、hsCRP、BUN、Cr、TC、LDL、HDL)的方差膨胀系数值均小于10。表明各变量之间没有明显共线关系,可以进行下一步的分析。
2.4 Cox比例风险预测模型
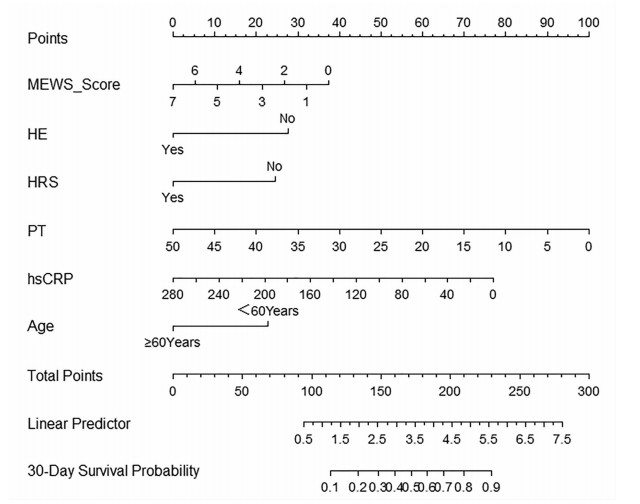
将上述经过多重共线性检验且有统计学意义的指标(P<0.05)作为协变量,住院时间为时间变量,生存结局(生存=0,死亡=1)作为状态变量,进行多因素Cox回归分析,构建Cox比例风险回归预测模型。最终筛选出6个独立的影响因素,分别为年龄、HE、HRS、hsCRP、改良MEWS评分和PT(P值均<0.05)(表 2)。
表 2 各变量的多因素Cox比例风险回归分析Table 2. Multivariate Cox proportional risk regression analysis of each variable变量 β值 SE Wald HR 95%CI P值 年龄(≥60岁) 0.956 0.363 6.931 2.602 1.277~5.303 0.008 HE 0.923 0.354 6.808 2.516 1.258~5.033 0.009 HRS 0.843 0.425 3.030 2.324 1.010~5.349 0.047 hsCRP 0.008 0.003 8.466 1.008 1.003~1.013 0.004 改良MEWS评分 0.187 0.084 4.905 1.205 1.022~1.422 0.027 PT 0.073 0.022 10.662 1.076 1.030~1.124 0.001 利用R软件对各协变量和模型整体进行比例风险假设检验。结果显示,年龄(≥60岁)(χ2=1.980,P=0.159)、PT(χ2=0.152,P=0.697)、HE(χ2=3.817,P=0.051)、HRS(χ2=0.321,P=0.571)、hsCRP(χ2=0.097,P=0.755)和改良MEWS评分(χ2=3.555,P=0.059) 6个协变量均不具有统计学意义;模型整体检验:也不具有统计学意义(χ2=8.507,P=0.203),可以认为满足比例风险假设检验。
2.5 列线图绘制、模型的验证及评价
根据数据拟合的Cox比例风险模型,将其在各个时间预测的生存比例绘制列线图进行可视化展示(图 1)。根据对列线图贡献大小依次为PT、hsCRP、改良MEWS评分、HE、HRS、年龄。
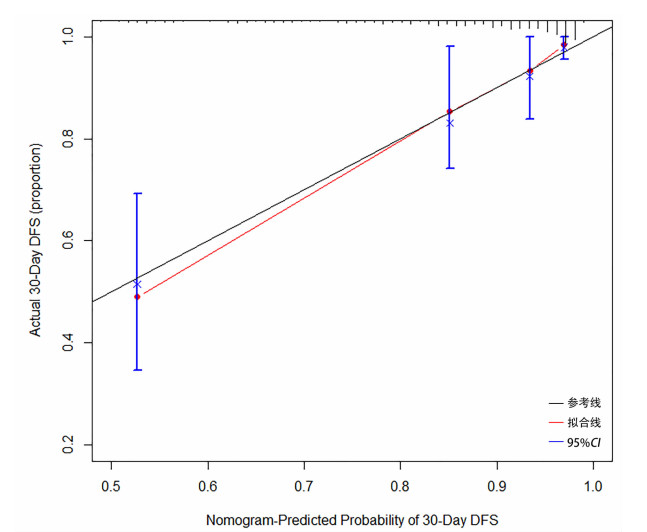
模型的C-index为0.857(95%CI:0.815~0.920),表明模型的预测准确性较高。采用bootstrap重复抽样的方法,绘制校准图,横坐标为根据预测的每个患者的生存概率,纵坐标为每个患者实际的生存概率,当实线与虚线恰好完全重合时最为理想。由校准图(图 2)可知,预测短期住院时间30天模型的校准曲线与标准曲线均有较高的吻合程度,提示模型预测风险与实际发生风险的一致性较好,即构建Cox比例风险预测模型校准度较好。
2.6 培养病原菌
336例肝硬化合并脓毒症患者培养出病原菌78株,其中2种以上(复合)病原菌13株,单一病原菌65株(19.3%):大肠埃希菌18株(血培养8株、腹水培养8株、尿培养2株)、肺炎克雷伯菌16株(血培养8株、痰培养8株)、粪肠球菌5株(腹水培养2株、尿培养2株、血培养1株)、白色念珠菌5株(痰培养4株、血培养1株)、屎肠球菌4株(腹水培养3株、血培养1株)、表皮葡萄球菌3株(腹水培养2株、胸水培养1株)、成团泛菌2株(腹水培养2株)、金黄色葡萄球菌2株(痰培养1株、血培养1株)、人葡萄球菌2株(腹水培养1株、血培养1株)、溶血葡萄球菌2株(血培养2株)、光滑念珠菌1株(痰培养1株)、铜绿假单胞菌1株(痰培养1株)、白假丝酵母菌1株(痰培养1株)、咽峡链球菌1株(痰培养1株)、产气肠杆菌1株(痰培养1株)、沃氏葡萄球菌1株(血培养1株)。革兰阳性菌以粪肠球菌多见;革兰阴性菌以大肠埃希菌、肺炎克雷伯菌多见;真菌培养出白色念珠菌。
3. 讨论
脓毒症是由感染引起的全身炎症反应综合征,可导致多器官功能衰竭,病死率较高[13]。研究[14]表明,即使进行强化治疗,脓毒症中危重患者的预后仍然较差。本研究结果显示,年龄(≥60岁)、PT、HE、HRS、hsCRP和改良MEWS评分是肝硬化合并脓毒症患者短期住院死亡的危险因素。
本院住院的肝硬化患者中,以乙型肝炎肝硬化多见,其次为丙型肝炎肝硬化和酒精性肝硬化。而336例肝硬化合并脓毒症患者中却以丙型肝炎肝硬化最多见,其次为乙型肝炎肝硬化。分析可能原因:尽管乙型肝炎患者多于丙型肝炎患者,但由于口服核苷类药物在2000年前即在本院开始使用,之后广泛应用于乙型肝炎肝硬化患者,大多数患者病情控制较稳定,长期服用核苷类者较少出现脓毒症等并发症;而治疗丙型肝炎的口服药物2019年左右才开始在本院使用,之前均采用干扰素加利巴韦林的方案治疗丙型肝炎,但对于肝硬化患者属于禁忌,故大多数丙型肝炎肝硬化患者不能得到有效控制。另外,云南地区毗邻东南亚,吸毒人群较多,通过此途径感染丙型肝炎患者又较其他地区相对多一些,这类人群大多也因各种原因没有得到及时的治疗,从而发展到肝硬化,甚至出现各种并发症。
研究[15]表明,高龄与脓毒症患者预后相关。本研究中年龄(≥60岁)是肝硬化合并脓毒症患者短期住院死亡的独立危险因素。PT对于脓毒症患者病情严重程度判断及预后评估均具有潜在的预测价值。有学者[16]指出,“炎-凝交互”在脓毒症凝血紊乱中扮演重要角色,炎症介质大量释放迅速启动促凝状态,进而激活内外源性凝血途径,大量消耗多种凝血因子,PT明显延长。本研究中,死亡组患者的PT高,分析可能原因是PT延长与炎症失控、凝血紊乱及器官功能障碍密切相关[17]。D-D水平能够反映正常人纤溶酶和抑制酶之间的动态平衡[18],且作为机体早期发生弥散性血管内凝血的灵敏指标。研究提出[19],脓毒症患者存在血液高凝和继发性纤溶现象、炎症介质启动凝血系统,造成微血栓形成,D-D升高。但在本研究中,仅单因素分析显示D-D差异有显著性,可能与样本量较小有关。但是,依然要警惕这部分重症患者凝血失衡,继发纤溶亢进的情况。研究[20]表明,Lac为葡萄糖无氧代谢的最终产物,在脓毒症时,机体全身或局部组织器官灌注不良,机体供氧量严重不足,不能满足机体组织代谢需要,无氧代谢导致Lac升高。同时,肝功能损伤时肝脏对Lac代谢能力严重下降,进一步导致Lac代谢物堆积。本研究中,死亡组患者的Lac水平高,可能与肝硬化合并脓毒症患者的组织缺氧及肝功能衰竭导致的Lac代谢障碍有关。HE是肝硬化患者一种可逆性神经精神并发症,发生在高达50%的肝硬化患者中[21]。研究[22]表明氨中毒是HE最主要的发病机制。肝硬化患者抵抗力低下,门静脉高压导致食管、胃底静脉曲张,腹水导致肾循环血量减少,氨排泄减少,都会引起血氨升高[23]。本研究中,HE是肝硬化合并脓毒症短期住院死亡的独立危险因素,死亡风险增加了1.516倍。分析可能原因是肝硬化合并脓毒症患者全身炎症引发内源性毒素释放导致脑功能紊乱,应激反应减弱,进而死亡风险增加。研究[24]表明,合并HRS在肝硬化患者中具有较高的短期病死率。灌注不足和细胞代谢异常是脓毒症器官功能障碍的机制之一[25]。此外,脓毒症的消退障碍和持续炎症可导致器官损伤并引发HRS[26]。本研究死亡组患者合并HRS多,可能与器官末端灌注受损、血脑屏障破坏、线粒体功能障碍、氧化应激减弱、毒性神经肽积累以及继发于脓毒症诱导的肝肾功能障碍、毒素清除障碍相关[27]。研究[28]表明,PCT是一种在感染性疾病诊断和预后判断中具有更高准确性的生物标志物。但在本研究中,PCT的意义不显著。笔者认为造成此差异的主要原因是本研究入选患者均为重症患者,合并多种基础疾病,且年龄大,在某种程度上,机体的免疫功能反应相对不灵敏。hsCRP作为细菌感染或组织损伤后人体内最敏感的急性期蛋白之一[29],在参与机体的抗炎反应、减轻组织损伤方面有着重要意义。在本研究中,hsCRP为肝硬化合并脓毒症患者短期住院发生死亡的危险因素,应引起高度重视。改良MEWS是比较常见的院前急救的伤情评估工具,可短时间内快速获取评估、辨别症状,是一种病情评估及预警工具[30],与患者病情及预后联系较为密切。目前已有研究[31]表明,将改良MEWS评分作为非计划性转入ICU患者住院情况的评估指标之一。改良MEWS评分应用在普通病房预测潜在危重患者也成为一种趋势[32]。本研究死亡组患者的改良MEWS评分高,表明死亡组患者入院时的基础情况更差,死亡风险高。
国内外文献以脓毒症的危险因素报道多见,传统的预测模型多通过单因素和多因素分析筛选预测变量。本研究则对肝硬化合并脓毒症患者短期住院死亡的风险进行分析,构建Cox比例风险预测模型。采用改良MWES评分结合临床相关数据包括年龄(>60岁)、PT、HE、HRS、hsCRP来预测患者死亡风险,将其在各个时间预测的生存比例绘制列线图进行可视化展示。该模型快速、简单、直观地得到患者的预后情况,可帮助临床医生预测肝硬化合并脓毒症患者的生存状态,并为临床医生提供治疗参考。
本研究属于回顾性单中心设计,样本未必能反应其他医疗机构的情况。另外,本研究样本量相对较小,需要更多的大样本、多中心进行验证及进一步研究。但本研究仍具有重要的阳性结果,对临床中肝硬化合并脓毒症患者短期住院发生的死亡风险提供了新思路,也为临床诊治提供了有价值的参考。
-
表 1 两组基线特征的单因素分析
Table 1. Univariate analysis of baseline characteristics of general data
项目 生存组(n=296) 死亡组(n=40) 统计值 P值 性别[例(%)] χ2=0.19 0.665 男 231(78.0) 30(75.0) 女 65(22.0) 10(25.0) 年龄[例(%)] χ2=10.03 0.002 ≥60岁 49(16.6) 15(37.5) <60岁 247(83.4) 25(62.5) 糖尿病[例(%)] 38(12.8) 9(22.5) χ2=2.73 0.098 高血压[例(%)] 48(16.2) 5(12.5) χ2=0.37 0.545 输注人血白蛋白[例(%)] 143(48.3) 19(47.5) χ2=0.01 0.923 质子泵抑制剂[例(%)] 133(44.9) 15(37.5) χ2=0.79 0.374 近2周有创操作史[例(%)] 132(44.6) 26(65.0) χ2=5.10 0.024 腹水[例(%)] 131(44.3) 19(47.5) χ2=0.15 0.699 消化道出血[例(%)] 64(21.6) 18 (45.0) χ2=9.21 0.002 HE[例(%)] 40(13.5) 18(45.0) χ2=24.46 <0.001 HRS[例(%)] 14(4.7) 9(22.5) χ2=17.45 <0.001 改良MEWS评分 1.0(0.0 ~ 2.0) 3.0(0.0~5.0) Z=-3.36 0.001 PT(s) 17.0(14.6~20.5) 24.3(17.9~30.6) Z=-4.91 <0.001 TT(s) 19.6(17.7~21.1) 20.8(18.4~22.9) Z=-1.79 0.073 APTT(s) 41.2(35.9~46.2) 47.6(39.7~56.3) Z=-3.78 <0.001 INR 1.5(1.2~1.7) 2.1(1.5~2.5) Z=-4.60 <0.001 D-D(ug/mL) 9.7(5.3~9.7) 17.5(7.7~18.3) Z=-4.31 <0.001 CD4/CD8 1.9(1.6~1.9) 2.3(2.3~2.3) Z=-4.87 <0.001 PLT(×109/L) 83.0(55.0~132.5) 83.0(59.0~140.3) Z=-0.47 0.637 Lac (mmol/L) 3.3(2.3~3.3) 9.0(3.8~9.0) Z=-6.56 <0.001 WBC(×109/L) 5.3(3.7~7.6) 7.5(4.7~13.5) Z=-2.91 0.004 NE(×109/L) 3.4(2.2~5.9) 6.3(3.2~11.8) Z=-3.77 <0.001 LYM(×109/L) 1.0(0.5~1.5) 0.9(0.5~1.3) Z=-1.09 0.276 RBC(×109/L) 3.5(2.8~4.5) 3.2(2.5~3.9) Z=-2.36 0.018 Hb(g/L) 119.5(87.3~145.0) 107.5(73.3~127.8) Z=-2.50 0.013 TBil(μmol /L) 33.4(17.4~79.5) 74.8(34.0~206.0) Z=-3.04 0.002 ALT(U/L) 38.0(22.0~69.0) 43.0(24.8~76.0) Z=-0.58 0.559 AST(U/L) 53.0(34.0~99.7) 77.0(40.3~121.3) Z=-1.72 0.085 TP(g/L) 62.9(54.8~70.6) 56.2(48.1~65.5) Z=-3.29 0.001 Alb(g/L) 29.1(23.8~36.0) 23.8(20.2~29.4) Z=-3.87 <0.001 PAB(mg/L) 104.8(58.7~136.5) 90.2(60.9~112.4) Z=-1.59 0.111 IL-6(pg/mL) 52.7(17.6~952.8) 1 951.5(197.8~5 414.3) Z=-5.86 <0.001 PCT(ng/mL) 1.1(0.1~4.8) 2.8(0.4~14.0) Z=-3.07 0.002 hsCRP(mg/L) 14.6(2.5~29.8) 60.7(15.4~106.3) Z=-4.91 <0.001 C1q(mg/L) 176.1(138.9~194.8) 170.7(127.0~200.0) Z=-0.92 0.359 BUN(mmol/L) 5.8(4.1~9.1) 15.1(6.3~24.6) Z=-5.07 <0.001 Cr(mmol/L) 73.0(57.0~103.8) 130.5(73.5~235.0) Z=-4.36 <0.001 TG(mmol/L) 1.1(0.7~3.1) 2.2(0.7~2.4) Z=-0.87 0.385 TC(mmol/L) 2.9(2.0~3.3) 2.3(1.4~2.9) Z=-2.73 0.006 LDL(mmol/L) 1.6(1.0~1.9) 1.3(0.7~1.6) Z=-2.06 0.039 HDL(mmol/L) 0.7(0.4~1.0) 0.4(0.2~0.4) Z=-4.62 <0.001 表 2 各变量的多因素Cox比例风险回归分析
Table 2. Multivariate Cox proportional risk regression analysis of each variable
变量 β值 SE Wald HR 95%CI P值 年龄(≥60岁) 0.956 0.363 6.931 2.602 1.277~5.303 0.008 HE 0.923 0.354 6.808 2.516 1.258~5.033 0.009 HRS 0.843 0.425 3.030 2.324 1.010~5.349 0.047 hsCRP 0.008 0.003 8.466 1.008 1.003~1.013 0.004 改良MEWS评分 0.187 0.084 4.905 1.205 1.022~1.422 0.027 PT 0.073 0.022 10.662 1.076 1.030~1.124 0.001 -
[1] DELLINGER RP, LEVY MM, SCHORR CA, et al. 50 years of sepsis investigation/enlightenment among adults-the long and winding road[J]. Crit Care Med, 2021, 49(10): 1606-1625. DOI: 10.1097/CCM.0000000000005203. [2] HUANG HK, CHEN HY, HSU YC. Comparing the prognosis of patient with alcohol and nonalcohol-associated cirrhosis with bacteremia[J]. Alcohol Alcohol, 2020, 55(5): 512-517. DOI: 10.1093/alcalc/agaa057. [3] CHEN HY, HSU YC. Afebrile bacteremia in adult emergency department patients with liver cirrhosis: clinical characteristics and outcomes[J]. Sci Rep, 2020, 10(1): 7617. DOI: 10.1038/s41598-020-64644-7. [4] CHATTERJEE S, KAWAHARA R, TJONDRO HC, et al. Serum N-glycomics stratifies bacteremic patients infected with different pathogens[J]. J Clin Med, 2021, 10(3): 516. DOI: 10.3390/jcm10030516. [5] JOHNSON AL, RATNASEKERA IU, IRVINE KM, et al. Bacteraemia, sepsis and antibiotic resistance in Australian patients with cirrhosis: a population-based study[J]. BMJ Open Gastroenterol, 2021, 8(1): e000695. DOI: 10.1136/bmjgast-2021-000695. [6] Chinese Society of Hepatology, Chinese Medical Association, Chinese Society of Infectious Diseases, Chinese Medical Association. Guidelines for the prevention and treatment of hepatitis C(2019 version)[J]. J Clin Hepatol, 2019, 35(12): 2670-2686. DOI: 10.3969/j.issn.1001-5256.2019.12.008.中华医学会肝病学分会, 中华医学会感染病学分会. 丙型肝炎防治指南(2019年版)[J]. 临床肝胆病杂志, 2019, 35(12): 2670-2686. DOI: 10.3969/j.issn.1001-5256.2019.12.008. [7] Chinese Society of Hepatology, Chinese Medical Association, Chinese Society of Infectious Diseases, Chinese Medical Association. The guideline of prevention and treatment for chronic hepatitis B(2010 version)[J]. J Clin Hepatol, 2011, 27(1): 113-128. http://lcgdbzz.org/article/id/LCGD201101035中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2010年版)[J]. 临床肝胆病杂志, 2011, 27(1): 113-128. http://lcgdbzz.org/article/id/LCGD201101035 [8] Fatty Liver Expert Committee, Chinese Medical Doctor Association, National Workshop on Fatty Liver and Alcoholic Liver Disease, Chinese Society of Hepatology, Chinese Medical Association. Guidelines of prevention and treatment for alcoholic liver disease: a 2018 update[J]. J Clin Hepatol, 2018, 34(5): 939-946. DOI: 10.3969/j.issn.1001-5256.2018.05.006.中国医师协会脂肪性肝病专家委员会, 中华医学会肝病学分会脂肪肝和酒精性肝病学组. 酒精性肝病防治指南(2018年更新版)[J]. 临床肝胆病杂志, 2018, 34(5): 939-946. DOI: 10.3969/j.issn.1001-5256.2018.05.006. [9] National Workshop on Fatty Liver and AlcoholicLiver Disease, Chinese Society of Hepatology, Chinese Medical Association. Guidelines on the diagnosis and management ofprimary biliary cholangitis (2021)[J]. J Clin Hepatol, 2022, 38(1): 35-41. DOI: 10.3969/j.issn.1001-5256.2022.01.007中华医学会肝病学分会. 原发性胆汁性胆管炎的诊断和治疗指南(2021)[J]﹒临床肝胆病杂志, 2022, 38(1): 35-41. DOI: 10.3969/j.issn.1001-5256.2022.01.007 [10] Chinese Society of Hepatology, Chinese Medical Association; Chinese Society of Gastroenterology, Chinese Medical Association; Chinese Society of Infectious Diseases, Chinese Medical Association. Consensus on the diagnosis and management of autoimmune hepatitis(2015)[J]. J Clin Hepatol, 2016, 32(1): 9-22. DOI: 10.3969/j.issn.1001-5256.2016.01.002.中华医学会肝病学分会, 中华医学会消化病学分会, 中华医学会感染病学分会. 自身免疫性肝炎诊断和治疗共识(2015)[J]. 临床肝胆病杂志, 2016, 32(1): 9-22. DOI: 10.3969/j.issn.1001-5256.2016.01.002. [11] SINGER M, DEUTSCHMAN CS, SEYMOUR CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI: 10.1001/jama.2016.0287. [12] ZHENG RQ, ZHANG YF, RONG ZQ, et al. Surviving Sepsis Campaign: international guidelines for management of sepsis and septic shock 2021, interpretation and expectation[J]. Chin Critical Care Med, 2021, 33(10): 1159- 1164. DOI: 10.3760/cma.j.cn121430-20211009-01442.郑瑞强, 张艺芬, 荣子琪, 等. 《拯救脓毒症运动: 脓毒症与感染性休克治疗国际指南2021版》解读与展望[J]. 中华危重病急救医学, 2021, 33(10): 1159-1164. DOI: 10.3760/cma.j.cn121430-20211009-01442. [13] FLEISCHMANN-STRUZEK C, MIKOLAJETZ A, SCHWARZKOPF D, et al. Challenges in assessing the burden of sepsis and understanding the inequalities of sepsis outcomes between National Health Systems: secular trends in sepsis and infection incidence and mortality in Germany[J]. Intensive Care Med, 2018, 44(11): 1826-1835. DOI: 10.1007/s00134-018-5377-4. [14] HASSAN EA, ABDEL REHIM AS, AHMED AO, et al. Clinical value of presepsin in comparison to hsCRP as a monitoring and early prognostic marker for sepsis in critically ill patients[J]. Medicina (Kaunas), 2019, 55(2): 36. DOI: 10.3390/medicina55020036. [15] MILBRANDT EB, ELDADAH B, NAYFIELD S, et al. Toward an integrated research agenda for critical illness in aging[J]. Am J Respir Crit Care Med, 2010, 182(8): 995-1003. DOI: 10.1164/rccm.200904-0630CP. [16] SCHMITT F, MANOLOV V, MORGENSTERN J, et al. Acute fibrinolysis shutdown occurs early in septic shock and is associated with increased morbidity and mortality: results of an observational pilot study[J]. Ann Intensive Care, 2019, 9(1): 19. DOI: 10.1186/s13613-019-0499-6. [17] VAN VUGHT LA, UHEL F, DING C, et al. Consumptive coagulopathy is associated with a disturbed host response in patients with sepsis[J]. J Thromb Haemost, 2021, 19(4): 1049-1063. DOI: 10.1111/jth.15246. [18] BATES SM. D-dimer assays in diagnosis and management of thrombotic and bleeding disorders[J]. Semin Thromb Hemost, 2012, 38(7): 673-682. DOI: 10.1055/s-0032-1326782. [19] INNOCENTI F, GORI AM, GIUSTI B, et al. Prognostic value of sepsis-induced coagulation abnormalities: an early assessment in the emergency department[J]. Intern Emerg Med, 2019, 14(3): 459-466. DOI: 10.1007/s11739-018-1990-z. [20] BAKKER J. Lost in translation: on lactate, hypotension, sepsis- induced tissue hypoperfusion, quantitative resuscitation and surviving sepsis campaign bundles[J]. Crit Care Med, 2015, 43(3): 705-706. DOI: 10.1097/CCM.0000000000000870. [21] BOHRA A, WORLAND T, HUI S, et al. Prognostic significance of hepatic encephalopathy in patients with cirrhosis treated with current standards of care[J]. World J Gastroenterol, 2020, 26(18): 2221-2231. DOI: 10.3748/wjg.v26.i18.2221. [22] KROUPINA K, BÉMEUR C, ROSE CF. Amino acids, ammonia, and hepatic encephalopathy[J]. Anal Biochem, 2022, 649: 114696. DOI: 10.1016/j.ab.2022.114696. [23] TRANAH TH, BALLESTER MP, CARBONELL-ASINS JA, et al. Plasma ammonia levels predict hospitalisation with liver-related complications and mortality in clinically stable outpatients with cirrhosis[J]. J Hepatol, 2022, 77(6): 1554-1563. DOI: 10.1016/j.jhep.2022.07.014. [24] ARORA V, MAIWALL R, RAJAN V, et al. Terlipressin is superior to noradrenaline in the management of acute kidney injury in acute on chronic liver failure[J]. Hepatology, 2020, 71(2): 600-610. DOI: 10.1002/hep.30208. [25] FEBRES ALDANA C, POPPITI RJ. Cholangitis lenta causing bile cast nephropathy: A unique model of hepatorenal failure in sepsis[J]. Fetal Pediatr Pathol, 2018, 37(6): 424-432. DOI: 10.1080/15513815.2018.1520945. [26] GINÈS P, FERNÁNDEZ J, DURAND F, et al. Management of critically-ill cirrhotic patients[J]. J Hepatol, 2012, 56 (Suppl 1): S13-24. DOI: 10.1093/ckj/sfac025. [27] BARLOW B, PONNALURI S, BARLOW A, et al. Targeting the gut microbiome in the management of sepsis-associated encephalopathy[J]. Front Neurol, 2022, 13: 999035. DOI: 10.3389/fneur.2022.999035. [28] ALI WA, BAZAN NS, ELBERRY AA, et al. A randomized trial to compare procalcitonin and C-reactive protein in assessing severity of sepsis and in guiding antibacterial therapy in Egyptian critically ill patients[J]. Ir J Med Sci, 2021, 190(4): 1487-1495. DOI: 10.1007/s11845-020-02494-y. [29] GREALISH M, CHIEW AL, VARNDELL W, Depczynski B. The relationship between admission glucose and lactate with critical illness amongst adult patients presenting to the emergency department[J]. Acta Diabetol, 2021, 58(10): 1343-1349. DOI: 10.1007/s00592-021-01725-7. [30] GÖK R, GÖK A, BULUT M. Assessing prognosis with modified early warning score, rapid emergency medicine score and worthing physiological scoring system in patients admitted to intensive care unit from emergency department[J]. Int Emerg Nurs, 2019, 43: 9-14. DOI: 10.1016/j.ienj.2018.06.002. [31] TANG R, SHI LP, WEI YY, et al. Correlation analysis of MEWS, length of stay in lCU and death of patients who were unplanned transferred to lCU before transfer[J]. Nursing Prac Res, 2022, 19(2): 179-183. DOI: 10.3969/j.issn.1672-9676.2022.02.005.唐蓉, 石兰萍, 魏莹莹, 等. 非计划性转入ICU患者转入前MEWS与ICU住院时长及死亡情况的相关性分析[J]. 护理实践与研究, 2022, 19(2): 179-183. DOI: 10.3969/j.issn.1672-9676.2022.02.005. [32] KHAN A, SARMA D, GOWDA C, et al. The Role of Modified Early Warning Score (MEWS) in the prognosis of acute pancreatitis[J]. Oman Med J, 2021, 36(3): e272. DOI: 10.5001/omj.2021.72. 期刊类型引用(0)
其他类型引用(1)
-




 PDF下载 ( 2199 KB)
PDF下载 ( 2199 KB)

 下载:
下载:



 下载:
下载: