肝癌肝切除术后感染风险预测模型的建立与评价
DOI: 10.3969/j.issn.1001-5256.2023.01.017
Establishment and validation of a nomogram risk prediction model for infection complications in patients after hepatectomy for liver cancer
-
摘要:
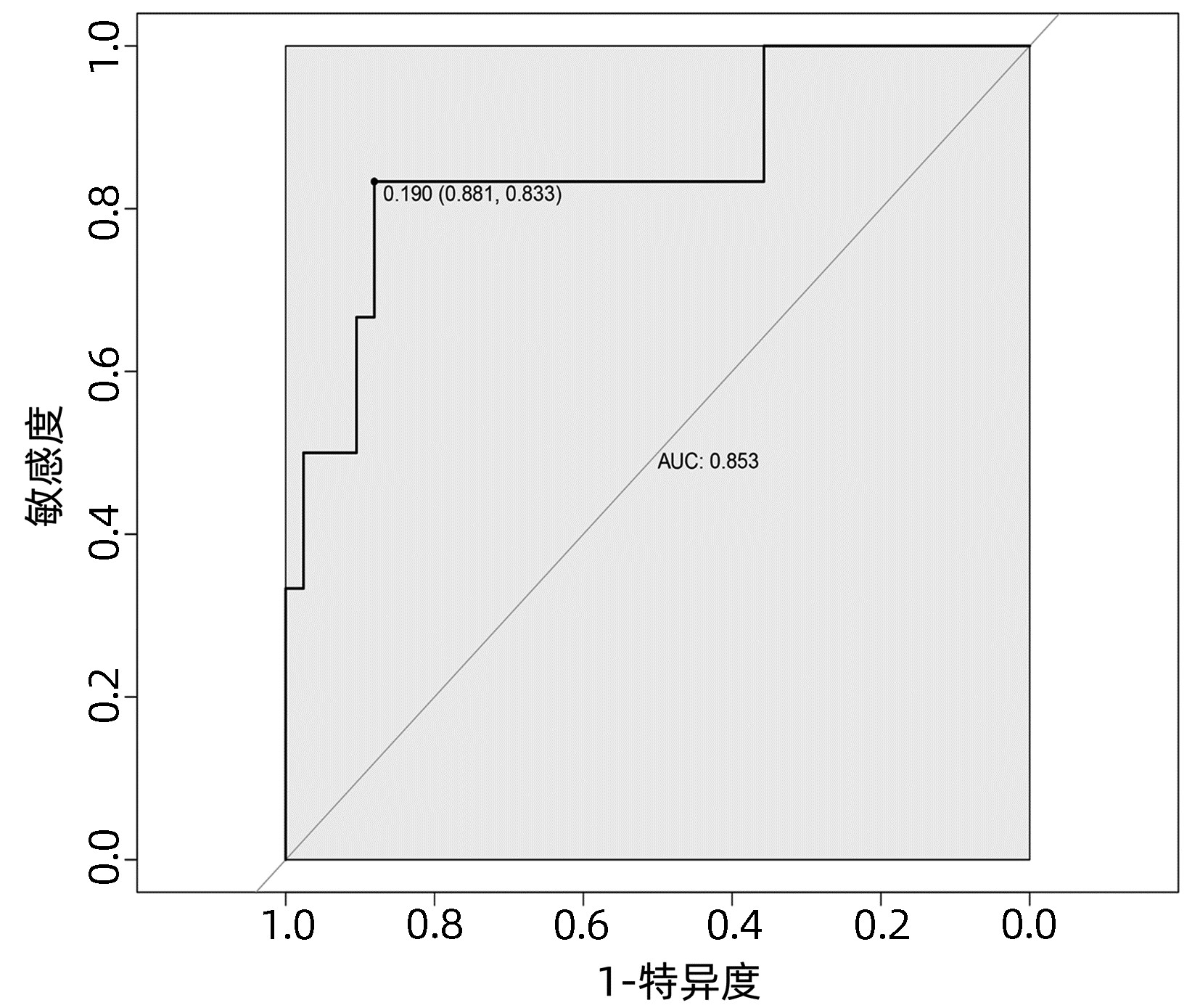
目的 探讨肝癌肝切除术后发生感染的危险因素,建立并验证风险预测模型。 方法 收集2020年1月—2022年4月于武汉大学人民医院行肝切除术的167例原发性肝癌患者的临床资料。根据术后早期是否发生感染,将所有患者分为术后感染组(n=28) 和非感染组(n=139)。计量资料两组间比较采用t检验或Mann- Whitney U检验,计数资料两组间比较采用χ2检验。采用单因素分析与Logistic回归分析筛选肝癌肝切除术后感染的影响因素,并建立术后发生感染的列线图风险预测模型,将所有患者按7∶ 3随机分为训练集(n=119)和验证集(n=48),采用Bootstrap法对模型进行内部验证,应用模型校准曲线和受试者工作特征曲线(ROC曲线)来评价列线图模型的校准度和区分度。 结果 167例患者中28例(16.8%)发生术后感染。Logistc多因素分析结果显示,糖尿病、CONUT评分≥4分、术前NLR、手术时间、术中失血量、引流管放置时间>7 d是肝癌肝切除术后发生感染的独立危险因素(P值均<0.05)。基于上述6个危险因素构建的列线图,训练集和验证集的ROC曲线下面积分别为0.848、0.853。列线图模型校准曲线显示预测值与实际观测值基本一致,表明列线图模型预测的准确度较好。 结论 基于糖尿病、CONUT评分≥4分、术前NLR、手术时间、术中失血量、引流管放置时间>7 d建立的个体化列线图风险预测模型预测效能良好,对高风险患者具有较高的预测价值。 Abstract:Objective To investigate the risk factors of infection after hepatectomy for liver cancer, and to establish and validate a risk prediction model. Methods The clinical data of 167 patients with primary liver cancer who underwent hepatectomy in People's Hospital of Wuhan University from January 2020 to March 2022 were retrospectively collected. All patients were divided into postoperative infection group (n=28) and non-infection group (n=139) according to whether postoperative infection complications occurred. The t-test or Mann-Whitney U test was used for comparison of continuous data between two groups and the chi-square test was used for comparison of categorical data between two groups. Univariate analysis and logistic regression analysis were used to screen the risk factors of infection after hepatectomy for hepatocellular carcinoma, and a nomogram risk prediction model for postoperative infection was established. All patients were randomly divided into training cohort (n=119) and the validation cohort (n=48) according to the ratio of 7∶ 3, the Bootstrap method was used for internal validation of the model, and the model calibration curve and ROC curve were used to evaluate the calibration and discrimination of the nomogram model. Results Postoperative infection occurred in 28 of 167 patients (16.8%). Logistic regression analysis showed that diabetes, CONUT score ≥4 points, preoperative NLR, operation time, intraoperative blood loss, and drainage tube placement time > 7 d were independent risk factors for infection after hepatectomy for liver cancer (all P < 0.05). Based on the nomogram constructed from the above six risk factors, the area under the ROC curve of the training cohort and the validation cohort was 0.848, and 0.853, respectively. The calibration curve of the nomogram model shows that the predicted value is basically consistent with the actual observed value, indicating that the accuracy of the nomogram model prediction is better. Conclusion The individualized nomogram risk prediction model based on diabetes, CONUT score ≥4 points, preoperative NLR, operation time, intraoperative blood loss, and drainage tube placement time > 7 d has good predictive performance and has high predictive value for high-risk patients. -
Key words:
- Carcinoma, Hepatocellular /
- Hepatectomy /
- Infection /
- Risk Factors /
- Nomogram
-
肝癌位居世界常见恶性肿瘤第六位,是导致癌症相关死亡的第三大原因,绝大多数为肝细胞癌[1-2]。肝切除术仍然是治疗原发性肝癌的一线治疗方法[3-4]。随着患者选择、手术技术和围手术期护理的改进,肝切除术后病死率有所下降,但术后并发症的发生率(20%~70%)仍然很高[5-6]。有研究[7-9]报道,术后感染发生率为5%~20%,术后合并感染的患者预后较差。既往有关肝切除术后感染并发症的风险预测模型存在样本量较小、仅关注腹腔内感染与术后总并发症等局限性[10-11]。因此,本研究分析了肝癌肝切除术后发生感染的影响因素并建立了列线图风险预测模型,以期及时发现高风险患者并优化肝癌患者的围手术期管理,从而改善预后。
1. 资料与方法
1.1 研究对象
回顾性收集2020年1月—2022年4月本院肝胆外科行肝癌肝切除术患者的临床资料。纳入标准:(1)病理诊断为肝癌且临床资料完整;(2)年龄>18岁;(3)首次行肝切除术患者;(4)肝功能Child-Pugh分级A或B级且无远处转移。排除标准:(1)肝癌复发患者;(2)行二步肝切除、联合行胆肠吻合术的肝癌患者;(3)资料不完整者。根据术后早期是否发生感染,将所有患者分为术后感染组和非感染组。
1.2 术后感染的诊断标准
术后感染性并发症包括:(1)肺部感染。患者有咳嗽、发热等临床表现,肺部听诊有湿啰音,影像学检查提示肺部炎症或痰培养阳性;(2)腹腔感染。腹腔引流管内有脓性分泌液或超声穿刺证实腹腔内脓肿的存在;(3)切口感染。切口出现红、肿、热、痛等感染症状或者出现脓性分泌物;(4)泌尿系感染。患者出现尿频、尿痛等感染症状或中段尿细菌培养阳性。
1.3 收集指标
(1) 一般资料:性别、年龄、高血压、糖尿病、乙型肝炎、肝硬化、肿瘤数目、肿瘤大小、Edmonson分级等;(2)术前血液学指标:术前甲胎蛋白(AFP)、ALT、AST、TBil、Alb、PT、PLT、SCr、总胆固醇、乳酸脱氢酶、ALP、ALBI评分、中性粒细胞与淋巴细胞比值(NLR)、控制营养状态评分(CONUT);(3)手术相关指标:手术部位、手术方式、肝段切除数量、引流管放置时间、美国麻醉医师学会(ASA)分级、手术时间、术中出血量、术中补液量、无肝期、血浆输注、红细胞输注、术后胆漏等。CONUT评分基于血清Alb、血清总胆固醇、总淋巴细胞计数3项参数计算,具体标准为:(1)血清Alb分为≥35.0 g/L,30.0~34.9 g/L,25.0~29.9 g/L与<25.0 g/L共4个等级,分别为0分、2分、4分和6分。(2)血清总胆固醇分为≥180 mg/dL,140~179 mg/dL,100~139 mg/dL,<100 mg/dL共4个等级,分别计0分、1分、2分和3分。(3)外周血淋巴细胞计数分为4个水平,≥1.60×109/L,(1.20~1.59)×109/L,(0.80~1.19)×109/L及<0.80×109/L,分别为0分、1分、2分和3分。3项参数的得分相加即为总CONUT评分。
1.4 统计学方法
采用SPSS 26.0统计软件进行分析。符合正态分布的计量资料以x±s表示, 两组间比较采用t检验;不符合正态分布的计量资料以M(P25~P75)表示,两组间比较采用Mann-Whitney U检验。计数资料组两间比较采用χ2检验。将有显著性差异的指标纳入Logistic回归多因素分析。根据回归分析结果运用R软件建立个体化列线图预测模型。将167例患者按7∶ 3随机分为训练集和验证集,用Bootstrap法(抽样1000次)对该模型进行内部验证,用C指数、ROC曲线及校准曲线评价模型的预测效能。P<0.05为差异有统计学意义。
2. 结果
2.1 肝癌术后发生早期感染的情况
本研究共纳入167例肝癌肝切除术患者,其中男性139例,女性28例,年龄29~79岁, 平均(59.98±10.72)岁。术后感染组包括肺部感染13例,腹腔感染8例,切口感染4例,泌尿系统感染3例。在167例肝癌肝切除术患者中,共有28例(16.8%)发生术后感染。
2.2 术后感染单因素分析
比较术后感染组和非感染组的临床资料,筛选有关术后感染的影响因素。两组在糖尿病、手术方式、术前NLR、CONUT≥4分、手术时间、补液量、肝门阻断时间、血浆输注、红细胞输注、术中失血量、引流管放置时间、术后胆漏方面差异均有统计学意义(P值均<0.05)(表 1)。
表 1 肝切除术后感染影响因素的单因素分析Table 1. Univariate analysis of the influencing factors of infection after hepatectomy变量 感染组(n=28) 非感染组(n=139) 统计值 P值 年龄(岁) 63.3±8.2 59.3±11.1 t=1.783 0.076 男/女(例) 22/6 117/22 χ2=0.524 0.469 高血压(是/否,例) 11/15 47/90 χ2=0.610 0.435 糖尿病(是/否,例) 9/19 16/123 χ2=7.794 0.005 乙型肝炎(是/否,例) 18/10 99/40 χ2=0.535 0.465 肝硬化(是/否,例) 11/17 72/67 χ2=1.60 0.227 肿瘤数目[例(%)] χ2=3.571 0.059 单发 17(60.7) 108(77.7) 多发 11(39.3) 31(22.3) 肿瘤大小[例(%)] χ2=2.056 0.152 <5 cm 8(28.6) 60(43.2) ≥5 cm 20(71.4) 79(65.8) Edmonson分级[例(%)] χ2=0.004 0.952 Ⅰ~Ⅱ级 7(25.0) 34(24.5) Ⅲ~Ⅳ级 21(75.0) 105(75.5) 手术部位[例(%)] χ2=0.307 0.858 左半肝 8(28.6) 44(31.6) 右半肝 18(64.3) 82(59.0) 双侧半肝 2(7.1) 13(9.4) 肝段切除[例(%)] χ2=0.874 0.350 <3段 19(67.9) 106(76.3) ≥3段 9(32.1) 33(23.7) 手术方式[例(%)] χ2=8.224 0.004 开腹 24(85.7) 79(56.8) 腹腔镜 4(14.3) 60(43.2) AFP[例(%)] χ2=0.204 0.652 ≥20 ng/mL 10(35.7) 56(40.3) <20 ng/mL 18(64.3) 83(59.7) ALT(U/L) 28.5(18.3~53.3) 27.0(17.0~40.0) Z=-0.791 0.429 AST(U/L) 29.5(24.3~42.3) 29.0(22.0~47.0) Z=-0.079 0.937 TBil(μmol/L) 18.9(12.8~34.5) 16.0(11.7~21.4) Z=-1.545 0.122 Alb (g/L) 40.0(37.0~42.9) 40.1(37.3~43.0) Z=-0.261 0.794 PT (s) 11.5(10.8~12.2) 11.5(10.9~12.2) Z=-0.718 0.473 PLT(×109/L) 164.0(122.0~221.0) 171.5(119.0~213.3) Z=-0.287 0.774 血肌酐(μmol/L) 60.0(52.3~80.8) 65.5(56.8~74.0) Z=-0.600 0.548 总胆固醇(mmol/L) 4.0(3.1~4.5) 3.9(3.4~4.5) Z=-0.006 0.995 乳酸脱氢酶(U/L) 199.5(181.5~249.2) 212.0(182.0~257.0) Z=-0.651 0.515 碱性磷酸酶(U/L) 97.3(73.5~139.9) 84.0(69.0~114.7) Z=-1.294 0.196 术前NLR 3.4(2.2~4.6) 2.4(1.9~3.2) Z=-2.609 0.009 ALBI评分 -2.6(-2.8~-2.2) -2.6(-2.9~-2.4) Z=-0.782 0.434 CONUT评分[例(%)] χ2=6.487 0.011 ≥4分 15(53.6) 40(28.8) <4分 13(46.4) 99(71.2) 引流管放置时间[例(%)] χ2=10.102 0.001 >7 d 18(64.3) 45(32.4) ≤7 d 10(35.7) 94(67.6) ASA分级[例(%)] χ2=0.157 0.692 1~2级 16(57.1) 85(61.2) 3~4级 12(42.9) 54(38.8) 手术时间(min) 365(228~380) 240(190~300) Z=-3.451 0.001 术中出血量(mL) 800(600~1300) 500(300~700) Z=-4.992 0.001 术中补液量(mL) 2500(2100~2800) 2150(1800~2700) Z=-2.542 0.011 肝门阻断时间(min) 40(30~49) 30(19~40) Z=-2.134 0.033 血浆输注(有/无,例) 17/11 52/87 χ2=5.220 0.022 红细胞输注(有/无,例) 18/10 55/84 χ2=5.787 0.016 术后胆漏(有/无,例) 7/21 10/129 χ2=8.081 0.004 2.3 多因素分析
以肝切除术后是否发生感染并发症作为因变量,将单因素分析中P<0.05的变量作为自变量进行非条件二元Logistic回归分析。分析结果显示,糖尿病、CONUT≥4分、手术时间、术前NLR、术中失血量、引流管放置时间>7 d这6个变量是术后发生感染的独立影响因素(P值均<0.05)(表 2)。
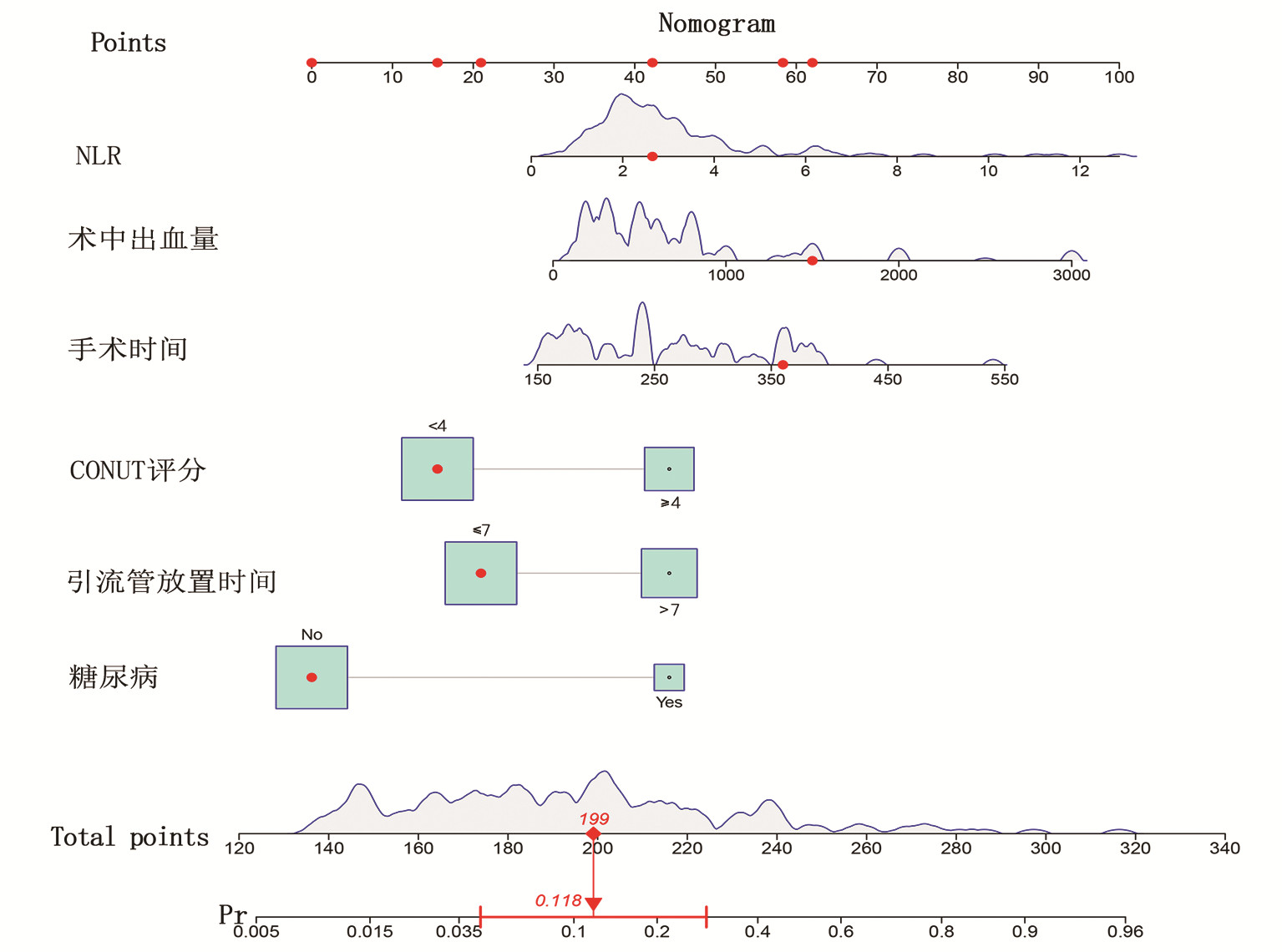
表 2 肝切除术后感染影响因素的多因素分析Table 2. Multivariate analysis of the influencing factors of infection after hepatectomy变量 β值 SE Wald OR 95%CI P值 糖尿病 -1.934 0.618 9.780 0.145 0.043~0.486 0.002 CONUT≥4分 1.254 0.525 5.695 3.504 1.251~9.814 0.017 术前NLR -0.247 0.114 4.736 0.781 0.625~0.976 0.030 手术时间 -0.006 0.003 4.533 0.994 0.988~0.999 0.033 术中失血量 -0.001 0.001 5.870 0.999 0.998~1.000 0.015 引流管放置时间>7 d 1.019 0.516 3.891 2.770 1.006~7.621 0.049 2.4 列线图模型的建立与验证
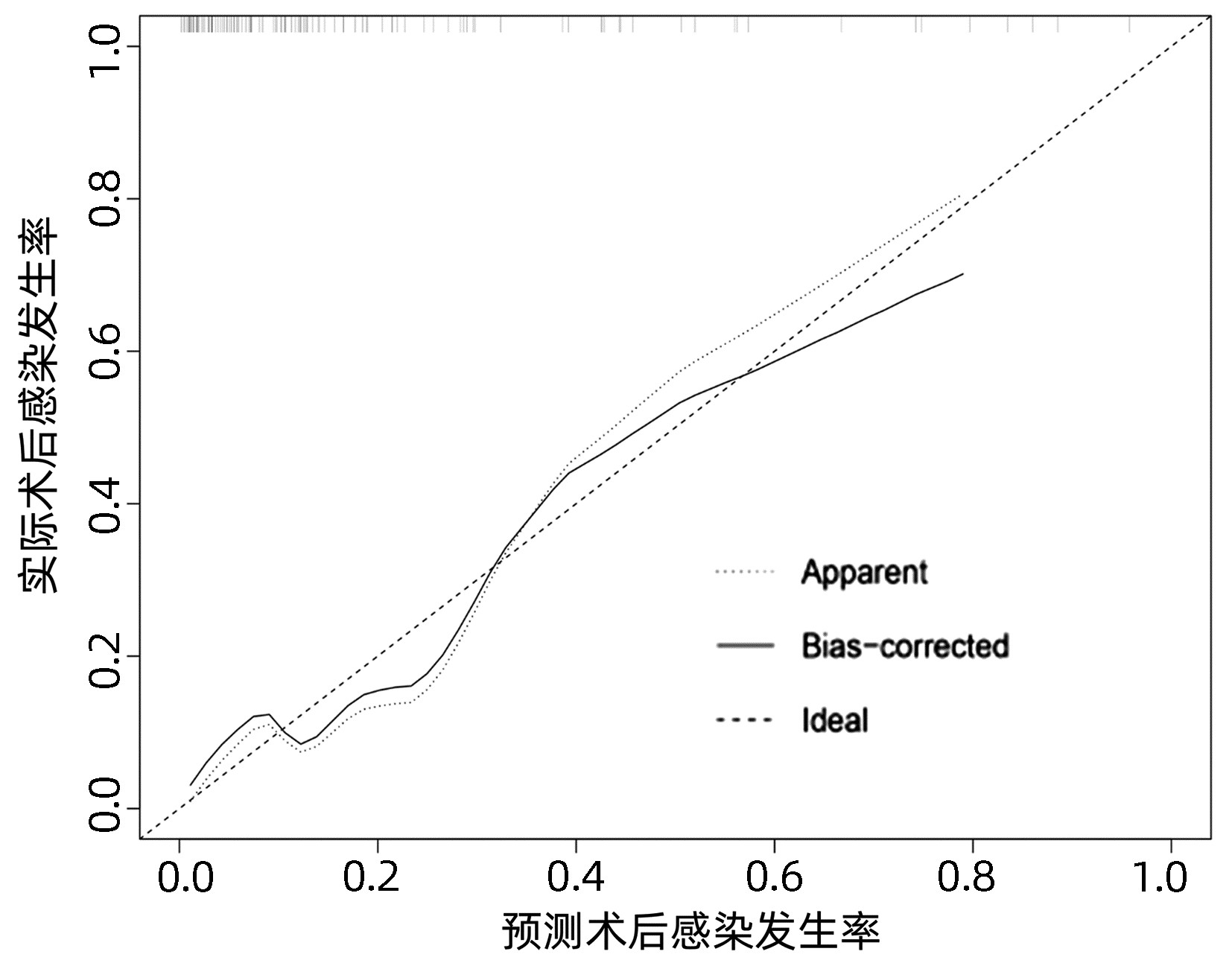
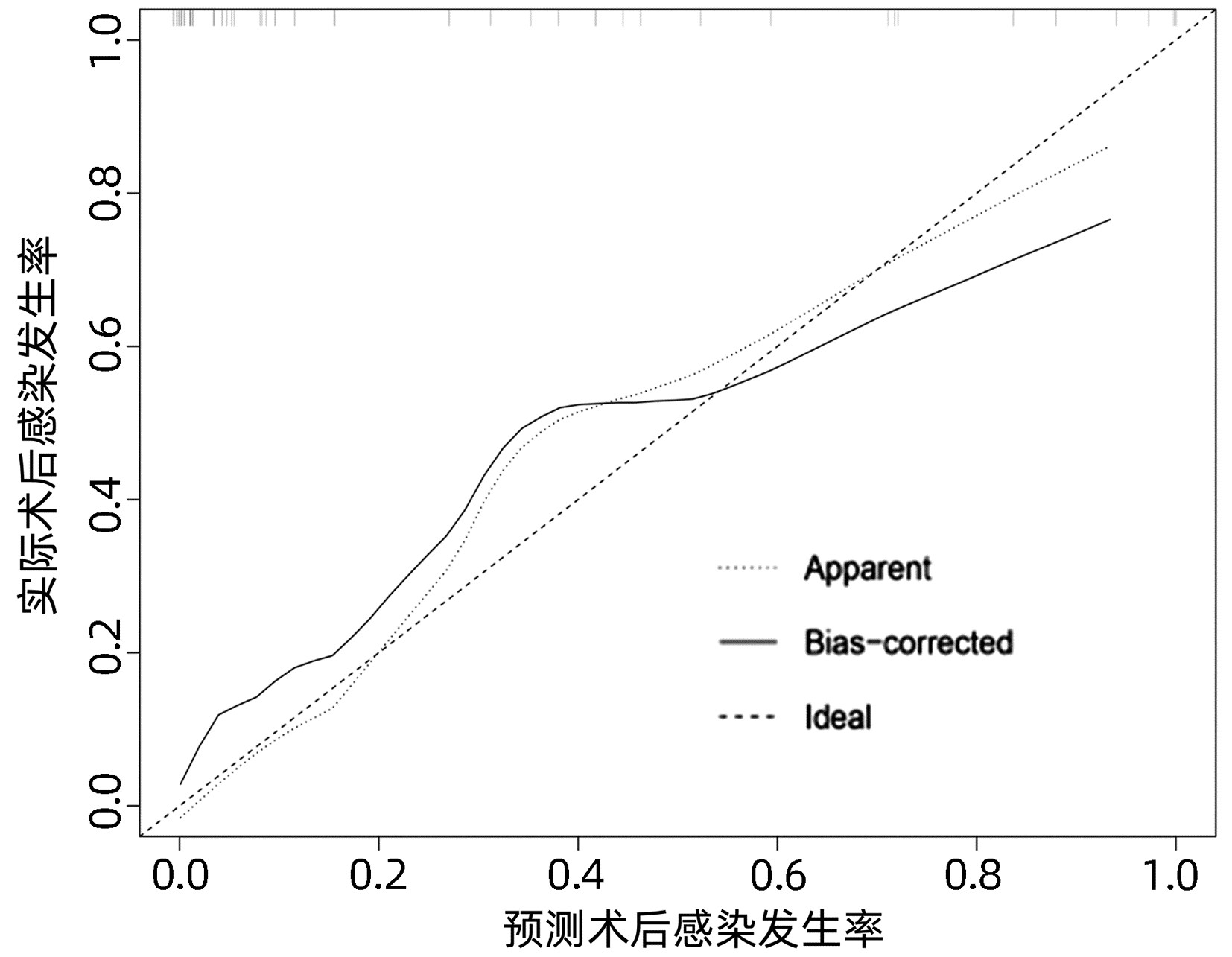
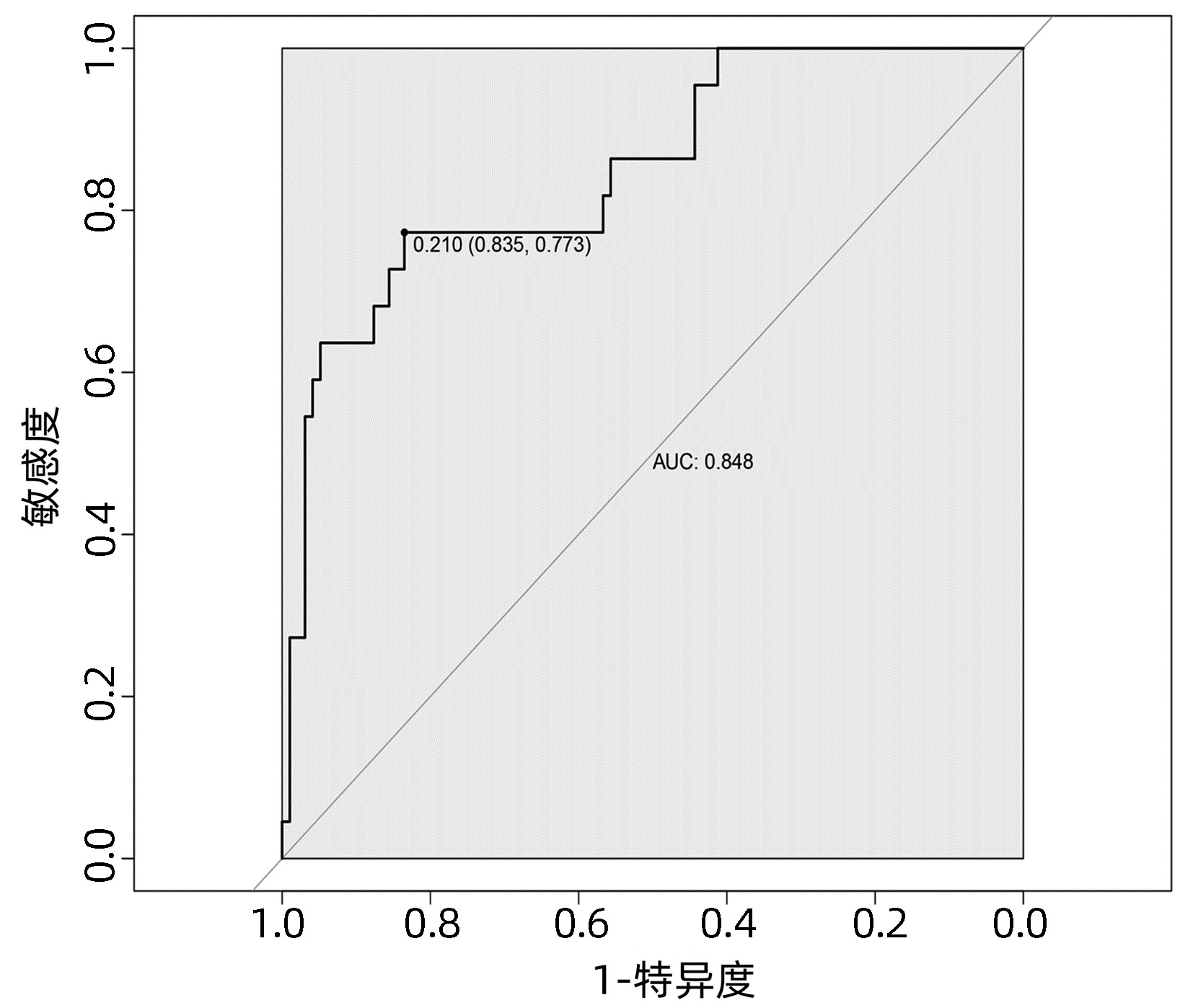
基于独立影响因素构建个体化列线图风险预测模型(图 1), 并绘制校准曲线和ROC曲线。训练集和验证集的校准曲线显示预测值与实际观测值基本一致,表明列线图模型预测的准确度较好(图 2、3)。训练集和验证集的ROC曲线下面积分别为0.848、0.853,表明模型的区分度较好(图 4、5)。
3. 讨论
术后感染是肝切除术较常见的并发症,与患者的预后密切相关[12]。本研究167例肝癌肝切除患者中,术后感染并发症的发生率为16.8%。笔者建立的肝切除术后感染的可视化列线图风险预测模型利于及时筛查高风险患者以及优化肝癌患者的围手术期管理。肝癌肝切除术后感染可能与手术创伤和抗感染力度不足以及内源性因素等有关[13]。全身状况差、免疫功能低下的肝癌患者是术后感染的高危人群[14]。由于临床抗生素的滥用,致病菌菌谱可发生变化,多重耐药菌的出现可使院内感染的发生率增加,同时导致抗感染治疗更加棘手[15]。
目前,有关肝癌肝切除术后总体并发症风险预测模型已有一些研究[16-17],但结合营养评分、NLR和术中预测因子的肝切除术后感染的个性化列线图风险预测模型较少。本研究所建立预测模型由糖尿病、CONUT评分、手术时间、术前NLR、术中失血量、引流管放置时间这6个变量组成,包含术前、术中及术后预测因子,这将有利于降低患者术后感染的发生率、指导肝癌患者术后治疗与康复计划、降低患者的经济负担。
本研究结果表明,糖尿病是肝切除术后发生感染的独立危险因素。糖尿病患者的高糖状态为致病菌的生长、繁殖提供了便利,若同时伴随免疫功能的紊乱还会增加对细菌的易感性。术前合并糖尿病、围手术期血糖控制不佳是术后发生感染的重要因素[18-19]。NLR是一种新的全身炎症反应标志物,高NLR可作为接受射频消融或肝切除的肝癌患者和其他类型癌症患者预后不良的预测因子[20-21]。Ruan等[22]发现,NLR是肝癌肝切除术后发生感染的的独立影响因素,这与本研究的结果一致。CONUT评分映了患者的免疫营养状态,与肝癌、胰腺癌等消化系统恶性肿瘤的预后密切相关[23-24]。本研究以4分为CONUT评分的临界值,将所有患者分为CONUT<4分,CONUT≥4分两组,结果表明,CONUT≥4分是肝切除术后发生感染的独立影响因素。
本研究认为,手术时间是肝切除术后发生感染的独立影响因素,与既往研究结果一致[25-26]。长时间的麻醉状态和手术应激状态将加重患者的心肺负荷,从而增加术后感染的风险。术中出血量是肝切除术后发生感染的重要影响因素,术中大量出血可导致肝肠供血供氧不足产生应激,导致肝细胞结构和功能损伤,同时肠黏膜屏障受损可导致菌群失调引发感染[27-29]。肝切除术后为排除过多的液体和坏死的肝组织,临床上多予以留置引流管,腹腔引流管留置时间≥7 d的患者发生术后感染的概率明显增加[30],是肝切除术后发生感染的独立影响因素,与本研究的结果相符合。因此,临床医生在工作中要根据患者的引流量情况及时拔除引流管以免增加感染的风险。
由于列线图模型将多因素分析中结果可视化、直观化,模型的评估简捷,临床资料获取方便等优点使其易于推广临床。本研究所建立的列线图模型具有良好的区分度和校准度。同时,本研究也存在一定的局限性,该预测模型属于单中心研究,尚未开展外部验证,笔者希望今后可对模型进行时间和空间的外部验证,以提高模型在临床上的适用性。
综上所述,糖尿病、CONUT≥4分、手术时间、术前NLR、术中失血量、引流管放置时间>7 d是肝切除术后发生感染的独立危险因素。以此为基础建立个体化列线图风险预测模型预测效能良好,能有效筛查高风险患者,进而指导临床医生优化对高风险患者的围手术期管理,降低患者术后感染的发生率。
-
表 1 肝切除术后感染影响因素的单因素分析
Table 1. Univariate analysis of the influencing factors of infection after hepatectomy
变量 感染组(n=28) 非感染组(n=139) 统计值 P值 年龄(岁) 63.3±8.2 59.3±11.1 t=1.783 0.076 男/女(例) 22/6 117/22 χ2=0.524 0.469 高血压(是/否,例) 11/15 47/90 χ2=0.610 0.435 糖尿病(是/否,例) 9/19 16/123 χ2=7.794 0.005 乙型肝炎(是/否,例) 18/10 99/40 χ2=0.535 0.465 肝硬化(是/否,例) 11/17 72/67 χ2=1.60 0.227 肿瘤数目[例(%)] χ2=3.571 0.059 单发 17(60.7) 108(77.7) 多发 11(39.3) 31(22.3) 肿瘤大小[例(%)] χ2=2.056 0.152 <5 cm 8(28.6) 60(43.2) ≥5 cm 20(71.4) 79(65.8) Edmonson分级[例(%)] χ2=0.004 0.952 Ⅰ~Ⅱ级 7(25.0) 34(24.5) Ⅲ~Ⅳ级 21(75.0) 105(75.5) 手术部位[例(%)] χ2=0.307 0.858 左半肝 8(28.6) 44(31.6) 右半肝 18(64.3) 82(59.0) 双侧半肝 2(7.1) 13(9.4) 肝段切除[例(%)] χ2=0.874 0.350 <3段 19(67.9) 106(76.3) ≥3段 9(32.1) 33(23.7) 手术方式[例(%)] χ2=8.224 0.004 开腹 24(85.7) 79(56.8) 腹腔镜 4(14.3) 60(43.2) AFP[例(%)] χ2=0.204 0.652 ≥20 ng/mL 10(35.7) 56(40.3) <20 ng/mL 18(64.3) 83(59.7) ALT(U/L) 28.5(18.3~53.3) 27.0(17.0~40.0) Z=-0.791 0.429 AST(U/L) 29.5(24.3~42.3) 29.0(22.0~47.0) Z=-0.079 0.937 TBil(μmol/L) 18.9(12.8~34.5) 16.0(11.7~21.4) Z=-1.545 0.122 Alb (g/L) 40.0(37.0~42.9) 40.1(37.3~43.0) Z=-0.261 0.794 PT (s) 11.5(10.8~12.2) 11.5(10.9~12.2) Z=-0.718 0.473 PLT(×109/L) 164.0(122.0~221.0) 171.5(119.0~213.3) Z=-0.287 0.774 血肌酐(μmol/L) 60.0(52.3~80.8) 65.5(56.8~74.0) Z=-0.600 0.548 总胆固醇(mmol/L) 4.0(3.1~4.5) 3.9(3.4~4.5) Z=-0.006 0.995 乳酸脱氢酶(U/L) 199.5(181.5~249.2) 212.0(182.0~257.0) Z=-0.651 0.515 碱性磷酸酶(U/L) 97.3(73.5~139.9) 84.0(69.0~114.7) Z=-1.294 0.196 术前NLR 3.4(2.2~4.6) 2.4(1.9~3.2) Z=-2.609 0.009 ALBI评分 -2.6(-2.8~-2.2) -2.6(-2.9~-2.4) Z=-0.782 0.434 CONUT评分[例(%)] χ2=6.487 0.011 ≥4分 15(53.6) 40(28.8) <4分 13(46.4) 99(71.2) 引流管放置时间[例(%)] χ2=10.102 0.001 >7 d 18(64.3) 45(32.4) ≤7 d 10(35.7) 94(67.6) ASA分级[例(%)] χ2=0.157 0.692 1~2级 16(57.1) 85(61.2) 3~4级 12(42.9) 54(38.8) 手术时间(min) 365(228~380) 240(190~300) Z=-3.451 0.001 术中出血量(mL) 800(600~1300) 500(300~700) Z=-4.992 0.001 术中补液量(mL) 2500(2100~2800) 2150(1800~2700) Z=-2.542 0.011 肝门阻断时间(min) 40(30~49) 30(19~40) Z=-2.134 0.033 血浆输注(有/无,例) 17/11 52/87 χ2=5.220 0.022 红细胞输注(有/无,例) 18/10 55/84 χ2=5.787 0.016 术后胆漏(有/无,例) 7/21 10/129 χ2=8.081 0.004 表 2 肝切除术后感染影响因素的多因素分析
Table 2. Multivariate analysis of the influencing factors of infection after hepatectomy
变量 β值 SE Wald OR 95%CI P值 糖尿病 -1.934 0.618 9.780 0.145 0.043~0.486 0.002 CONUT≥4分 1.254 0.525 5.695 3.504 1.251~9.814 0.017 术前NLR -0.247 0.114 4.736 0.781 0.625~0.976 0.030 手术时间 -0.006 0.003 4.533 0.994 0.988~0.999 0.033 术中失血量 -0.001 0.001 5.870 0.999 0.998~1.000 0.015 引流管放置时间>7 d 1.019 0.516 3.891 2.770 1.006~7.621 0.049 -
[1] SUNG H, FERLAY J, SIEGEL RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI: 10.3322/caac.21660. [2] VILLANUEVA A. Hepatocellular carcinoma[J]. N Engl J Med, 2019, 380(15): 1450-1462. DOI: 10.1056/NEJMra1713263. [3] LI YM, CHEN H, FENG ZD. Surgical treatments of primary liver cancer[J/CD]. Chin J Hepat Surg(Electronic Edition), 2021, 10(4): 343-347. DOI: 10.3877/cma.j.issn.2095-3232.2021.04.001.李玉民, 陈昊, 冯泽东. 原发性肝癌外科治疗[J/CD]. 中华肝脏外科手术学电子杂志, 2021, 10(4): 343-347. DOI: 10.3877/cma.j.issn.2095-3232.2021.04.001. [4] YUAN SX, ZHOU WP. Progress and hot spots of comprehensive treatment for primary liver cancer[J]. Chin J Dig Surg, 2021, 20(2): 163-170. DOI: 10.3760/cma.j.cn115610-20201211-00776.袁声贤, 周伟平. 原发性肝癌综合治疗的进展和热点[J]. 中华消化外科杂志, 2021, 20(2): 163-170. DOI: 10.3760/cma.j.cn115610-20201211-00776. [5] RAHBARI NN, MEHRABI A, MOLLBERG NM, et al. Hepatocellular carcinoma: current management and perspectives for the future[J]. Ann Surg, 2011, 253(3): 453-469. DOI: 10.1097/SLA.0b013e31820d944f. [6] SADAMORI H, YAGI T, SHINOURA S, et al. Risk factors for major morbidity after liver resection for hepatocellular carcinoma[J]. Br J Surg, 2013, 100(1): 122-129. DOI: 10.1002/bjs.8957. [7] WU KT, WANG CC, LU LG, et al. Hepatocellular carcinoma: clinical study of long-term survival and choice of treatment modalities[J]. World J Gastroenterol, 2013, 19(23): 3649-3657. DOI: 10.3748/wjg.v19.i23.3649. [8] KAIBORI M, ISHIZAKI M, MATSUI K, et al. Postoperative infectious and non-infectious complications after hepatectomy for hepatocellular carcinoma[J]. Hepatogastroenterology, 2011, 58(110-111): 1747-1756. DOI: 10.5754/hge10533. [9] LIU HJ, BAO CM, BAI WL, et al. Risk factors for infectious complications in primary liver cancer[J]. J Clin Hepatol, 2018, 34(5): 1033-1037. DOI: 10.3969/j.issn.1001-5256.2018.05.021.刘洪金, 鲍春梅, 白文林, 等. 原发性肝癌发生感染性并发症的危险因素分析[J]. 临床肝胆病杂志, 2018, 34(5): 1033-1037. DOI: 10.3969/j.issn.1001-5256.2018.05.021. [10] TANG H, LU W, YANG Z, et al. Risk factors and long-term outcome for postoperative intra-abdominal infection after hepatectomy for hepatocellular carcinoma[J]. Medicine (Baltimore), 2017, 96(17): e6795. DOI: 10.1097/MD.0000000000006795. [11] QIU JJ, MO XS, TENG YJ, et al. Establishment and evaluation of a nomogram risk prediction model for severe complications in patients after hepatectomy for hepatocellular carcinoma[J]. Chin J Gen Surg, 2021, 30(1): 24-31. DOI: 10.7659/j.issn.1005-6947.2021.01.004.邱洁净, 莫新少, 滕艳娟, 等. 肝细胞癌患者肝切除术后严重并发症列线图风险预测模型的建立与评价[J]. 中国普通外科杂志, 2021, 30(1): 24-31. DOI: 10.7659/j.issn.1005-6947. 2021.01.004. [12] YANG T, LIU K, LIU CF, et al. Impact of postoperative infective complications on long-term survival after liver resection for hepatocellular carcinoma[J]. Br J Surg, 2019, 106(9): 1228-1236. DOI: 10.1002/bjs.11231. [13] HAVERKAMP L, WEIJS TJ, van der SLUIS PC, et al. Laparoscopic total gastrectomy versus open total gastrectomy for cancer: a systematic review and meta-analysis[J]. Surg Endosc, 2013, 27(5): 1509-1520. DOI: 10.1007/s00464-012-2661-1. [14] WANG XH, LIU FB, ZHAO YJ, et al. Influence of hepatic steatosis on postoperative infections in patients undergoing liver resection[J]. Chin J Nosocomiol, 2015, 25(21): 4944-4946. DOI: 10.11816/cn.ni.2015-142708.汪学华, 刘付宝, 赵义军, 等. 肝脏脂肪变性对肝脏切除术后感染的影响分析[J]. 中华医院感染学杂志, 2015, 25(21): 4944-4946. DOI: 10.11816/cn.ni.2015-142708. [15] GAO F, ZHANG XN, CHEN MZ, et al. Prophylactic use of antibiotics after interventional procedures for primary hepatocellular carcinoma: its clinical significance[J]. J Intervent Radiol, 2013, 22(2): 151-153. DOI: 10.3969/j.issn.1008-794X.2013.02.016.高峰, 张雪娜, 陈茂振, 等. 原发性肝癌TACE术后预防性抗生素应用价值研究[J]. 介入放射学杂志, 2013, 22(2): 151-153. DOI: 10.3969/j.issn.1008-794X.2013.02.016. [16] WANG H, YANG J, YANG J, et al. Development and validation of a prediction score for complications after hepatectomy in hepatitis B-related hepatocellular carcinoma patients[J]. PLoS One, 2014, 9(8): e105114. DOI: 10.1371/journal.pone.0105114. [17] MA KW, CHEUNG TT, SHE WH, et al. Risk prediction model for major complication after hepatectomy for malignant tumour - A validated scoring system from a university center[J]. Surg Oncol, 2017, 26(4): 446-452. DOI: 10.1016/j.suronc.2017.08.007. [18] FU XB, HE JY, ZHANG YH, et al. Perioperative management of liver cancer patients with concomitant hyperglycemia. [J]. Chin J Gen Surg, 2011, 20(7): 680-682. https://www.cnki.com.cn/Article/CJFDTOTAL-ZPWZ201107006.htm傅熙博, 贺金云, 张玉会, 等. 并存高血糖肝癌患者的围手术期处理[J]. 中国普通外科杂志, 2011, 20(7): 680-682. https://www.cnki.com.cn/Article/CJFDTOTAL-ZPWZ201107006.htm [19] OKABAYASHI T, ICHIKAWA K, NAMIKAWA T, et al. Effect of perioperative intensive insulin therapy for liver dysfunction after hepatic resection[J]. World J Surg, 2011, 35(12): 2773-2778. DOI: 10.1007/s00268-011-1299-9. [20] DAN J, ZHANG Y, PENG Z, et al. Postoperative neutrophil-to-lymphocyte ratio change predicts survival of patients with small hepatocellular carcinoma undergoing radiofrequency ablation[J]. PLoS One, 2013, 8(3): e58184. DOI: 10.1371/journal.pone.0058184. [21] JUNG MR, PARK YK, JEONG O, et al. Elevated preoperative neutrophil to lymphocyte ratio predicts poor survival following resection in late stage gastric cancer[J]. J Surg Oncol, 2011, 104(5): 504-510. DOI: 10.1002/jso.21986. [22] RUAN DY, LIN ZX, LI Y, et al. Poor oncologic outcomes of hepatocellular carcinoma patients with intra-abdominal infection after hepatectomy[J]. World J Gastroenterol, 2015, 21(18): 5598-5606. DOI: 10.3748/wjg.v21.i18.5598. [23] MAO YS, HAO SJ, ZOU CF, et al. Controlling Nutritional Status score is superior to Prognostic Nutritional Index score in predicting survival and complications in pancreatic ductal adenocarcinoma: a Chinese propensity score matching study[J]. Br J Nutr, 2020, 124(11): 1190-1197. DOI: 10.1017/S0007114520002299. [24] HARIMOTO N, YOSHIZUMI T, SAKATA K, et al. Prognostic significance of preoperative controlling nutritional status (CONUT) score in patients undergoing hepatic resection for hepatocellular carcinoma[J]. World J Surg, 2017, 41(11): 2805-2812. DOI: 10.1007/s00268-017-4097-1. [25] ZHAO Y, JIN Y, WU Y. Postoperative infectious complications after liver resection for hepatocellular carcinoma[J]. J Cancer Res Ther, 2016, 12(Suppl): C268-C270. DOI: 10.4103/0973-1482.200754. [26] CHACON E, EMAN P, DUGAN A, et al. Effect of operative duration on infectious complications and mortality following hepatectomy[J]. HPB (Oxford), 2019, 21(12): 1727-1733. DOI: 10.1016/j.hpb.2019.05.001. [27] NANASHIMA A, ARAI J, OYAMA S, et al. Associated factors with surgical site infections after hepatectomy: predictions and countermeasures by a retrospective cohort study[J]. Int J Surg, 2014, 12(4): 310-314. DOI: 10.1016/j.ijsu.2014.01.018. [28] LI X, YUAN LY, LIU SS, et al. Influencing factors of postoperative infections in primary liver cancer patients underwent partial hepatectomy. [J]. J Prac Hepatol, 2018, 21(1): 127-128. DOI: 10.3969/j.issn.1672-5069.2018.01.035.李霞, 袁玲雁, 刘双双, 等. 肝部分切除术患者术后并发感染的相关影响因素分析[J]. 实用肝脏病杂志, 2018, 21(1): 127-128. DOI: 10.3969/j.issn.1672-5069.2018.01.035. [29] OKABAYASHI T, NISHIMORI I, YAMASHITA K, et al. Risk factors and predictors for surgical site infection after hepatic resection[J]. J Hosp Infect, 2009, 73(1): 47-53. DOI: 10.1016/j.jhin.2009.04.022. [30] ZHOU WY, LI L, ZHONG JT, et al. Laparotomy and cool-tip radiofrequency ablation for large liver tumors: short-term results. [J]. Chin J Hepatobiliary Surg, 2013, 19(9): 677-680. DOI: 10.3760/cma.j.issn.1007-8118.2013.09.010.周武元, 李磊, 钟敬涛, 等. 开腹射频消融治疗较大肝肿瘤近期疗效分析[J]. 中华肝胆外科杂志, 2013, 19(9): 677-680. DOI: 10.3760/cma.j.issn.1007-8118.2013.09.010. 期刊类型引用(10)
1. 温芳芳,张龙,王娟. 预后营养指数、血清白蛋白对肝切除术病人术后感染风险的预测价值及护理指导意义. 全科护理. 2025(02): 236-239 .  百度学术
百度学术2. 孙文秀,张松黎,沈翔,李慧琴,张小鹏,彭海仙. 严重胸部创伤患者呼吸机相关性肺炎感染特点及其危险因素分析. 中国消毒学杂志. 2025(03): 190-193 .  百度学术
百度学术3. 曾华珺,刘婷婷,叶守婉,宋暖,魏明明. 肝胆管结石患者肝部分切除术后发生腹腔感染的危险因素分析及预测模型构建. 淮海医药. 2024(01): 39-42 .  百度学术
百度学术4. 常江,王勇,杨青壮. 不同肝血流阻断方式在腹腔镜左半肝切除术肝癌患者中的应用. 长春中医药大学学报. 2024(06): 675-680 .  百度学术
百度学术5. 翟鸿烨,王伟,张利军,袁晖,白重阳,柳琳,桂玉婷,翟达. CD64指数、系统免疫炎症指数、CRP/Alb比值与肝癌肝部分切除术患者术后感染的关系. 现代生物医学进展. 2024(17): 3342-3347 .  百度学术
百度学术6. 张雅琼,黄澜,潘聪莹. 多种血液学标志物预测肝癌切除术后感染的临床价值. 中国临床研究. 2024(10): 1542-1546 .  百度学术
百度学术7. 王建超,张怀波,张东瑞. 某院乙肝肝硬化相关早期肝癌患者并发术后感染的病原菌分布与影响因素分析. 抗感染药学. 2024(12): 1258-1262 .  百度学术
百度学术8. 杨宝乐,王小娟,张书瑜,马川,李进虎,黄琼. 基于网络药理学探讨三七治疗肝癌的作用机制. 转化医学杂志. 2023(04): 149-154+163 .  百度学术
百度学术9. 王琪,张玉,王芳芳,郭春霞,杨振浩,何行昌. 原发性肝癌肝动脉化疗栓塞术后医院感染病原菌及其影响因素. 中华医院感染学杂志. 2023(17): 2634-2638 .  百度学术
百度学术10. 陈勇,刘新新. 肝切除术后应用不同疗程抗菌药物治疗对感染发生率的影响. 中国药物经济学. 2023(12): 66-68 .  百度学术
百度学术其他类型引用(4)
-




 PDF下载 ( 2267 KB)
PDF下载 ( 2267 KB)

 下载:
下载:






 下载:
下载:




 百度学术
百度学术