芍药苷对棕榈酸诱导的HepG2细胞的保护作用及其机制
DOI: 10.12449/JCH250316
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:刘彤负责课题设计,资料分析,撰写论文;李善政、周铖参与收集数据,修改论文,统计分析;刘素彤、张丽慧负责论文修改,统计分析;赵文霞负责拟定写作思路,指导撰写文章并最后定稿。
Study on the protective efect and mechanism of paeoniflorin on palmitic acid-induced HepG2 cells
-
摘要:
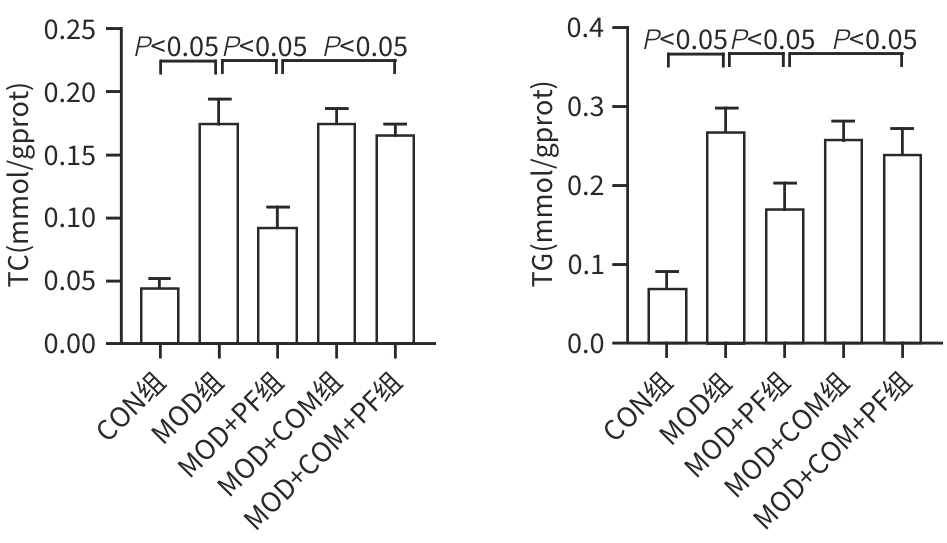
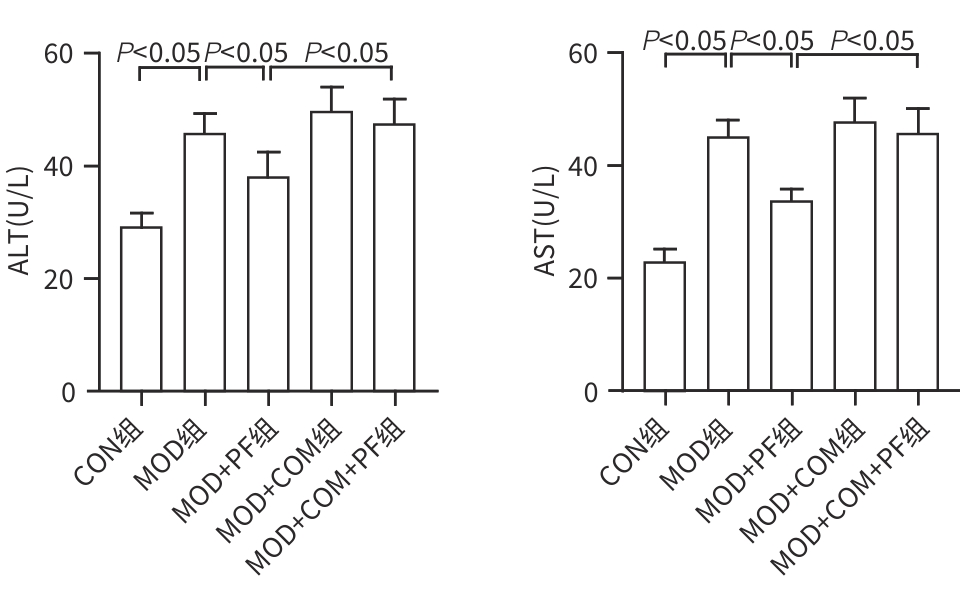
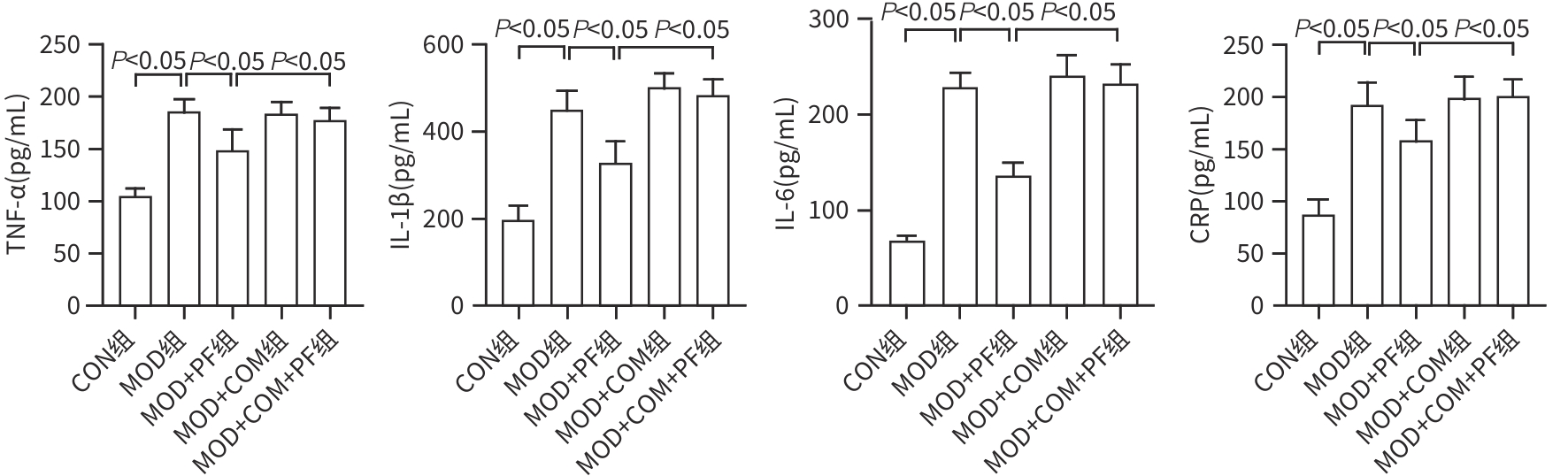
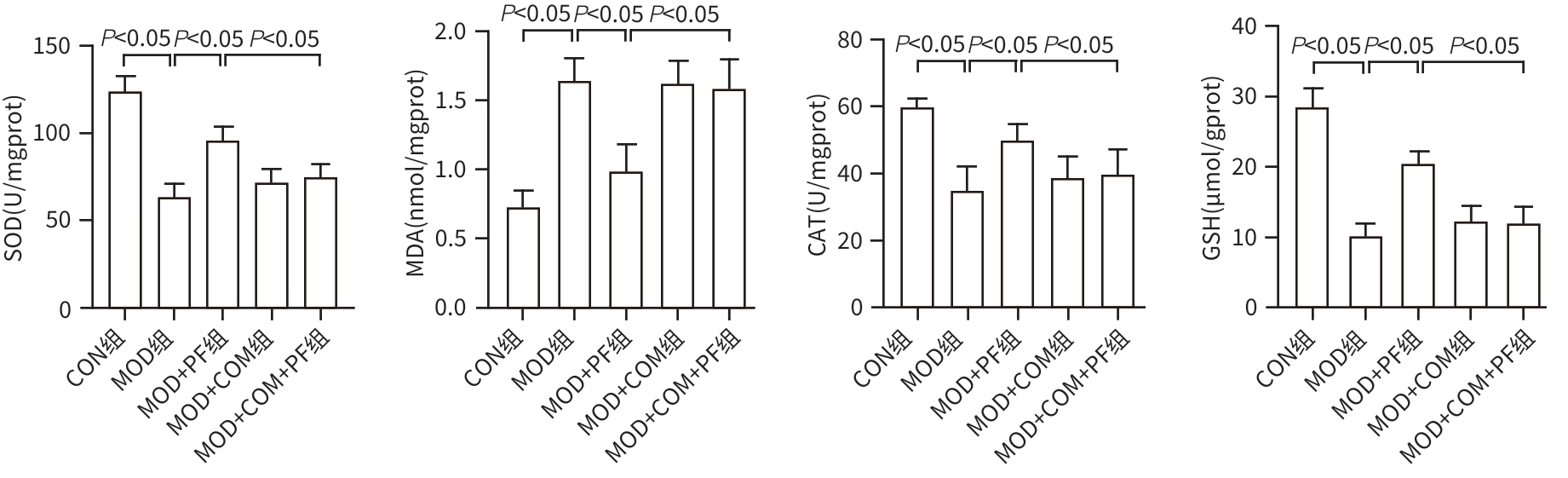
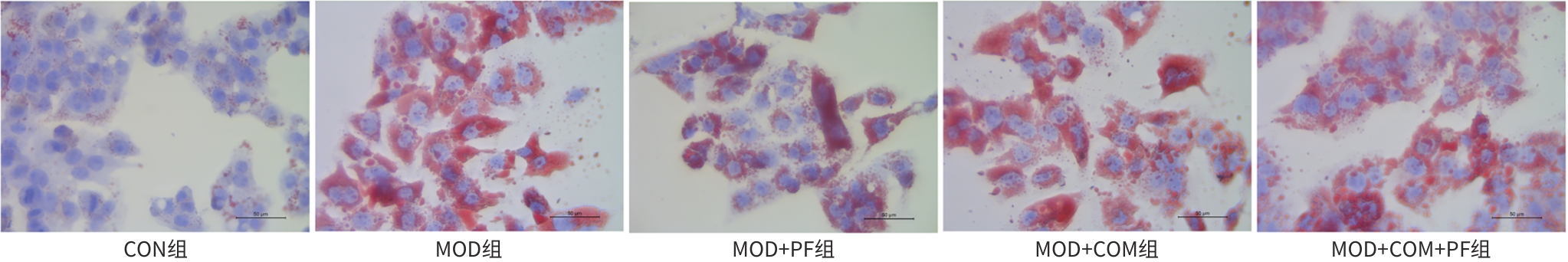
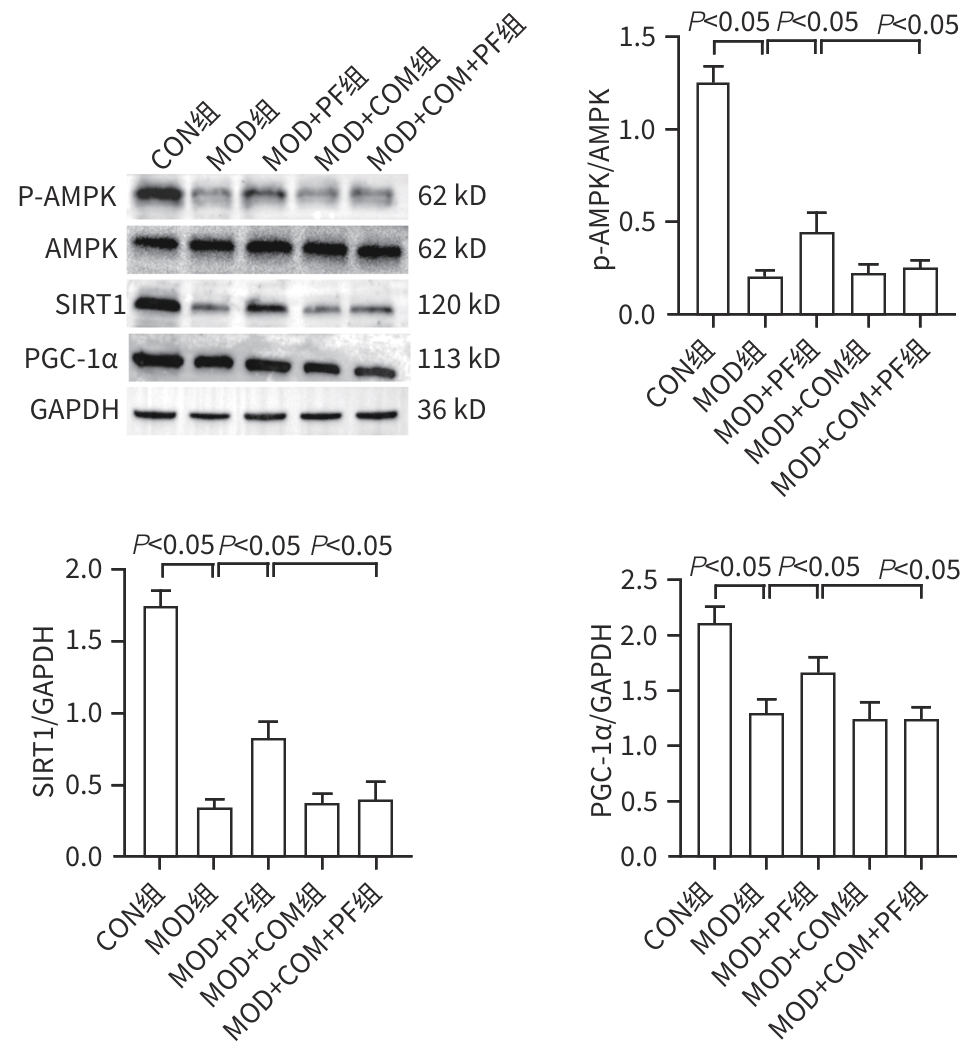
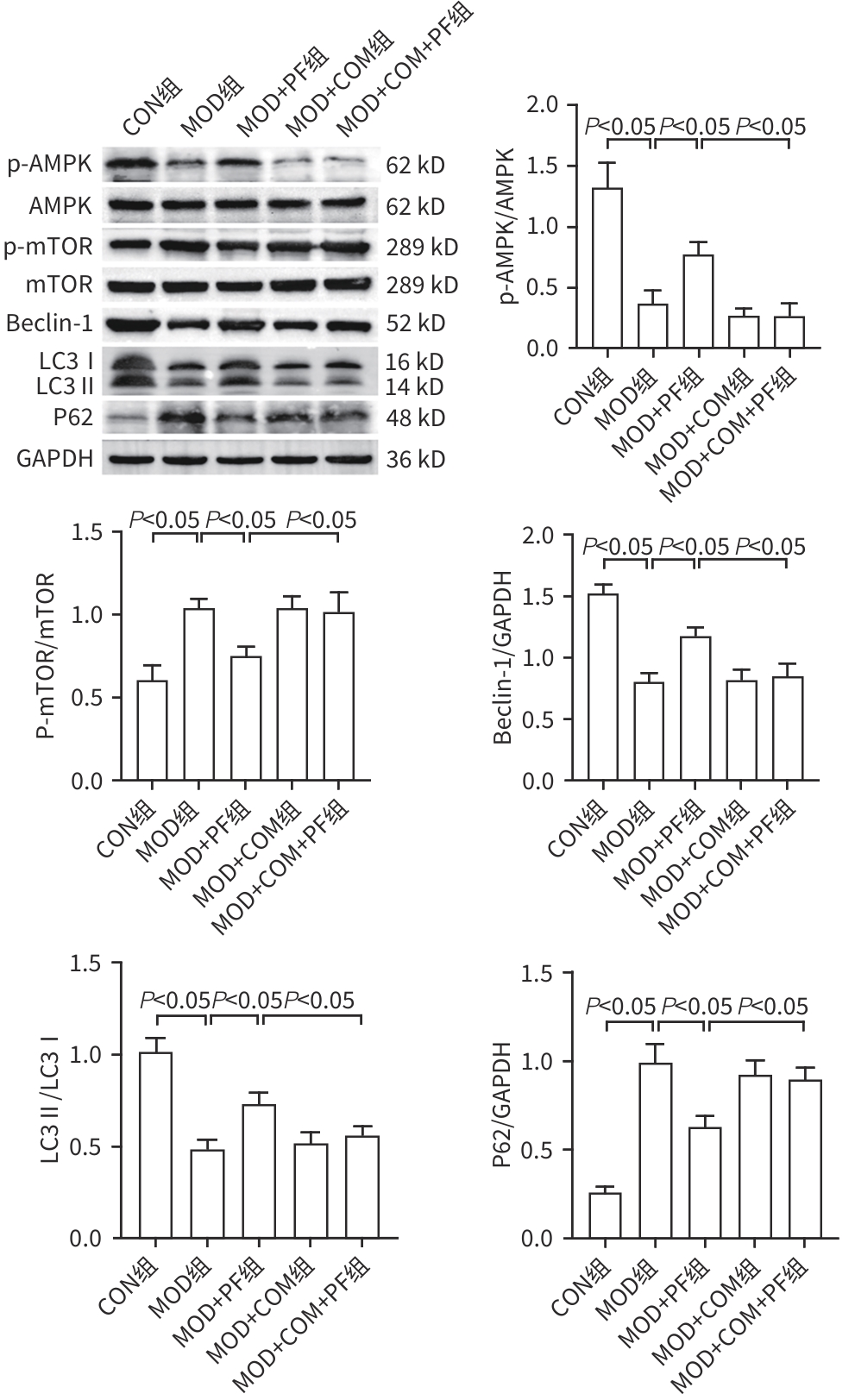
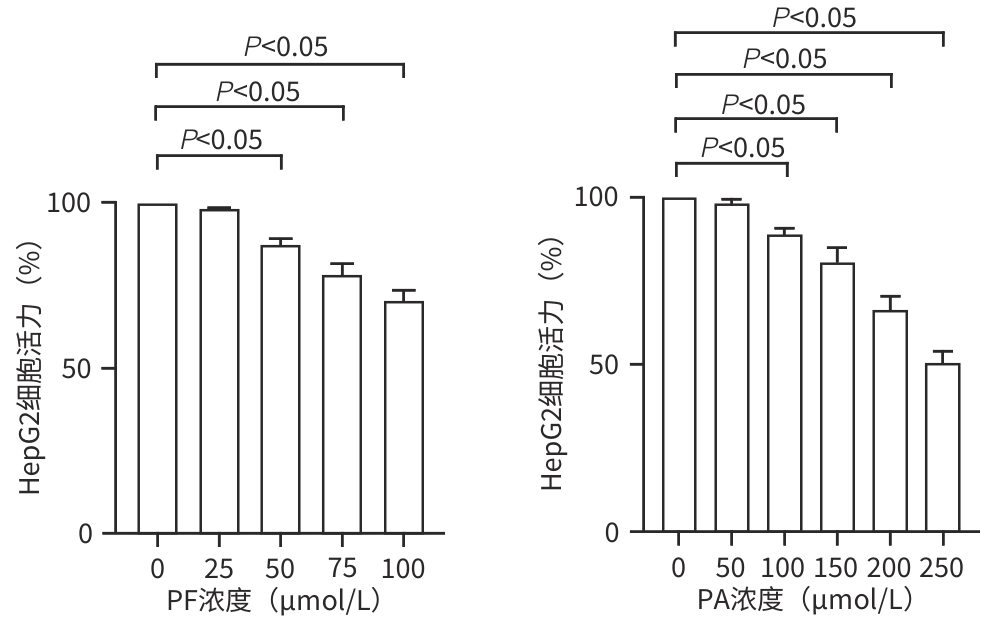
目的 探讨芍药苷(PF)保护棕榈酸(PA)诱导的HepG2细胞的作用及机制。 方法 使用浓度为250 μmol/L的PA刺激HepG2细胞来建立非酒精性脂肪性肝病模型,浓度为10 μmol/L的Compound C作为抑制剂,浓度为25 μmol/L的PF进行干预。实验分为5组:正常组(CON组)使用完全培养基处理,模型组(MOD组)使用PA处理,PF治疗组(MOD+PF组)使用PA+PF处理,模型加抑制剂组(MOD+COM组)使用PA+Compound C处理,模型加抑制剂加PF组(MOD+COM+PF组)使用PA+Compound C+PF处理。使用试剂盒检测细胞脂质沉积指标、肝功能指标、氧化应激指标、炎症指标,油红O染色观察细胞脂质沉积情况,Western Blot法检测细胞中AMP活化蛋白激酶(AMPK)、沉默信息调节因子1(SIRT1)、过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-1α)、哺乳动物雷帕霉素靶蛋白(mTOR)、Beclin-1、LC3、P62蛋白表达。计量数据组间比较采用单因素方差分析,进一步两两比较采用Tukey’s检验。 结果 与MOD组相比,PF改善了细胞中TC、TG水平(P值均<0.05),降低了细胞中ALT、AST、C反应蛋白、TNF-α、IL-1β、IL-6水平(P值均<0.05),升高了细胞中SOD、CAT活性及GSH水平,降低了MDA水平(P值均<0.05)。油红O染色结果显示,PF减轻了细胞脂质沉积。Western Blot结果显示,与MOD相比,PF升高了p-AMPK、SIRT1、PGC-1α、LC3Ⅱ/LC3Ⅰ、Beclin-1蛋白表达,降低了p-mTOR、P62蛋白表达(P值均<0.05)。 结论 PF可抑制PA诱导的非酒精性脂肪性肝病细胞模型的氧化应激和炎症反应,改善脂质沉积,促进细胞自噬,具体作用可能是通过AMPK/SIRT1/PGC-1α/mTOR信号通路来实现的。 Abstract:Objective To investigate the role and mechanism of action of paeoniflorin (PF) in protecting HepG2 cells induced by palmitic acid (PA). Methods HepG2 cells were stimulated with PA at a concentration of 250 μmol/L to establish a NAFLD model. Compound C at a concentration of 10 μmol/L was used as an inhibitor, and PF at a concentration of 25 μmol/L was used for intervention. The experiment was divided into normal group (CON group) treated with complete culture medium, model group (MOD group) treated with PA, PF treatment group (MOD+PF group) treated with PA and PF, model+inhibitor group (MOD+COM group) treated with PA and Compound C, and model+inhibitor+PF group (MOD+COM+PF group) treated with PA, Compound C, and PF. Kits were used to measure lipid deposition indicators, liver function parameters, oxidative stress indicators, and inflammation indicators; oil red O staining was used to observe lipid deposition; Western Blot was used to measure the protein expression levels of AMPK, SIRT1, PGC-1α, mTOR, Beclin-1, LC3, and P62 in cells. The one-way analysis of variance was used for comparison of quantitative data between groups, while the Tukey’s test was used for comparison between two groups. Results Compared with the MOD group, PF improved the levels of TC and TG (P<0.05), reduced the levels of ALT, AST, CRP, TNF-α, IL-1β, and IL-6 (P<0.05), increased the activity of SOD and CAT and the level of GSH, and reduced the level of MDA in cells (all P<0.05). Oil red O staining showed that PF alleviated lipid deposition in cells. Western blot results showed that compared with the MOD group, PF increased the protein expression levels of p-AMPK, SIRT1, PGC-1α, LC3Ⅱ/LC3Ⅰ, and Beclin-1 and reduced the protein expression levels of p-mTOR and P62 (all P<0.05). Conclusion PF can inhibit PA-induced oxidative stress and inflammatory response in HepG2 cells, improve lipid deposition, and promote autophagy via the AMPK/SIRT1/PGC-1α/mTOR signaling pathway. -
Key words:
- Non-alcoholic Fatty Liver Disease /
- Paeoniflorin /
- Hep G2 Cells
-
[1] MARGINI C, DUFOUR JF. The story of HCC in NAFLD: From epidemiology, across pathogenesis, to prevention and treatment[J]. Liver Int, 2016, 36( 3): 317- 324. DOI: 10.1111/liv.13031. [2] SCHUSTER S, CABRERA D, ARRESE M, et al. Triggering and resolution of inflammation in NASH[J]. Nat Rev Gastroenterol Hepatol, 2018, 15( 6): 349- 364. DOI: 10.1038/s41575-018-0009-6. [3] WEI SL, WANG L, EVANS PC, et al. NAFLD and NASH: Etiology, targets and emerging therapies[J]. Drug Discov Today, 2024, 29( 3): 103910. DOI: 10.1016/j.drudis.2024.103910. [4] DAY EA, FORD RJ, STEINBERG GR. AMPK as a therapeutic target for treating metabolic diseases[J]. Trends Endocrinol Metab, 2017, 28( 8): 545- 560. DOI: 10.1016/j.tem.2017.05.004. [5] WEI ZH, XIA JY, LI JT, et al. SIRT1 promotes glucolipid metabolic conversion to facilitate tumor development in colorectal carcinoma[J]. Int J Biol Sci, 2023, 19( 6): 1925- 1940. DOI: 10.7150/ijbs.76704. [6] LIAO JB, XIE XH, WANG N, et al. Formononetin promotes fatty acid β-oxidation to treat non-alcoholic steatohepatitis through SIRT1/PGC-1α/PPARα pathway[J]. Phytomedicine, 2024, 124: 155285. DOI: 10.1016/j.phymed.2023.155285. [7] KIM YC, GUAN KL. mTOR: A pharmacologic target for autophagy regulation[J]. J Clin Invest, 2015, 125( 1): 25- 32. DOI: 10.1172/JCI73939. [8] ZHANG J, FENG QS. Pharmacological effects and molecular protective mechanisms of Astragalus polysaccharides on nonalcoholic fatty liver disease[J]. Front Pharmacol, 2022, 13: 854674. DOI: 10.3389/fphar.2022.854674. [9] ZHOU YX, GONG XH, ZHANG H, et al. A review on the pharmacokinetics of paeoniflorin and its anti-inflammatory and immunomodulatory effects[J]. Biomed Pharmacother, 2020, 130: 110505. DOI: 10.1016/j.biopha.2020.110505. [10] NAGAPPAN A, KIM JH, JUNG DY, et al. Cryptotanshinone from the Salvia miltiorrhiza bunge attenuates ethanol-induced liver injury by activation of AMPK/SIRT1 and Nrf2 signaling pathways[J]. Int J Mol Sci, 2019, 21( 1): 265. DOI: 10.3390/ijms21010265. [11] LAN T, YU Y, ZHANG J, et al. Cordycepin ameliorates non-alcoholic steatohepatitis by activation of the AMP-activated protein kinase signaling pathway[J]. Hepatology, 2021, 74( 2): 686- 703. DOI: 10.1002/hep.31749. [12] PATERNOSTRO R, TRAUNER M. Current treatment of non-alcoholic fatty liver disease[J]. J Intern Med, 2022, 292( 2): 190- 204. DOI: 10.1111/joim.13531. [13] GUO XY, YIN XZ, LIU ZJ, et al. Non-alcoholic fatty liver disease(NAFLD) pathogenesis and natural products for prevention and treatment[J]. Int J Mol Sci, 2022, 23( 24): 15489. DOI: 10.3390/ijms232415489. [14] XIAO Q, ZHANG SJ, YANG C, et al. Ginsenoside Rg1 ameliorates palmitic acid-induced hepatic steatosis and inflammation in HepG2 cells via the AMPK/NF-κB pathway[J]. Int J Endocrinol, 2019, 2019: 7514802. DOI: 10.1155/2019/7514802. [15] CHEN MX, HUANG NQ, LIU J, et al. AMPK: A bridge between diabetes mellitus and Alzheimer’s disease[J]. Behav Brain Res, 2021, 400: 113043. DOI: 10.1016/j.bbr.2020.113043. [16] STEINBERG GR, HARDIE DG. New insights into activation and function of the AMPK[J]. Nat Rev Mol Cell Biol, 2023, 24( 4): 255- 272. DOI: 10.1038/s41580-022-00547-x. [17] YANG YS, LIU Y, WANG YW, et al. Regulation of SIRT1 and its roles in inflammation[J]. Front Immunol, 2022, 13: 831168. DOI: 10.3389/fimmu.2022.831168. [18] QIAN L, ZHU YL, DENG C, et al. Peroxisome proliferator-activated receptor gamma coactivator-1(PGC-1) family in physiological and pathophysiological process and diseases[J]. Signal Transduct Target Ther, 2024, 9( 1): 50. DOI: 10.1038/s41392-024-01756-w. [19] THIRUPATHI A, de SOUZA CT. Multi-regulatory network of ROS: The interconnection of ROS, PGC-1 alpha, and AMPK-SIRT1 during exercise[J]. J Physiol Biochem, 2017, 73( 4): 487- 494. DOI: 10.1007/s13105-017-0576-y. [20] QIAN H, CHAO XJ, WILLIAMS J, et al. Autophagy in liver diseases: A review[J]. Mol Aspects Med, 2021, 82: 100973. DOI: 10.1016/j.mam.2021.100973. [21] BYRNES K, BLESSINGER S, BAILEY NT, et al. Therapeutic regulation of autophagy in hepatic metabolism[J]. Acta Pharm Sin B, 2022, 12( 1): 33- 49. DOI: 10.1016/j.apsb.2021.07.021. [22] MARCONDES-DE-CASTRO IA, REIS-BARBOSA PH, MARINHO TS, et al. AMPK/mTOR pathway significance in healthy liver and non-alcoholic fatty liver disease and its progression[J]. J Gastroenterol Hepatol, 2023, 38( 11): 1868- 1876. DOI: 10.1111/jgh.16272. [23] HWANG HY, SHIM JS, KIM D, et al. Antidepressant drug sertraline modulates AMPK-MTOR signaling-mediated autophagy via targeting mitochondrial VDAC1 protein[J]. Autophagy, 2021, 17( 10): 2783- 2799. DOI: 10.1080/15548627.2020.1841953. [24] KMA L, BARUAH TJ. The interplay of ROS and the PI3K/Akt pathway in autophagy regulation[J]. Biotechnol Appl Biochem, 2022, 69( 1): 248- 264. DOI: 10.1002/bab.2104. [25] ZHOU B, ZHANG J, CHEN YX, et al. Puerarin protects against sepsis-induced myocardial injury through AMPK-mediated ferroptosis signaling[J]. Aging(Albany NY), 2022, 14( 8): 3617- 3632. DOI: 10.18632/aging.204033. -



 PDF下载 ( 2930 KB)
PDF下载 ( 2930 KB)

 下载:
下载: