黄连素对肝脏疾病的防治作用及其机制
DOI: 10.12449/JCH241130
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:王慧丽、秦文昊、胡冰负责课题设计,资料分析,撰写论文;王慧丽、秦文昊、杨档档、宁雅倩参与收集数据,修改论文;王慧丽、林杉、代崧霖负责拟定写作思路,指导撰写文章并最后定稿。
Preventive and therapeutic effects of berberine on liver diseases and its mechanism
-
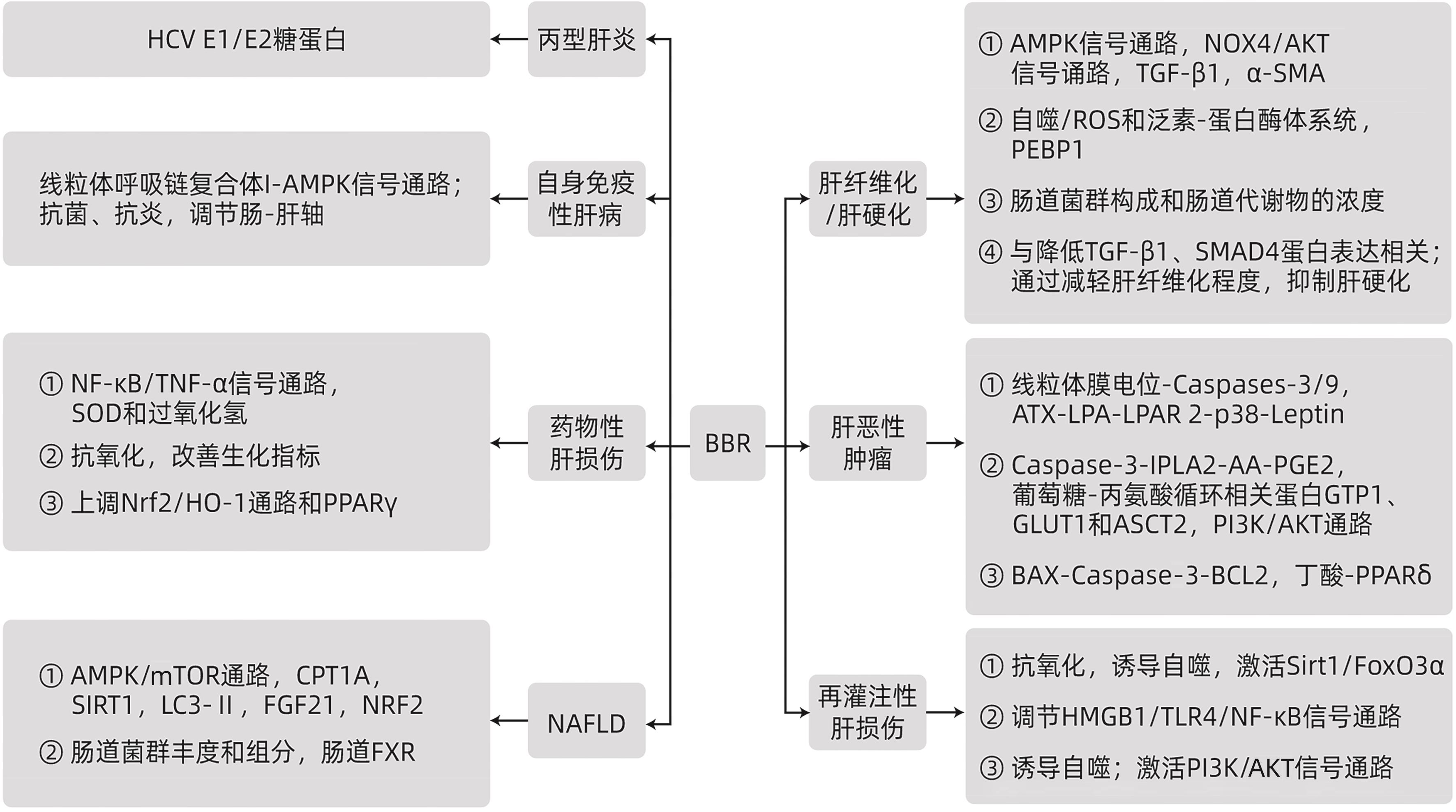
摘要: 黄连素是临床常用的清热解毒药,目前常规被用于治疗细菌性胃肠炎、腹泻等消化道疾病。但近期多项研究表明,黄连素可通过调控腺苷酸活化蛋白激酶、转化生长因子-β等蛋白通路及改变肠道菌群构成,对自身免疫性肝炎、病毒性肝炎、非酒精性脂肪性肝病及肝癌等疾病产生治疗作用,不仅为这些疾病的治疗提供新的药物选择,扩展了黄连素的潜在适应证范围,也为后续类似药物的研发提供了线索。本文旨在总结黄连素对各类肝脏疾病的治疗作用及其机制,为临床的有效应用提供参考。Abstract: Berberine is an antipyretic and detoxicating drug commonly used in clinical practice, and it is currently used for the routine treatment of gastrointestinal diseases such as bacterial gastroenteritis and diarrhea. However, several recent studies have shown that berberine can exert a therapeutic effect on the diseases such as autoimmune hepatitis, viral hepatitis, nonalcoholic fatty liver disease, and liver cancer by regulating the AMPK and TGF-β pathways and altering the composition of intestinal flora. This provides new drugs for the treatment of these diseases, expands the potential indications of berberine, and provides clues for the follow-up research and development of similar drugs. This article summarizes the therapeutic effect and mechanism of berberine on various liver diseases, in order to provide a reference for effective clinical application.
-
Key words:
- Berberine /
- Liver Diseases /
- Therapeutics
-
[1] HU CY, MO ZX. Research progress on pharmacological actions and mechanism of berberine[J]. China Ind Econ, 2017, 23( 20): 213- 219. DOI: 10.13422/j.cnki.syfjx.2017200213.胡诚毅, 莫志贤. 黄连素的药理作用及机制研究进展[J]. 中国实验方剂学杂志, 2017, 23( 20): 213- 219. DOI: 10.13422/j.cnki.syfjx.2017200213. [2] WONGBUTDEE J. Physiological effects of berberine[J]. Thai Pharm Health Sci J, 2008( 4): 78- 83. [3] YAO J, KONG WJ, JIANG JD. Learning from berberine: Treating chronic diseases through multiple targets[J]. Sci China Life Sci, 2015, 58( 9): 854- 859. DOI: 10.1007/s11427-013-4568-z. [4] SHEN QM. Physiological function of liver[J]. Liver Dr, 2022( 4): 35- 37.沈启明. 肝脏的生理功能[J]. 肝博士, 2022( 4): 35- 37. [5] ZHOU MT, DENG Y, LIU MC, et al. The pharmacological activity of berberine, a review for liver protection[J]. Eur J Pharmacol, 2021, 890: 173655. DOI: 10.1016/j.ejphar.2020.173655. [6] LAN SH, TANG QY, LI NN, et al. Mechanism of action of Xiaochaihu Decoction in the treatment of hepatitis B based on network pharmacology[J]. J Clin Hepatol, 2021, 37( 10): 2308- 2315. DOI: 10.3969/j.issn.1001-5256.2021.10.010.蓝绍航, 唐秋媛, 李娜娜, 等. 基于网络药理学研究小柴胡汤治疗乙型肝炎的作用机制[J]. 临床肝胆病杂志, 2021, 37( 10): 2308- 2315. DOI: 10.3969/j.issn.1001-5256.2021.10.010. [7] GUO WZ, KANG Z. Old drugs and new drugs are used to treat viral hepatitis[J]. Int Med Health Guid Issues, 2005, 11( 12): 87- 88. DOI: 10.3760/cma.j.issn.1007-1245.2005.12.049.郭文征, 康庄. 老药新用治疗病毒性肝炎[J]. 国际医药卫生导报, 2005, 11( 12): 87- 88. DOI: 10.3760/cma.j.issn.1007-1245.2005.12.049. [8] LI F, LI B, ZHU QY. Research progress on the epidemiological characteristics and diagnosis of hepatitis C in China[J]. Int J Virol, 2023, 30( 6): 509- 511. DOI: 10.3760/cma.j.issn.1673-4092.2023.06.014.黎锋, 李博, 朱秋映. 中国丙肝流行特征与诊断研究进展[J]. 国际病毒学杂志, 2023, 30( 6): 509- 511. DOI: 10.3760/cma.j.issn.1673-4092.2023.06.014. [9] HUNG TC, JASSEY A, LIU CH, et al. Berberine inhibits hepatitis C virus entry by targeting the viral E2 glycoprotein[J]. Phytomedicine, 2019, 53: 62- 69. DOI: 10.1016/j.phymed.2018.09.025. [10] WANG YY, ZHOU L, LI YN, et al. The effects of berberine on concanavalin A-induced autoimmune hepatitis(AIH) in mice and the adenosine 5'-monophosphate(AMP)-activated protein kinase(AMPK) pathway[J]. Med Sci Monit, 2017, 23: 6150- 6161. DOI: 10.12659/msm.907377. [11] KOWDLEY KV, FORMAN L, EKSTEEN B, et al. A randomized, dose-finding, proof-of-concept study of berberine ursodeoxycholate in patients with primary sclerosing cholangitis[J]. Am J Gastroenterol, 2022, 117( 11): 1805- 1815. DOI: 10.14309/ajg.0000000000001956. [12] PHOGAT A, SINGH J, KUMAR V, et al. Berberine mitigates acetamiprid-induced hepatotoxicity and inflammation via regulating endogenous antioxidants and NF-κB/TNF-α signaling in rats[J]. Environ Sci Pollut Res Int, 2023, 30( 37): 87412- 87423. DOI: 10.1007/s11356-023-28279-1. [13] MAHMOUD AM, HOZAYEN WG, RAMADAN SM. Berberine ameliorates methotrexate-induced liver injury by activating Nrf2/HO-1 pathway and PPARγ, and suppressing oxidative stress and apoptosis in rats[J]. Biomed Pharmacother, 2017, 94: 280- 291. DOI: 10.1016/j.biopha.2017.07.101. [14] KOPERSKA A, WESOŁEK A, MOSZAK M, et al. Berberine in non-alcoholic fatty liver disease-a review[J]. Nutrients, 2022, 14( 17): 3459. DOI: 10.3390/nu14173459. [15] WANG CE, XU WT, GONG J, et al. Research progress in the treatment of nonalcoholic fatty liver disease[J]. Clin J Med Offic, 2022, 50( 9): 897- 899, 903. DOI: 10.16680/j.1671-3826.2022.09.06.王彩娥, 许文涛, 宫建, 等. 非酒精性脂肪性肝病治疗研究进展[J]. 临床军医杂志, 2022, 50( 9): 897- 899, 903. DOI: 10.16680/j.1671-3826.2022.09.06. [16] ZHU XP, BIAN H, WANG L, et al. Berberine attenuates nonalcoholic hepatic steatosis through the AMPK-SREBP-1c-SCD1 pathway[J]. Free Radic Biol Med, 2019, 141: 192- 204. DOI: 10.1016/j.freeradbiomed.2019.06.019. [17] WANG P, LI RK, LI YQ, et al. Berberine alleviates non-alcoholic hepatic steatosis partially by promoting SIRT1 deacetylation of CPT1A in mice[J]. Gastroenterol Rep, 2023, 11: goad032. DOI: 10.1093/gastro/goad032. [18] SUN YX, XIA MF, YAN HM, et al. Berberine attenuates hepatic steatosis and enhances energy expenditure in mice by inducing autophagy and fibroblast growth factor 21[J]. Br J Pharmacol, 2018, 175( 2): 374- 387. DOI: 10.1111/bph.14079. [19] ZHU L, XU JJ, LI HD, et al. Berberine ameliorates abnormal lipid metabolism via the adenosine monophosphate-activated protein kinase/sirtuin 1 pathway in alcohol-related liver disease[J]. Lab Invest, 2023, 103( 4): 100041. DOI: 10.1016/j.labinv.2022.100041. [20] CHEN Y, LI Q, ZHAO SW, et al. Berberine protects mice against type 2 diabetes by promoting PPARγ-FGF21-GLUT2-regulated insulin sensitivity and glucose/lipid homeostasis[J]. Biochem Pharmacol, 2023, 218: 115928. DOI: 10.1016/j.bcp.2023.115928. [21] KHATER SI, ALMANAA TN, FATTAH DMA, et al. Liposome-encapsulated berberine alleviates liver injury in type 2 diabetes via promoting AMPK/mTOR-mediated autophagy and reducing ER stress: Morphometric and immunohistochemical scoring[J]. Antioxidants, 2023, 12( 6): 1220. DOI: 10.3390/antiox12061220. [22] CAI YJ, YANG QN, YU YQ, et al. Efficacy and underlying mechanisms of berberine against lipid metabolic diseases: A review[J]. Front Pharmacol, 2023, 14: 1283784. DOI: 10.3389/fphar.2023.1283784. [23] YUAN XL, WANG J, TANG XY, et al. Berberine ameliorates nonalcoholic fatty liver disease by a global modulation of hepatic mRNA and lncRNA expression profiles[J]. J Transl Med, 2015, 13: 24. DOI: 10.1186/s12967-015-0383-6. [24] DAI L, LU S, SHEN TB, et al. Methyltransferase SETD2 mediates hepatoprotection of berberine against steatosis[J]. Ann Transl Med, 2022, 10( 10): 552. DOI: 10.21037/atm-22-1753. [25] YANG FJ, GAO RM, LUO XX, et al. Berberine influences multiple diseases by modifying gut microbiota[J]. Front Nutr, 2023, 10: 1187718. DOI: 10.3389/fnut.2023.1187718. [26] ZHANG YY, YAN JJ, ZHANG P, et al. Berberine maintains gut microbiota homeostasis and ameliorates liver inflammation in experimental non-alcoholic fatty liver disease[J]. Chin J Gastroenterol, 2018, 23( 4): 209- 215. DOI: 10.3969/j.issn.1008-7125.2018.04.004.张园园, 严君君, 张培, 等. 黄连素调节肠道菌群减轻非酒精性脂肪性肝病肝脏炎症的实验研究[J]. 胃肠病学, 2018, 23( 4): 209- 215. DOI: 10.3969/j.issn.1008-7125.2018.04.004. [27] GUO HH, SHEN HR, WANG LL, et al. Berberine is a potential alternative for metformin with good regulatory effect on lipids in treating metabolic diseases[J]. Biomed Pharmacother, 2023, 163: 114754. DOI: 10.1016/j.biopha.2023.114754. [28] WANG C, YANG YT, CHEN JY, et al. Berberine protects against high-energy and low-protein diet-induced hepatic steatosis: Modulation of gut microbiota and bile acid metabolism in laying hens[J]. Int J Mol Sci, 2023, 24( 24): 17304. DOI: 10.3390/ijms242417304. [29] YI JZ, WU SY, TAN SW, et al. Berberine alleviates liver fibrosis through inducing ferrous redox to activate ROS-mediated hepatic stellate cells ferroptosis[J]. Cell Death Discov, 2021, 7( 1): 374. DOI: 10.1038/s41420-021-00768-7. [30] LI J, PAN Y, KAN MJ, et al. Hepatoprotective effects of berberine on liver fibrosis via activation of AMP-activated protein kinase[J]. Life Sci, 2014, 98( 1): 24- 30. DOI: 10.1016/j.lfs.2013.12.211. [31] LIU XZ, WANG LF, TAN SW, et al. Therapeutic effects of berberine on liver fibrosis are associated with lipid metabolism and intestinal flora[J]. Front Pharmacol, 2022, 13: 814871. DOI: 10.3389/fphar.2022.814871. [32] XIE ZP, ZHOU Y, LIN M, et al. Binding of berberine to PEBP1 synergizes with sorafenib to induce the ferroptosis of hepatic stellate cells[J]. Amino Acids, 2023, 55( 12): 1867- 1878. DOI: 10.1007/s00726-023-03345-7. [33] DOU Q, LI Y, WANG YY, et al. Effect of berberine on protecting liver function and inhibiting inflammation in cirrhotic rats[j]. J Guangzhou Univ Tradit Chin Med, 2021, 38( 12): 2708- 2715. DOI: 10.13359/j.cnki.gzxbtcm.2021.12.027.窦芊, 李赢, 王园园, 等. 小檗碱对肝硬化大鼠肝功能的保护及炎症抑制作用[J]. 广州中医药大学学报, 2021, 38( 12): 2708- 2715. DOI: 10.13359/j.cnki.gzxbtcm.2021.12.027. [34] WANG N, FENG YB, ZHU MF, et al. Berberine induces autophagic cell death and mitochondrial apoptosis in liver cancer cells: The cellular mechanism[J]. J Cell Biochem, 2010, 111( 6): 1426- 1436. DOI: 10.1002/jcb.22869. [35] REN G, GUO JH, FENG CL, et al. Berberine inhibits carcinogenesis through antagonizing the ATX-LPA-LPAR2-p38-leptin axis in a mouse hepatoma model[J]. Mol Ther Oncolytics, 2022, 26: 372- 386. DOI: 10.1016/j.omto.2022.08.001. [36] GUO W, TAN HY, LI S, et al. Glutamic-pyruvic transaminase 1 facilitates alternative fuels for hepatocellular carcinoma growth-a small molecule inhibitor, berberine[J]. Cancers, 2020, 12( 7): 1854. DOI: 10.3390/cancers12071854. [37] ZHENG HL. Inhibitory effect of berberine on hepatocellular carcinoma metastasis and its mechanism by suppressing the‘phoenix rising’pathway[D]. Changchun: Jilin University, 2016.郑慧琳. 黄连素对“凤凰涅槃”信号通路引起肝癌转移的抑制作用及机制探讨[D]. 长春: 吉林大学, 2016. [38] DU HY, GU JY, PENG Q, et al. Berberine suppresses EMT in liver and gastric carcinoma cells through combination with TGFβR regulating TGF-β/smad pathway[J]. Oxid Med Cell Longev, 2021, 2021: 2337818. DOI: 10.1155/2021/2337818. [39] SHOU JW, SHAW PC. Berberine activates PPARδ and promotes gut microbiota-derived butyric acid to suppress hepatocellular carcinoma[J]. Phytomedicine, 2023, 115: 154842. DOI: 10.1016/j.phymed.2023.154842. [40] LIN YB, SHENG MW, WENG YQ, et al. Berberine protects against ischemia/reperfusion injury after orthotopic liver transplantation via activating Sirt1/FoxO3α induced autophagy[J]. Biochem Biophys Res Commun, 2017, 483( 2): 885- 891. DOI: 10.1016/j.bbrc.2017.01.028. [41] GENDY AM, ELNAGAR MR, ALLAM MM, et al. Berberine-loaded nanostructured lipid carriers mitigate warm hepatic ischemia/reperfusion-induced lesion through modulation of HMGB1/TLR4/NF-κB signaling and autophagy[J]. Biomed Pharmacother, 2022, 145: 112122. DOI: 10.1016/j.biopha.2021.112122. [42] SHENG M, ZHOU Y, YU W, et al. Protective effect of Berberine pretreatment in hepatic ischemia/reperfusion injury of rat[J]. Transplant Proc, 2015, 47( 2): 275- 282. DOI: 10.1016/j.transproceed.2015.01.010. -



 PDF下载 ( 972 KB)
PDF下载 ( 972 KB)

 下载:
下载:


