自噬介导肝细胞癌耐药的相关机制
DOI: 10.12449/JCH241128
-
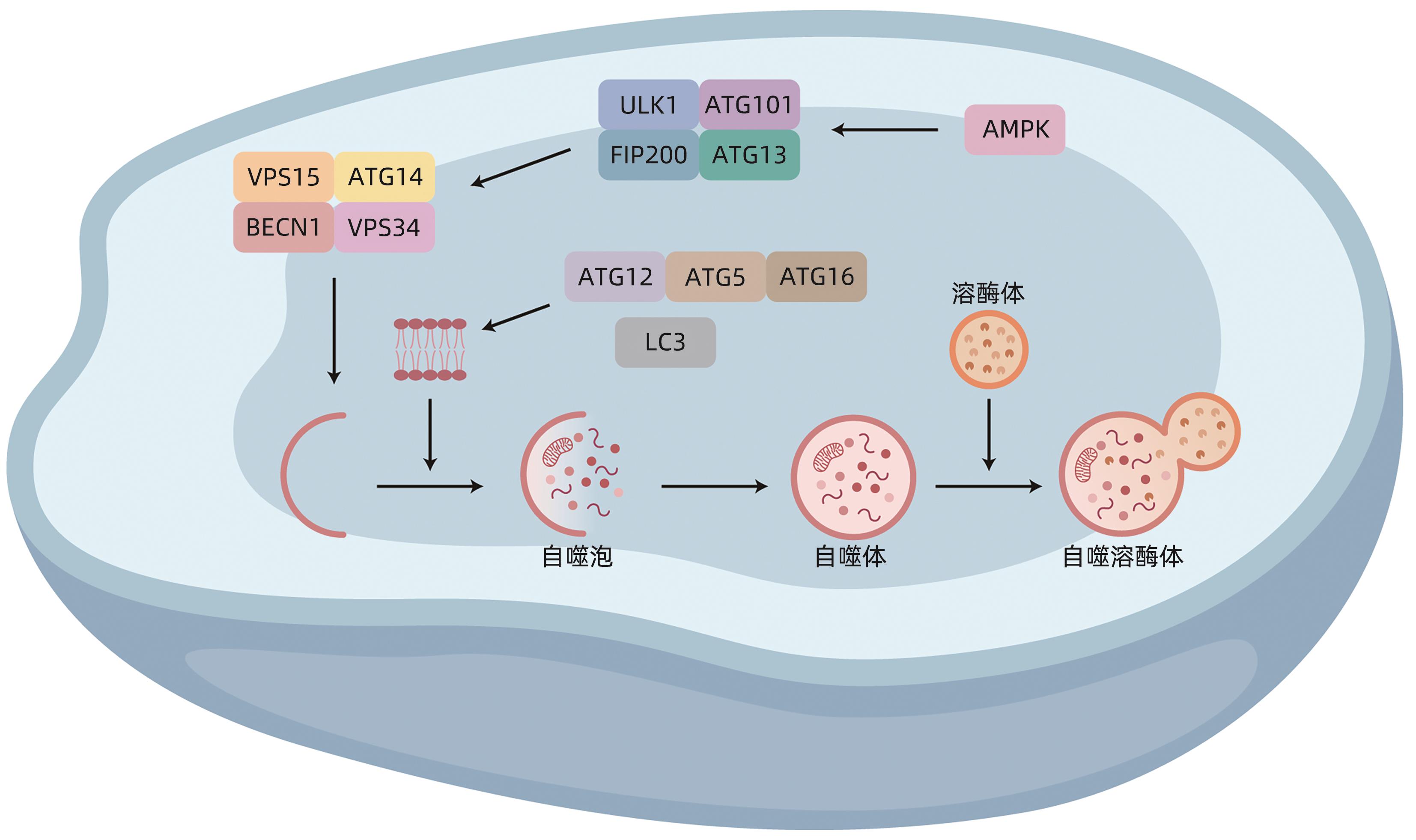
摘要: 肝细胞癌(HCC)治疗抵抗是制约其疗效的重要因素。自噬是一种多步骤、多靶点的过程,与肿瘤细胞的增殖和凋亡密切相关。同时,自噬与肿瘤治疗抗性之间也存在显著串扰。因此,自噬可能是肿瘤细胞在临床干预后阻碍细胞死亡的关键因素之一。转化生长因子-β、上皮间充质转化、长链非编码RNA是导致HCC耐药的重要因素。本文从转化生长因子-β、上皮间充质转化及长链非编码RNA这三个角度,探讨其介导复杂的分子网络诱导自噬的发生而影响HCC耐药性的可能机制,为提高HCC治疗敏感性探索新的思路。Abstract: Treatment resistance of hepatocellular carcinoma (HCC) is an important factor restricting its treatment outcome. Autophagy is a process involving multiple steps and targets and is closely associated with the proliferation and apoptosis of tumor cells. At the same time, there is significant crosstalk between autophagy and tumor treatment resistance. Therefore, autophagy may be one of the key factors hindering tumor cell death after medical intervention. Transforming growth factor-β (TGF-β), epithelial-mesenchymal transition (EMT), and long non-coding RNA (lncRNA) are important factors leading to drug resistance of HCC. This article discusses the possible mechanism of TGF-β, EMT, and lncRNA mediating complex molecular networks and inducing drug resistance of HCC, in order to provide new ideas for improving the sensitivity of HCC treatment.
-
Key words:
- Carcinoma, Hepatocellular /
- Autophagy /
- Drug Resistance, Neoplasm
-
表 1 自噬和 HCC 耐药中的lncRNA
Table 1. lncRNA in autophagy and HCC resistance
lncRNA 自噬蛋白 细胞 药物 表达状态 主要观点 参考文献 KCNQ1OT1 BECN1 SK-HEP-1
SK-HEP-1/DDP(耐药细胞)
顺铂 在HCC细胞中表达上调 KCNQ1OT1靶向miR-338-3p,抑制SK-HEP-1/DDP细胞的自噬,提高SK-HEP-1/DDP细胞对顺铂的敏感性 [35] NEAT1 LC3
ATG3
Huh7
HepG2
索拉非尼 在HCC细胞中表达上调 NEAT1通过调节miR-204/ATG3通路促进HCC细胞的自噬,增强HCC对索拉非尼的耐药性 [36] SNGH16 LC3 Hep3B
Hep3B/So(耐药细胞)
索拉非尼 在HCC细胞中表达上调 SNGH16通过下调miR-23b-3p的表达,促进HCC细胞自噬,增加其对索拉非尼的耐药性 [37] CRNDE ATG4B SMMC-7721
HepG2
Hep3B
Huh7
索拉非尼 在HCC组织及细胞中表达上调 lncRNA CRNDE通过促进ATG4B的表达介导自噬,增加HCC细胞对索拉非尼的耐药性 [38] SNHG1 LC3
BECN1
SR-HCC 索拉非尼 在HCC细胞中表达上调 SNHG1通过上调SLC3A2激活Akt通路,诱导自噬发生,使 HCC对索拉非尼耐药 [39] HULC LC3
P62
Hep3B
Huh7
奥沙利铂 在HCC组织及细胞中表达上调 HULC通过调节miR-383-5p/VAMP2轴促进HCC发自噬并减弱HCC对奥沙利铂的化疗敏感性 [40] BBOX1-AS1 LC3 Hep3B
Huh7
索拉非尼 在HCC组织及细胞中表达上调 BBOX1-AS1通过调节miR-361-3p/PHF8轴促进细胞自噬,降低索拉非尼在HCC细胞中的细胞毒性 [41] HOTAIRM1 BECN1 Huh7
HepG2
仑伐替尼 在HCC组织及细胞中表达上调 HOTAIRM1下调miR-34a激活细胞自噬,诱导HCC对仑伐替尼产生耐药性 [42] 注:KCNQ1OT1,KCNQ1重叠转录物1;NEAT1,核富集丰富的转录本1;SNGH16,小核仁RNA宿主基因16;CRNDE,结直肠肿瘤差异表达;SNHG1,小核仁RNA宿主基因1;HULC,肝细胞癌上调长链非编码RNA;BBOX1-AS1,γ-丁酰甜菜碱羟化酶1反义RNA 1;HOTAIRM1,HOXA转录本反义RNA1。
-
[1] TOH MR, WONG EYT, WONG SH, et al. Global epidemiology and genetics of hepatocellular carcinoma[J]. Gastroenterology, 2023, 164( 5): 766- 782. DOI: 10.1053/j.gastro.2023.01.033. [2] LIU QG, SONG T, WANG HH. Re-understanding of surgical resection techniques for liver cancer[J]. Chin J Dig Surg, 2024, 23( 1): 75- 79. DOI: 10.3760/cma.j.cn115610-20231214-00253.刘青光, 宋涛, 王欢欢. 肝癌外科手术切除技术的再认识[J]. 中华消化外科杂志, 2024, 23( 1): 75- 79. DOI: 10.3760/cma.j.cn115610-20231214-00253. [3] Chinese College of Transplant Doctors, Liver Transplantation Group, Chinese Society of Organ Transplantation, Chinese Medical Association. Chinese clinical practice guidelines on liver transplantation for hepatocellular carcinoma(2021 edition)[J]. Chin J Dig Surg, 2022, 21( 4): 433- 443. DOI: 10.3760/cma.j.cn115610-20220316-00135.中国医师协会器官移植医师分会, 中华医学会器官移植学分会肝移植学组. 中国肝癌肝移植临床实践指南(2021版)[J]. 中华消化外科杂志, 2022, 21( 4): 433- 443. DOI: 10.3760/cma.j.cn115610-20220316-00135. [4] KUDO M, FINN RS, QIN SK, et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: A randomised phase 3 non-inferiority trial[J]. Lancet, 2018, 391( 10126): 1163- 1173. DOI: 10.1016/S0140-6736(18)30207-1. [5] HU X, WEN L, LI XF, et al. Relationship between autophagy and drug resistance in tumors[J]. Mini Rev Med Chem, 2023, 23( 10): 1072- 1078. DOI: 10.2174/1389557522666220905090732. [6] CAO WY, LI JH, YANG KP, et al. An overview of autophagy: Mechanism, regulation and research progress[J]. Bull Cancer, 2021, 108( 3): 304- 322. DOI: 10.1016/j.bulcan.2020.11.004. [7] KLIONSKY DJ, PETRONI G, AMARAVADI RK, et al. Autophagy in major human diseases[J]. EMBO J, 2021, 40( 19): e108863. DOI: 10.15252/embj.2021108863. [8] DEBNATH J, GAMMOH N, RYAN KM. Autophagy and autophagy-related pathways in cancer[J]. Nat Rev Mol Cell Biol, 2023, 24( 8): 560- 575. DOI: 10.1038/s41580-023-00585-z. [9] JIANG B, CUI YY, MA XX, et al. Crosstalk between autophagy inhibitor and salidroside-induced apoptosis: A novel strategy for autophagy-based treatment of hepatocellular cancer[J]. Int Immunopharmacol, 2023, 124( Pt B): 111040. DOI: 10.1016/j.intimp.2023.111040. [10] WANG CZ, YAN GX, DONG DS, et al. LncRNA-ATB promotes autophagy by activating Yes-associated protein and inducing autophagy-related protein 5 expression in hepatocellular carcinoma[J]. World J Gastroenterol, 2019, 25( 35): 5310- 5322. DOI: 10.3748/wjg.v25.i35.5310. [11] HUO XX, QI J, HUANG KQ, et al. Identification of an autophagy-related gene signature that can improve prognosis of hepatocellular carcinoma patients[J]. BMC Cancer, 2020, 20( 1): 771. DOI: 10.1186/s12885-020-07277-3. [12] LIN ZY, NIU Y, WAN A, et al. RNA m6 A methylation regulates sorafenib resistance in liver cancer through FOXO3- mediated autophagy[J]. EMBO J, 2020, 39( 12): e103181. DOI: 10.15252/embj.2019103181. [13] PAN JM, ZHANG M, DONG LQ, et al. Genome-Scale CRISPR screen identifies LAPTM5 driving lenvatinib resistance in hepatocellular carcinoma[J]. Autophagy, 2023, 19( 4): 1184- 1198. DOI: 10.1080/15548627.2022.2117893. [14] ASHRAFIZADEH M, MIRZAEI S, HASHEMI F, et al. New insight towards development of paclitaxel and docetaxel resistance in cancer cells: EMT as a novel molecular mechanism and therapeutic possibilities[J]. Biomedecine Pharmacother, 2021, 141: 111824. DOI: 10.1016/j.biopha.2021.111824. [15] HASHEMI M, SABOUNI E, RAHMANIAN P, et al. Deciphering STAT3 signaling potential in hepatocellular carcinoma: Tumorigenesis, treatment resistance, and pharmacological significance[J]. Cell Mol Biol Lett, 2023, 28( 1): 33. DOI: 10.1186/s11658-023-00438-9. [16] HU B, CHENG JW, HU JW, et al. KPNA3 confers sorafenib resistance to advanced hepatocellular carcinoma via TWIST regulated epithelial-mesenchymal transition[J]. J Cancer, 2019, 10( 17): 3914- 3925. DOI: 10.7150/jca.31448. [17] LIN Y. Molecular mechanism of RBM8A mediated epithelial interstitial transformation regulating oxaliplatin resistance in hepatocellular carcinoma[D]. Nanning: Guangxi Medical University, 2019.林燕. RBM8A介导上皮间质转化调控肝细胞癌对奥沙利铂耐药的分子机制研究[D]. 南宁: 广西医科大学, 2019. [18] HUANG YH, HONG WQ, WEI XW. The molecular mechanisms and therapeutic strategies of EMT in tumor progression and metastasis[J]. J Hematol Oncol, 2022, 15( 1): 129. DOI: 10.1186/s13045-022-01347-8. [19] PAN GT, LIU YH, SHANG LR, et al. EMT-associated microRNAs and their roles in cancer stemness and drug resistance[J]. Cancer Commun, 2021, 41( 3): 199- 217. DOI: 10.1002/cac2.12138. [20] SHRESTHA R, BRIDLE KR, CAO L, et al. Dual targeting of sorafenib-resistant HCC-derived cancer stem cells[J]. Curr Oncol, 2021, 28( 3): 2150- 2172. DOI: 10.3390/curroncol28030200. [21] HU SB, WANG LY, ZHANG X, et al. Autophagy induces transforming growth factor-β-dependent epithelial-mesenchymal transition in hepatocarcinoma cells through cAMP response element binding signalling[J]. J Cell Mol Med, 2018, 22( 11): 5518- 5532. DOI: 10.1111/jcmm.13825. [22] SU GY, FENG T, PEI T, et al. Autophagy modulates FSS-induced epithelial-mesenchymal transition in hepatocellular carcinoma cells[J]. Mol Carcinog, 2021, 60( 9): 607- 619. DOI: 10.1002/mc.23327. [23] ZHAO HJ, LIU HY, YANG YH, et al. The emerging role of EVA1A in different types of cancers[J]. Int J Mol Sci, 2022, 23( 12): 6665. DOI: 10.3390/ijms23126665. [24] UNGEFROREN H. Autocrine TGF-β in cancer: Review of the literature and caveats in experimental analysis[J]. Int J Mol Sci, 2021, 22( 2): 977. DOI: 10.3390/ijms22020977. [25] YAN C, YANG QQ, SHEN HM, et al. Chronically high level of tgfb1a induction causes both hepatocellular carcinoma and cholangiocarcinoma via a dominant Erk pathway in zebrafish[J]. Oncotarget, 2017, 8( 44): 77096- 77109. DOI: 10.18632/oncotarget.20357. [26] MARTIN CJ, DATTA A, LITTLEFIELD C, et al. Selective inhibition of TGFβ1 activation overcomes primary resistance to checkpoint blockade therapy by altering tumor immune landscape[J]. Sci Transl Med, 2020, 12( 536): eaay8456. DOI: 10.1126/scitranslmed.aay8456. [27] MARIN JJG, MACIAS RIR, MONTE MJ, et al. Molecular bases of drug resistance in hepatocellular carcinoma[J]. Cancers, 2020, 12( 6): 1663. DOI: 10.3390/cancers12061663. [28] KARABICICI M, AZBAZDAR Y, OZHAN G, et al. Changes in Wnt and TGF-β signaling mediate the development of regorafenib resistance in hepatocellular carcinoma cell line HuH7[J]. Front Cell Dev Biol, 2021, 9: 639779. DOI: 10.3389/fcell.2021.639779. [29] SHRESTHA R, PRITHVIRAJ P, BRIDLE KR, et al. Combined inhibition of TGF-β1-induced EMT and PD-L1 silencing re-sensitizes hepatocellular carcinoma to sorafenib treatment[J]. J Clin Med, 2021, 10( 9): 1889. DOI: 10.3390/jcm10091889. [30] GIANSANTI M, THEINERT T, BOEING SK, et al. Exploiting autophagy balance in T and NK cells as a new strategy to implement adoptive cell therapies[J]. Mol Cancer, 2023, 22( 1): 201. DOI: 10.1186/s12943-023-01893-w. [31] ZHANG KG, ZHANG MP, LUO ZJ, et al. The dichotomous role of TGF-β in controlling liver cancer cell survival and proliferation[J]. J Genet Genom, 2020, 47( 9): 497- 512. DOI: 10.1016/j.jgg.2020.09.005. [32] TAUCHER E, MYKOLIUK I, FEDIUK M, et al. Autophagy, oxidative stress and cancer development[J]. Cancers(Basel), 2022, 14( 7): 1637. DOI: 10.3390/cancers14071637. [33] VERMA S, SAHU BD, MUGALE MN. Role of lncRNAs in hepatocellular carcinoma[J]. Life Sci, 2023, 325: 121751. DOI: 10.1016/j.lfs.2023.121751. [34] YIN QS, HUANG XL, YANG QX, et al. LncRNA model predicts liver cancer drug resistance and validate in vitro experiments[J]. Front Cell Dev Biol, 2023, 11: 1174183. DOI: 10.3389/fcell.2023.1174183. [35] ZHONG WW, DAI QQ, HUANG QH. Effect of lncRNA KCNQ1OT1 on autophagy and drug resistance of hepatocellular carcinoma cells by targeting miR-338-3p[J]. Cell Mol Biol(Noisy-le-grand), 2020, 66( 3): 191- 196. [36] LI XY, ZHOU Y, YANG L, et al. LncRNA NEAT1 promotes autophagy via regulating miR-204/ATG3 and enhanced cell resistance to sorafenib in hepatocellular carcinoma[J]. J Cell Physiol, 2020, 235( 4): 3402- 3413. DOI: 10.1002/jcp.29230. [37] CHEN LX, SUN LB, DAI XF, et al. LncRNA CRNDE promotes ATG4B-mediated autophagy and alleviates the sensitivity of sorafenib in hepatocellular carcinoma cells[J]. Front Cell Dev Biol, 2021, 9: 687524. DOI: 10.3389/fcell.2021.687524. [38] JING Z, YE XP, MA XJ, et al. SNGH16 regulates cell autophagy to promote Sorafenib Resistance through suppressing miR-23b-3p via sponging EGR1 in hepatocellular carcinoma[J]. Cancer Med, 2020, 9( 12): 4324- 4338. DOI: 10.1002/cam4.3020. [39] LI WD, DONG XS, HE CJ, et al. Correction to: LncRNA SNHG1 contributes to sorafenib resistance by activating the Akt pathway and is positively regulated by miR-21 in hepatocellular carcinoma cells[J]. J Exp Clin Cancer Res, 2021, 40( 1): 377. DOI: 10.1186/s13046-021-02183-3. [40] LI P, LI YW, MA LT. Long noncoding RNA highly upregulated in liver cancer promotes the progression of hepatocellular carcinoma and attenuates the chemosensitivity of oxaliplatin by regulating miR-383-5p/vesicle-associated membrane protein-2 axis[J]. Pharmacol Res Perspect, 2021, 9( 4): e00815. DOI: 10.1002/prp2.815. [41] TAO HS, ZHANG YX, LI J, et al. Oncogenic lncRNA BBOX1-AS1 promotes PHF8-mediated autophagy and elicits sorafenib resistance in hepatocellular carcinoma[J]. Mol Ther Oncolytics, 2022, 28: 88- 103. DOI: 10.1016/j.omto.2022.12.005. [42] GU DY, TONG M, WANG J, et al. Overexpression of the lncRNA HOTAIRM1 promotes lenvatinib resistance by downregulating miR-34a and activating autophagy in hepatocellular carcinoma[J]. Discov Oncol, 2023, 14( 1): 66. DOI: 10.1007/s12672-023-00673-8. -



 PDF下载 ( 866 KB)
PDF下载 ( 866 KB)

 下载:
下载:


