经窦道Foley导尿管治疗胰十二指肠切除术后复杂胰瘘伴静脉大出血1例报告
DOI: 10.12449/JCH241123
伦理学声明:本例报告已获得患者家属知情同意。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:付裕负责课题设计,资料采集与分析,查阅文献,撰写论文;王洋、韩万斌参与收集数据,修改论文;周荣幸负责拟定写作思路,指导撰写文章并最后定稿。
Clinical effect of Foley catheter through sinus tract in treatment of complex pancreatic fistula with massive venous hemorrhage after pancreaticoduodenectomy: A case report
-
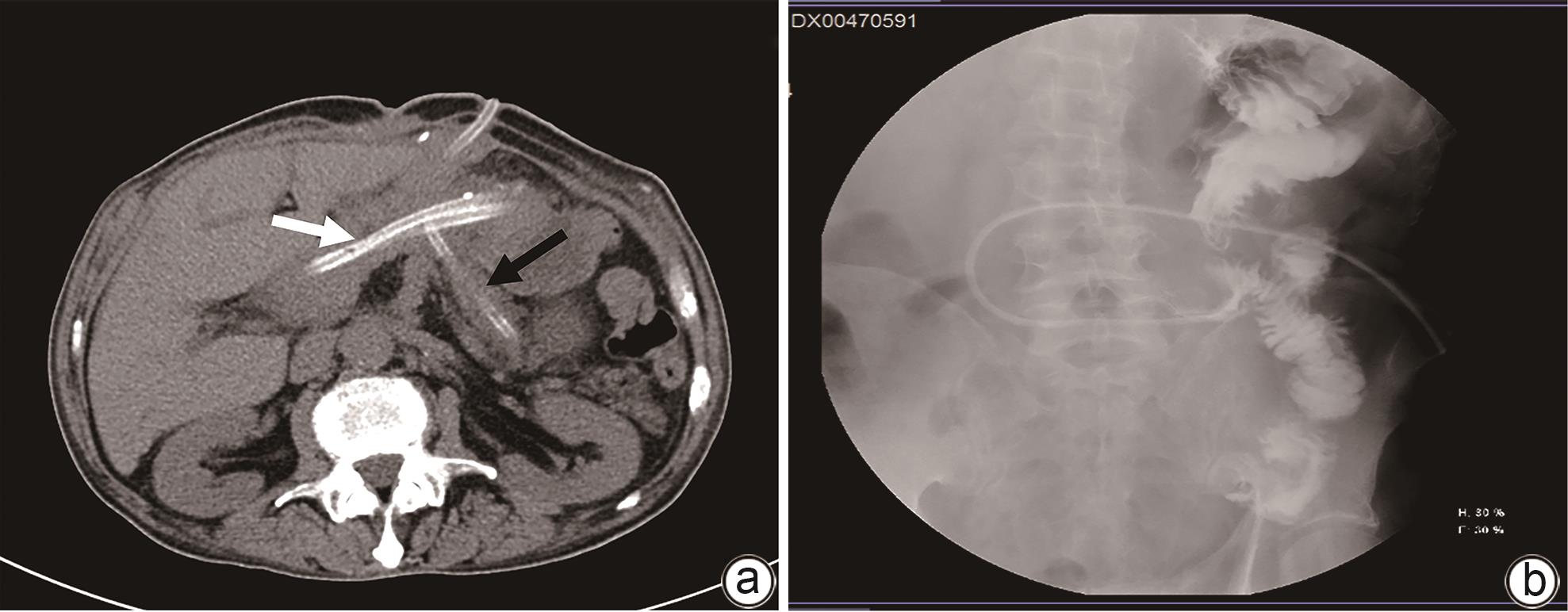
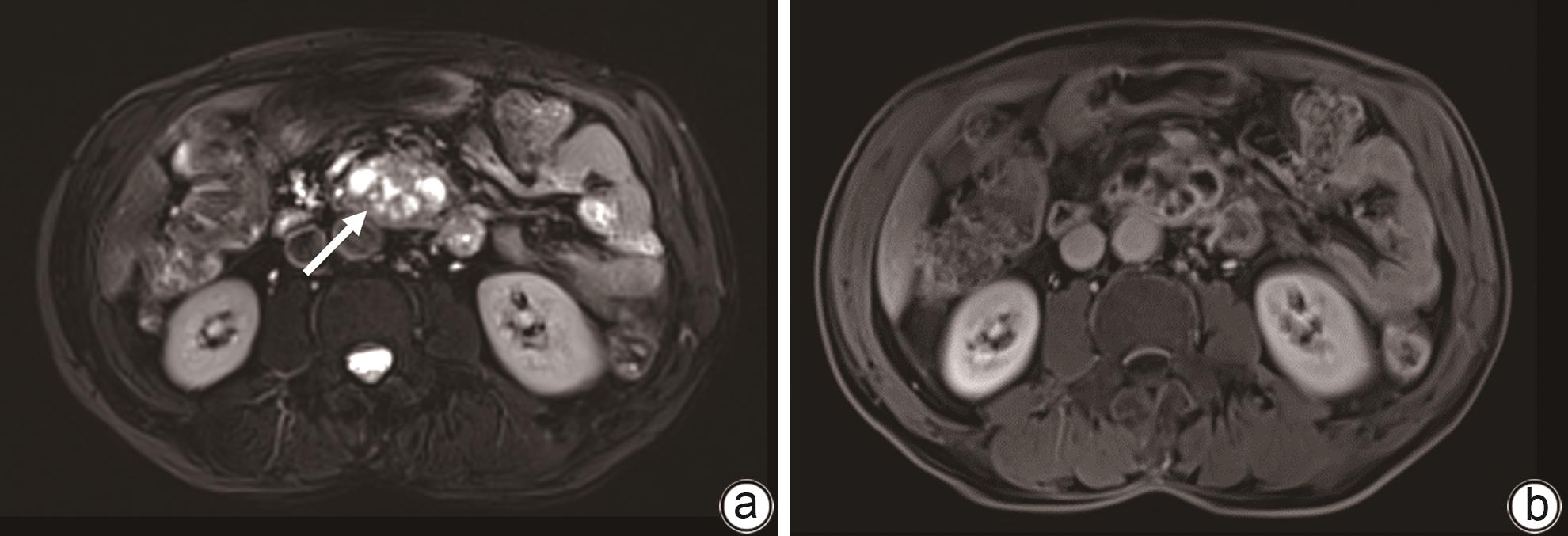
摘要: 目前,对于胰十二指肠切除术后胰瘘伴出血的治疗,血管介入和手术是主要的治疗手段,但以上治疗方法都存在一定的弊端,例如手术后出现再次胰瘘、出血、腹腔感染等并发症,介入治疗难以发现出血部位等。本文报道1例经引流管窦道置入Foley导尿管球囊压迫治疗胰十二指肠切除术后复杂性胰瘘伴静脉大出血患者。经导尿管球囊加压止血及有效引流,患者出血停止,消化道瘘痊愈,无胰腺假性囊肿、肠缺血、门静脉高压等并发症。Abstract: At present, vascular intervention and surgery are the main methods for the treatment of pancreatic fistula with bleeding after pancreaticoduodenectomy, but these treatment methods have certain drawbacks, such as the complications of pancreatic fistula, bleeding, and abdominal infection after surgical treatment, and interventional treatment sometimes fails to identify the bleeding site. This article reports a case of complex pancreatic fistula with massive venous hemorrhage after pancreaticoduodenectomy treated with Foley catheter balloon compression through the drainage tube sinus. Bleeding was arrested and gastrointestinal fistula was cured after catheter balloon compression and effective drainage, with no complications such as pancreatic pseudocyst, intestinal ischemia, and portal hypertension.
-
[1] YANG J, HUANG Q, XIE F, et al. Single-center experience analysis of pancreaticoduodenectomy: Report of 543 cases[J]. J Hepatobiliary Surg, 2019, 27( 6): 438- 442. DOI: 10.3969/j.issn.1006-4761.2019.06.012.杨骥, 黄强, 谢放, 等. 单中心胰十二指肠切除术经验分析: 附543例报告[J]. 肝胆外科杂志, 2019, 27( 6): 438- 442. DOI: 10.3969/j.issn.1006-4761.2019.06.012. [2] MIHALJEVIC AL, HACKERT T, LOOS M, et al. Not all Whipple procedures are equal: Proposal for a classification of pancreatoduodenectomies[J]. Surgery, 2021, 169( 6): 1456- 1462. DOI: 10.1016/j.surg.2020.11.030. [3] AOKI S, MIYATA H, KONNO H, et al. Risk factors of serious postoperative complications after pancreaticoduodenectomy and risk calculators for predicting postoperative complications: A nationwide study of 17, 564 patients in Japan[J]. J Hepatobiliary Pancreat Sci, 2017, 24( 5): 243- 251. DOI: 10.1002/jhbp.438. [4] JIANG B, HUANG Q. The clinicalvalue of pancreatic fistula risk scoring system in pancreaticoduodenectomy[J]. Chin J Hepatobiliary Surg, 2019, 25( 9): 668- 671. DOI: 10.3760/cma.j.issn.1007-8118.2019.09.008.江兵, 黄强. 胰瘘风险评分系统在胰十二指肠切除术的应用价值[J]. 中华肝胆外科杂志, 2019, 25( 9): 668- 671. DOI: 10.3760/cma.j.issn.1007-8118.2019.09.008. [5] NAKEEB AE, SULTAN AM, ATEF E, et al. Tailored pancreatic reconstruction after pancreaticoduodenectomy: A single-center experience of 892 cases[J]. Hepatobiliary Pancreat Dis Int, 2017, 16( 5): 528- 536. DOI: 10.1016/S1499-3872(17)60051-1. [6] ZHANG L, ZHANG YL, SHEN L. Effects of intraoperative fluid balance during pancreatoduodenectomy on postoperative pancreatic fistula: An observational cohort study[J]. BMC Surg, 2023, 23( 1): 89. DOI: 10.1186/s12893-023-01978-9. [7] ZHOU LC, TAN Z, TANG YP, et al. Value of pancreatic anatomic structure under standard pancreatic neck transection in predicting pancreatic fistula af-ter pancreaticoduodenectomy[J]. J Clin Hepatol, 2022, 38( 12): 2807- 2813. DOI: 10.3969/j.issn.1001-5256.2022.12.022.周黎晨, 谭震, 唐娅萍, 等. 标准胰颈横断下胰腺断面结构参数对胰十二指肠切除术后胰瘘的预测价值[J]. 临床肝胆病杂志, 2022, 38( 12): 2807- 2813. DOI: 10.3969/j.issn.1001-5256.2022.12.022. [8] LU JW, DING HF, WU XN, et al. Intra-abdominal hemorrhage following 739 consecutive pancreaticoduodenectomy: Risk factors and treatments[J]. J Gastroenterol Hepatol, 2019, 34( 6): 1100- 1107. DOI: 10.1111/jgh.14560. [9] CHEN JF, XU SF, ZHAO W, et al. Diagnostic and therapeutic strategies to manage post-pancreaticoduodenectomy hemorrhage[J]. World J Surg, 2015, 39( 2): 509- 515. DOI: 10.1007/s00268-014-2809-3. [10] WANG WG, FU L, BABU SR, et al. Incidence of and risk factors and reinterventions for post-pancreatoduodenectomy hemorrhage: Retrospective analysis[J]. Dig Surg, 2018, 35( 1): 19- 27. DOI: 10.1159/000460263. [11] GINSBURG M, FERRAL H, ALONZO MJ, et al. Percutaneous transhepatic placement of a stent-graft to treat a delayed mesoportal hemorrhage after pancreaticoduodenectomy[J]. World J Surg Oncol, 2014, 12: 315. DOI: 10.1186/1477-7819-12-315. [12] SUZUKI K, IGAMI T, KOMADA T, et al. Stent-graft treatment for extrahepatic portal vein hemorrhage after pancreaticoduodenectomy[J]. Acta Radiol Open, 2015, 4( 6): 2058460115589338. DOI: 10.1177/2058460115589338. [13] PESCATORI LC, KOBEITER H, ZAAROUR Y, et al. Transhepatic endovascular repair for portal vein haemorrhage[J]. CVIR Endovasc, 2020, 3( 1): 56. DOI: 10.1186/s42155-020-00149-8. [14] WANG DA, LIN C, E CY. Causes, diagnosis and treatment of postoperative pancreatic hemorrhage[J/OL]. Chin J Hepat Surg(Electronic Edition), 2024, 13( 4): 472- 480. DOI: 10.3877/cma.j.issn.2095-3232.2024.04.006.王冬澳, 林超, 鄂长勇. 胰腺术后出血原因及诊治策略[J/OL]. 中华肝脏外科手术学电子杂志, 2024, 13( 4): 472- 480. DOI: 10.3877/cma.j.issn.2095-3232.2024.04.006. [15] WENTE MN, VEIT JA, BASSI C, et al. Postpancreatectomy hemorrhage(PPH): An International Study Group of Pancreatic Surgery(ISGPS) definition[J]. Surgery, 2007, 142( 1): 20- 25. DOI: 10.1016/j.surg.2007.02.001. [16] GAO HQ, LI BY, MA YS, et al. Risk factors analysis and treatment of postpancreaticoduodenectomy hemorrhage[J]. Chin J Dig Surg, 2022, 21( 4): 492- 499. DOI: 10.3760/cma.j.cn115610-20220228-00111.高红桥, 李宝毅, 马永蔌, 等. 胰十二指肠切除术后出血的危险因素分析及治疗策略[J]. 中华消化外科杂志, 2022, 21( 4): 492- 499. DOI: 10.3760/cma.j.cn115610-20220228-00111. [17] FARVACQUE G, GUILBAUD T, LOUNDOU AD, et al. Delayed post-pancreatectomy hemorrhage and bleeding recurrence after percutaneous endovascular treatment: Risk factors from a bi-centric study of 307 consecutive patients[J]. Langenbecks Arch Surg, 2021, 406( 6): 1893- 1902. DOI: 10.1007/s00423-021-02146-4. [18] TANG W, QIU JG, DU CY. Risk factors for post-pancreaticoduodenectomy hemorrhage[J]. Chin J Gen Surg, 2020, 35( 7): 527- 531. DOI: 10.3760/cma.j.cn113855-20191225-00771.唐伟, 邱建国, 杜成友. 胰十二指肠切除术后出血的危险因素分析[J]. 中华普通外科杂志, 2020, 35( 7): 527- 531. DOI: 10.3760/cma.j.cn113855-20191225-00771. [19] FENG J, ZHAO XQ, ZHANG HY, et al. Diagnosis and treatment for severe hemorrhage of portal vein system after pancreaticoduodenectomy[J/OL]. Chin J Hepatic Surg Electron Ed, 2018, 7( 6): 482- 485. DOI: 10.3877/cma.j.issn.2095-3232.2018.06.012.冯健, 赵向前, 张航宇, 等. 胰十二指肠切除术后门静脉系统严重出血诊断与治疗[J/OL]. 中华肝脏外科手术学电子杂志, 2018, 7( 6): 482- 485. DOI: 10.3877/cma.j.issn.2095-3232.2018.06.012. [20] XU YT, LIU J, MENG FY, et al. Abdominal tube drainage with continuous internal irrigation and suction in treatment of pancreatic fistula following pancreaticoduodenectomy[J]. Chin J Hepatobiliary Surg, 2021, 27( 9): 699- 701. DOI: 10.3760/cma.j.cn113884-20210323-00111.徐延田, 刘军, 孟凡迎, 等. 腹腔引流管持续内冲洗负压引流法治疗胰十二指肠切除术后胰瘘[J]. 中华肝胆外科杂志, 2021, 27( 9): 699- 701. DOI: 10.3760/cma.j.cn113884-20210323-00111. [21] LI W, XU ZW. Abdominal dual tube drainage with continuous irrigation in treatment of pancreatic fistula after pancreatoduodenectomy[J]. J Surg Concepts Pract, 2019, 24( 1): 51- 54. DOI: 10.16139/j.1007-9610.2019.01.011.李伟, 许志伟. 腹腔双套管匀速冲洗引流治疗胰十二指肠切除术后胰漏[J]. 外科理论与实践, 2019, 24( 1): 51- 54. DOI: 10.16139/j.1007-9610.2019.01.011. [22] ZHOU TY, SUN JH, ZHANG YL, et al. Post-pancreaticoduodenectomy hemorrhage: DSA diagnosis and endovascular treatment[J]. Oncotarget, 2017, 8( 43): 73684- 73692. DOI: 10.18632/oncotarget.17450. [23] ZHU DW, TAN YH, GU JP, et al. Interventional therapy of late hemorrhage after postpancreatectomy[J]. Chin J Interv Imag Ther, 2020, 17( 9): 543- 547. DOI: 10.13929/j.issn.1672-8475.2020.09.007.朱帝文, 谭永华, 顾俊鹏, 等. 介入治疗胰十二指肠切除术后晚期出血[J]. 中国介入影像与治疗学, 2020, 17( 9): 543- 547. DOI: 10.13929/j.issn.1672-8475.2020.09.007. [24] HABIB JR, GAO SS, YOUNG AJ, et al. Incidence and contemporary management of delayed bleeding following pancreaticoduodenectomy[J]. World J Surg, 2022, 46( 5): 1161- 1171. DOI: 10.1007/s00268-022-06451-x. [25] LIU L, XU ZH, WANG WQ, et al. Prevention and management of pancreatic fistula after pancreatoduodenectomy with precise and comprehensive opinion[J]. Chin J Dig Surg, 2023, 22( 5): 657- 662. DOI: 10.3760/cma.j.cn115610-20230401-00143.刘亮, 徐志航, 王文权, 等. 精准联合综合策略防治胰十二指肠切除术后胰瘘[J]. 中华消化外科杂志, 2023, 22( 5): 657- 662. DOI: 10.3760/cma.j.cn115610-20230401-00143. [26] TASU JP, VESSELLE G, HERPE G, et al. Postoperative abdominal bleeding[J]. Diagn Interv Imaging, 2015, 96( 7-8): 823- 831. DOI: 10.1016/j.diii.2015.03.013. [27] LU YM, GUO YR, ZHOU MY, et al. Indwelling intrauterine Foley balloon catheter for intraoperative and postoperative bleeding in cesarean scar pregnancy[J]. J Minim Invasive Gynecol, 2020, 27( 1): 94- 99. DOI: 10.1016/j.jmig.2019.02.024. [28] ZENG C, YU GD, JIAO CJ. Foley catheter in the treatment of bleeding after adenoidectomy[J]. Chin Arch Otolaryngol Head Neck Surg, 2016, 23( 5): 272. DOI: 10.16066/j.1672-7002.2016.05.008.曾宸, 喻国冻, 焦传家. Foley导尿管治疗腺样体切除术后出血[J]. 中国耳鼻咽喉头颈外科, 2016, 23( 5): 272. DOI: 10.16066/j.1672-7002.2016.05.008. -



 PDF下载 ( 1087 KB)
PDF下载 ( 1087 KB)

 下载:
下载: