芪术方对高脂高果糖高胆固醇诱导的非酒精性脂肪性肝病小鼠模型的影响及其机制
DOI: 10.12449/JCH241113
Effect of Qizhu prescription on a mouse model of non-alcoholic fatty liver disease incluced by high-fat, high-fructose, and high-cholesterol diet and its mechanism
-
摘要:
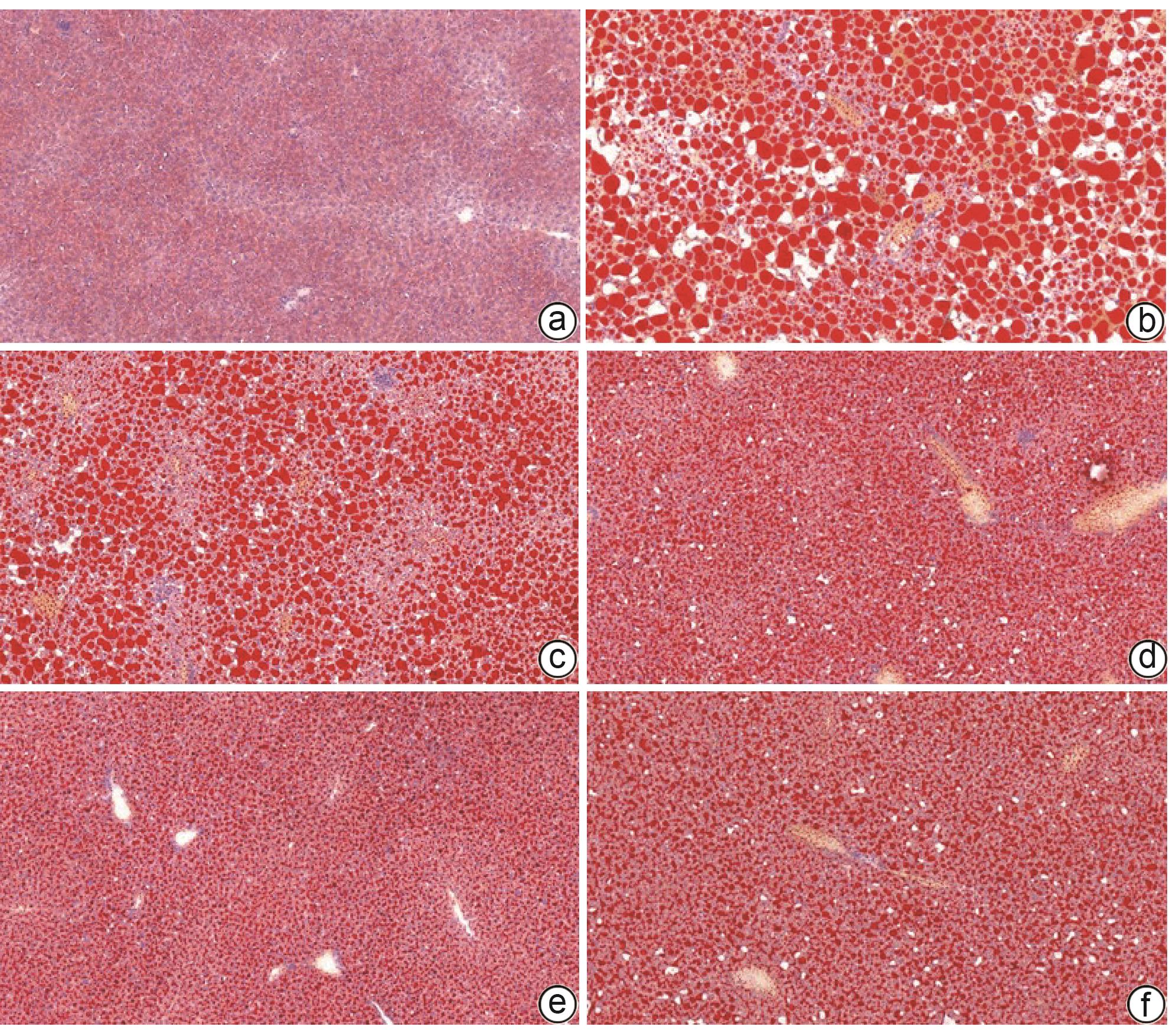
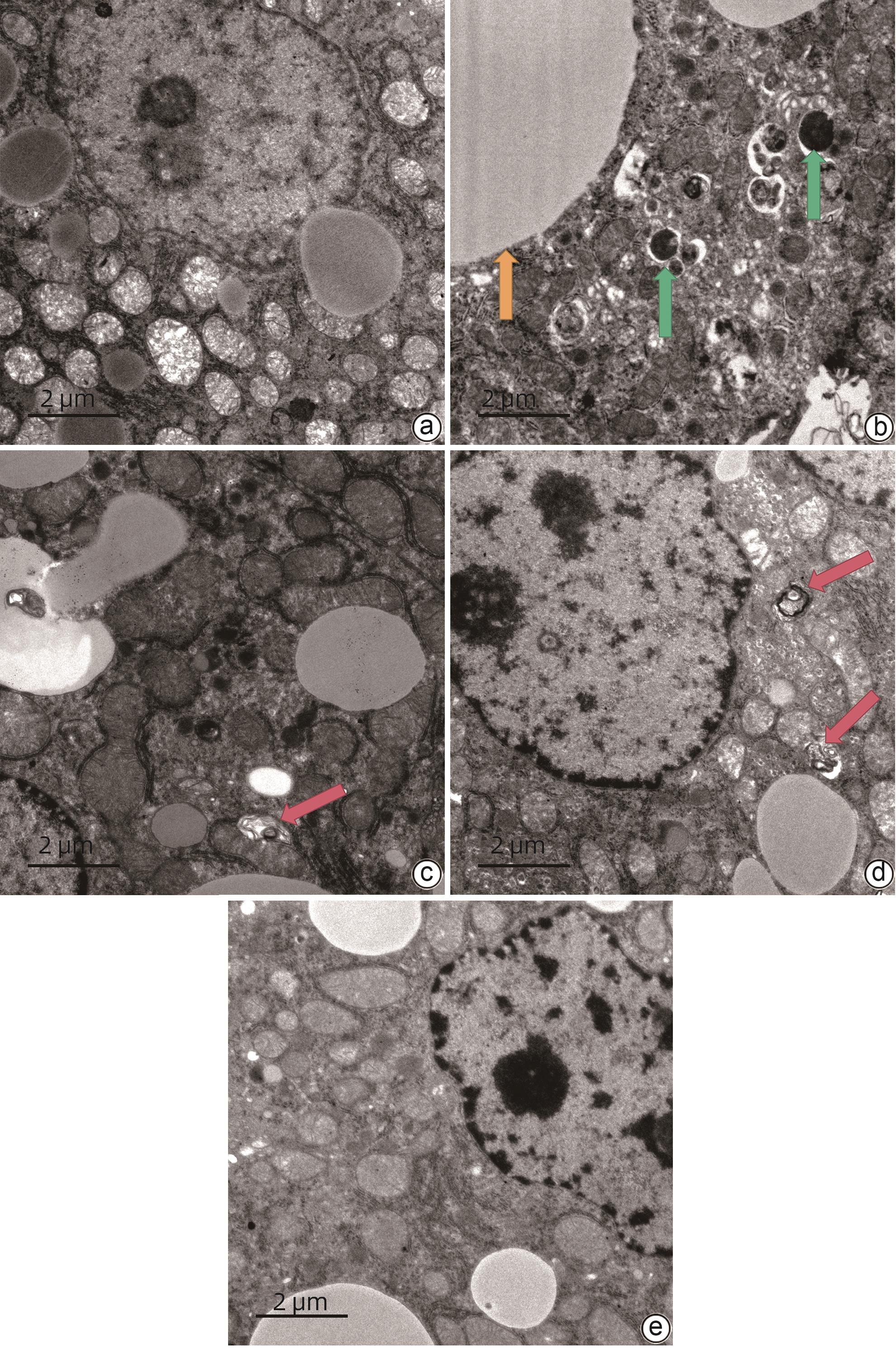
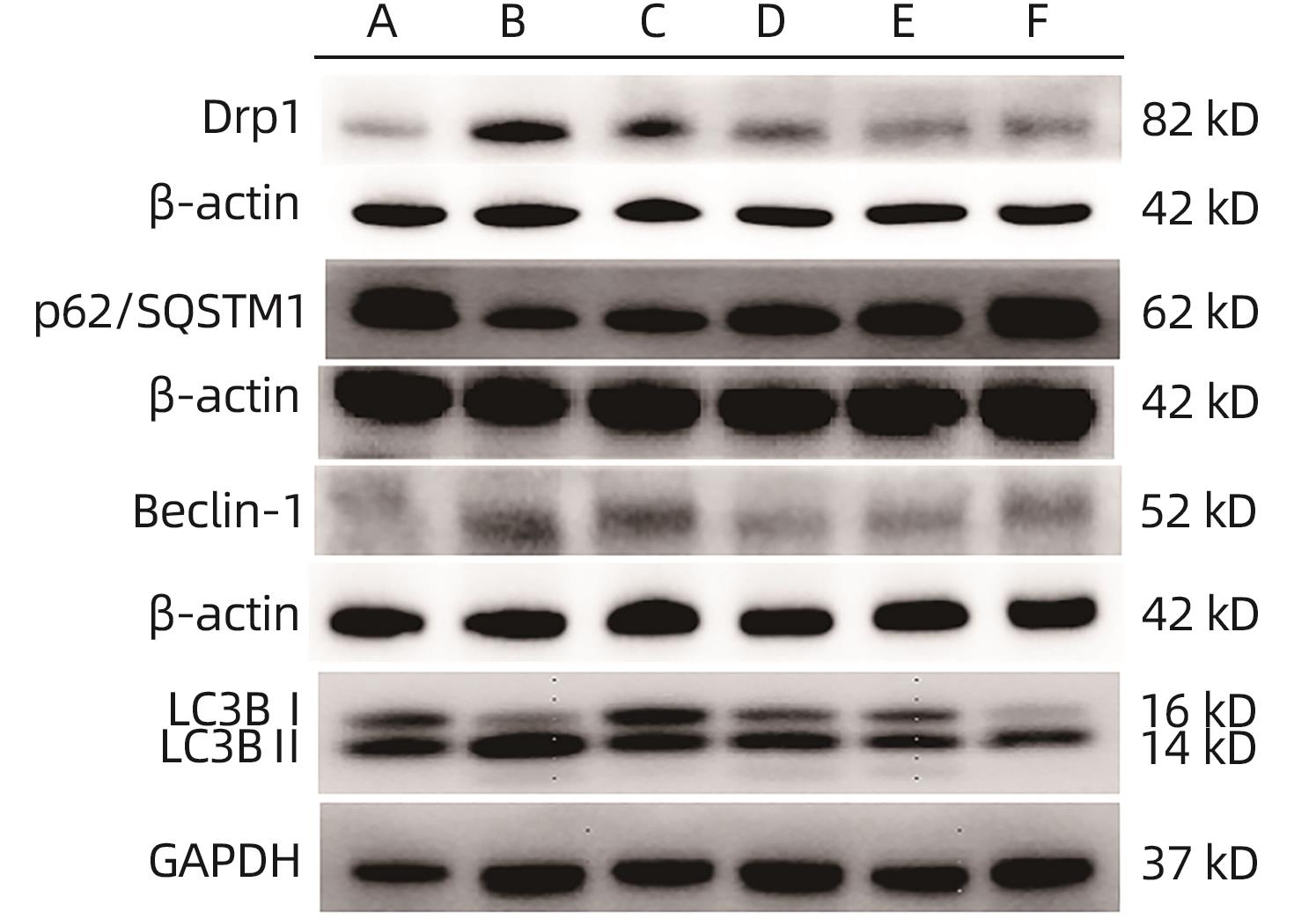
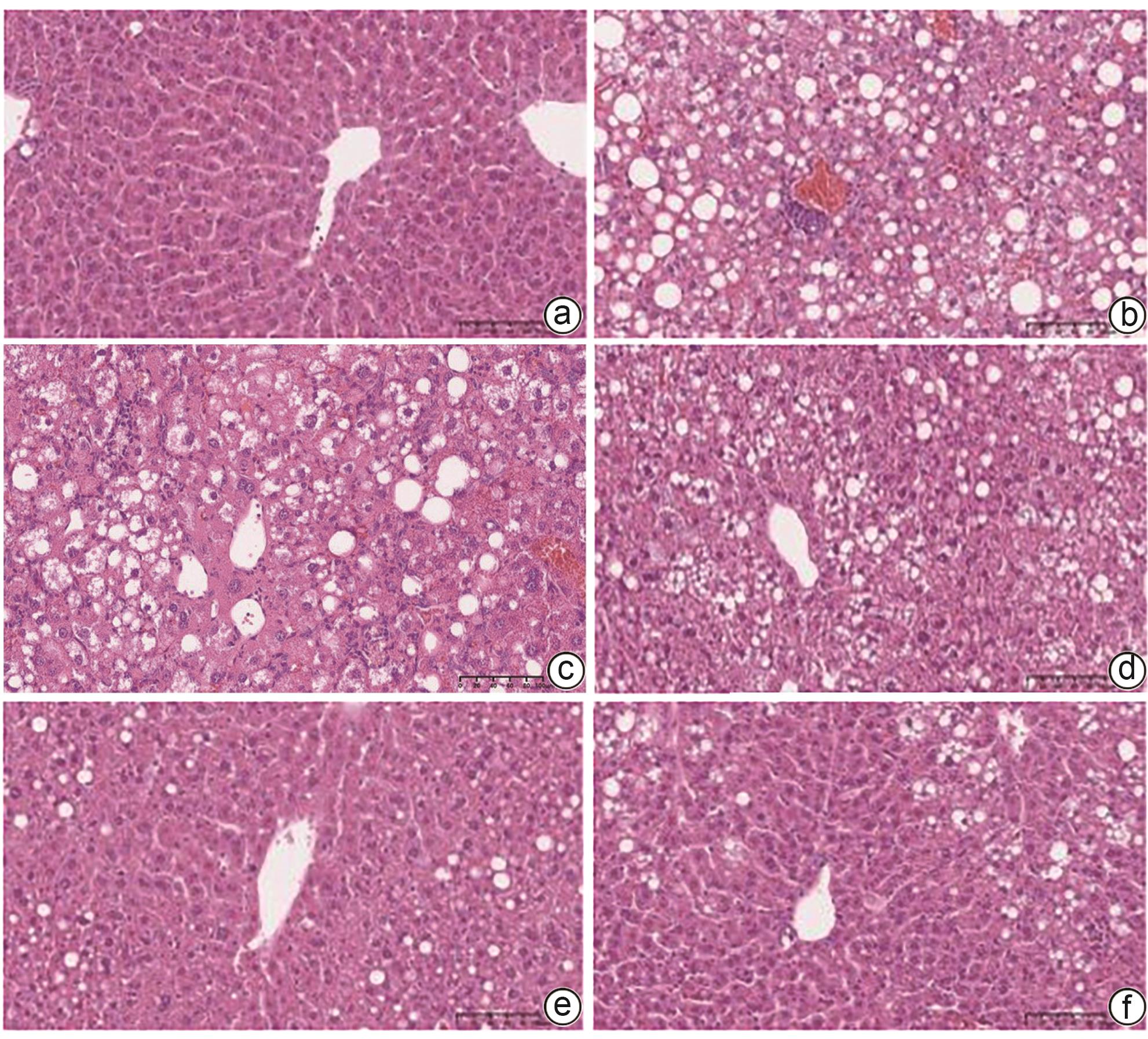
目的 探讨芪术方对非酒精性脂肪性肝病(NAFLD)小鼠模型的疗效及作用机制。 方法 60只雄性C57BL/6J小鼠随机分为正常组,模型组,芪术方低(4.75 g/kg)、中(9.50 g/kg)、高剂量组(19.00 g/kg),多唏磷脂酰胆碱组(磷脂组)(228 mg/kg),每组10只。高脂高胆固醇饲料和20%果糖水造模16周后,各组给予相应药物干预,每天给药1次,连续8周。检测血清ALT、AST、TC、TG、LDL;酶联免疫吸附法(ELISA)检测血清游离脂肪酸(FFA)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、超氧化物歧化酶(SOD)、丙二醛(MDA);苏木素-伊红(HE)和油红O染色观察肝组织病理变化;蛋白免疫印迹法(Western Blot)检测微管相关蛋白轻链3B(LC3BⅡ/Ⅰ)、螯合体(p62/SQSTM1)、Beclin-1、动力相关蛋白1(Drp1)表达。实时荧光定量PCR(Real-time PCR)检测Drp1、Beclin-1、p62/SQSTM1 mRNA表达水平。计量资料多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。 结果 与正常组比较,模型组血清TG、TC、ALT、AST、LDL、FFA、TNF-α、IL-1β、MDA水平均升高,SOD水平降低(P值均<0.05)。HE染色结果显示,模型组小鼠肝组织可见肝细胞脂肪变及大量脂肪空泡;油红O染色结果显示,模型组小鼠肝细胞内有大量大小不一红色脂滴沉积,油红O染色面积百分比较正常组升高(P<0.05)。Real-time PCR结果显示,与正常组比较,模型组肝组织中Drp1、Beclin-1 mRNA升高,p62/SQSTM1 mRNA降低(P值均<0.05)。Western Blot结果显示,与正常组比较,模型组肝组织中Drp1、Beclin-1、LC3BⅡ/Ⅰ蛋白表达水平升高,p62/SQSTM1蛋白表达水平降低(P值均<0.05)。与模型组比较,部分剂量芪术方组和磷脂组血清TG、TC、ALT、AST、LDL、FFA、TNF-α、IL-1β、MDA水平均降低,SOD水平升高(P值均<0.05)。与模型组比较,各用药组肝组织脂肪变改善明显,且油红O染色面积百分比降低(P值均<0.05);Drp1、Beclin-1 mRNA降低,p62/SQSTM1 mRNA升高(P值均<0.05);Drp1、Beclin-1、LC3B Ⅱ/Ⅰ蛋白表达水平降低,部分用药组p62/SQSTM1蛋白表达水平升高(P值均<0.05),且芪术方中、高剂量效果更明显(P值均<0.01)。 结论 芪术方改善NAFLD小鼠肝脂质代谢及炎症水平可能与调控肝细胞线粒体自噬有关。 Abstract:Objective To investigate the therapeutic effect and mechanism of action of Qizhu prescription in mice with non-alcoholic fatty liver disease (NAFLD). Methods A total of 60 male C57BL/6J mice were randomly divided into normal group, model group, low-dose Qizhu prescription group (4.75 g/kg), middle-dose Qizhu prescription group (9.50 g/kg), high-dose Qizhu prescription group (19.00 g/kg), Yishanfu group (228 mg/kg), with 10 mice in each group. After 16 weeks of modeling with a high-fat high-cholesterol diet and 20% fructose water, each group was given the corresponding drug once a day for 8 weeks. The serum levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST), total cholesterol (TC), triglyceride (TG), and low-density lipoprotein (LDL) were measured; ELISA was used to measure the serum levels of free fatty acid (FFA), tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β), superoxide dismutase (SOD), and malondialdehyde (MDA); HE staining and oil red O staining were used to the pathological changes of liver tissue; Western blot was used to measure the protein expression levels of LC3BⅡ/Ⅰ, p62/SQSTM1, Beclin-1, and Drp1, and real-time PCR was used to measure the mRNA expression levels of Drp1, Beclin-1, and p62/SQSTM1. A one-way analysis of variance was used for comparison of continuous data between multiple groups, and the least significant difference t-test was used for further comparison between two groups. Results Compared with the normal group, the model groups had significant increases in the serum levels of TG, TC, ALT, AST, LDL, FFA, TNF-α, IL-1β, and MDA and a significant reduction in the serum level of SOD (P<0.05). HE staining showed that the mice in the model group had hepatocyte steatosis and a large number of fat vacuoles in liver tissue, and oil red O staining showed that the mice in the model group had a large number of red lipid droplets of varying sizes in hepatocytes, with a significant increase in the percentage of oil red O staining area compared with the normal group (P<0.05). Real-time PCR showed that compared with the normal group, the model group had significant increases in the mRNA expression levels of Drp1 and Beclin-1 and a significant reduction in the mRNA expression level of p62/SQSTM1 in liver tissue (all P<0.05), and Western blot showed that compared with the normal group, the model group had significant increases in the protein expression levels of Drp1, Beclin-1, and LC3BⅡ/Ⅰ and a significant reduction in the protein expression level of p62/SQSTM1 in liver tissue (all P<0.05). Compared with the model group, some Qizhu prescription groups and the Yishanfu group had significant reductions in the serum levels of TG, TC, ALT, AST, LDL, FFA, TNF-α, IL-1β, and MDA and a significant increase in the serum level of SOD (all P<0.05). Compared with the model group, each administration group had a significant improvement in steatosis of liver tissue, a significant reduction in the percentage of oil red O staining area, significant reductions in the mRNA expression levels of Drp1 and Beclin-1, and a significant increase in the mRNA expression level of p62/SQSTM1 (all P<0.05); there were significant reductions in the protein expression levels of Drp1, Beclin-1, and LC3BⅡ/Ⅰ, while some administration groups had a significant increase in the protein expression level of p62/SQSTM1 (all P<0.05), with a significantly better effect in the middle- and high-dose Qizhu prescription groups (all P<0.01). Conclusion Qizhu prescription improves lipid metabolism and inflammation in mice with NAFLD possibly by regulating hepatocyte mitophagy. -
Key words:
- Non-alcoholic Fatty Liver Disease /
- Qi Zhu Formula /
- Mitophagy /
- Lipid Metabolism /
- Inflammation
-
表 1 PCR引物序列
Table 1. PCR Primer sequence
基因 引物序列 Drp1 上游 5'-AACAGGCAACTGGAGAGGAA-3' 下游 5'-GCAACTGGAACTGGCACATT-3' Beclin-1 上游 5-CCAATGTCTTCAATGCCACCTTC-3' 下游 5'-AGGCAGCATTGATTTCATTCCAC-3' p62/SQSTM1 上游 5'-CCTTGCCCTACAGCTGAGTC-3' 下游 5'-CATGTTCCACATCAATGTCAACC-3' GAPDH 上游 5'-GGTTGTCTCCTGCGACTTCA-3' 下游 5'-TGGTCCAGGGTTTCTTACTCC-3' 表 2 各组小鼠肝功能及血脂水平
Table 2. Effects on liver function and blood glucose of mice in each group
组别 动物数(只) AST(U/L) ALT(U/L) TC(mmol/L) TG(mmol/L) LDL(mmol/L) 正常组 6 81.00±31.77 29.33±5.61 2.45±0.11 0.74±0.20 0.44±0.04 模型组 6 179.30±57.571) 142.70±72.791) 6.28±0.651) 0.99±0.251) 1.43±0.281) 芪术方低剂量组 6 117.00±33.002) 70.33±30.532) 4.18±0.222) 0.67±0.092) 0.92±0.232) 芪术方中剂量组 6 90.33±17.082) 31.33±4.842) 3.83±0.682) 0.56±0.092) 0.60±0.122) 芪术方高剂量组 6 81.67±10.842) 26.33±4.082) 3.76±0.202) 0.58±0.062) 0.63±0.072) 磷脂组 6 91.00±21.462) 26.67±4.132) 4.18±0.402) 0.59±0.052) 0.73±0.072) F值 8.232 12.26 48.40 7.41 28.69 P值 <0.001 <0.001 <0.001 <0.001 <0.001 注:与正常组比较,1)P<0.05;与模型组比较,2)P<0.05。
表 3 各组小鼠油红O染色面积百分比
Table 3. Percentage of oil red stained area in each group of mice
组别 动物数(只) 油红O染色阳性面积(%) 正常组 3 0.76±0.42 模型组 3 40.40±7.731) 芪术方低剂量组 3 25.80±3.472) 芪术方中剂量组 3 11.55±2.473) 芪术方高剂量组 3 7.81±1.783) 磷脂组 3 10.93±3.983) F值 38.43 P值 <0.001 注:与正常组比较,1)P<0.05;与模型组比较,2)P<0.05,3)P<0.01。
表 4 各组小鼠TNF-α、IL-1β、FFA、MDA及SOD表达水平
Table 4. Expression levels of TNF-α, IL-1β, FFA, MDA and SOD in each group of mice
组别 动物数(只) TNF-α(pg/mL) IL-1β(pg/mL) FFA(μmol/L) MDA(nmol/mL) SOD(U/L) 正常组 6 575.80±75.86 106.90±10.45 688.50±58.02 1.79±0.18 213.30±50.51 模型组 6 1 976.00±141.201) 206.90±18.001) 1 122.00±102.601) 3.00±0.281) 92.62±6.331) 芪术方低剂量组 6 1 554.00±109.002) 177.50±21.232) 990.80±99.88 2.10±0.102) 201.80±17.612) 芪术方中剂量组 6 1 259.00±144.002) 166.40±16.553) 961.90±95.942) 2.01±0.103) 284.90±54.903) 芪术方高剂量组 6 1 000.00±98.932) 138.50±9.643) 888.30±88.713) 1.97±0.173) 396.10±27.593) 磷脂组 6 805.50±120.602) 127.80±16.253) 771.10±104.103) 2.07±0.063) 476.00±58.713) F值 114.70 31.62 17.04 39.73 69.36 P值 <0.001 <0.001 <0.001 <0.001 <0.001 注:与正常组比较,1)P<0.05;与模型组比较,2)P<0.05,3)P<0.01。
表 5 各组小鼠Drp1、Beclin-1、p62/SQSTM1 mRNA表达水平
Table 5. mRNA expression levels of Drp1, Beclin-1, and p62/SQSTM1 in each group of mice
组别 动物数(只) Drp1 Beclin-1 p62/SQSTM1 正常组 6 1.00±0.19 1.00±0.19 1.00±0.14 模型组 6 2.07±0.391) 2.54±0.631) 0.26±0.111) 芪术方低剂量组 6 1.43±0.222) 1.67±0.262) 0.84±0.17 芪术方中剂量组 6 1.16±0.222) 1.31±0.122) 1.11±0.952) 芪术方高剂量组 6 1.05±0.272) 1.02±0.242) 1.22±0.502) 磷脂组 6 1.14±0.282) 0.97±0.402) 0.61±0.17 F值 13.41 18.55 3.70 P值 <0.001 <0.001 0.010 注:与正常组比较,1)P<0.05;与模型组比较,2)P<0.05。
表 6 各组小鼠Drp1、Beclin-1、p62/SQSTM1、LC3B Ⅱ/Ⅰ蛋白表达水平
Table 6. Protein expression levels of Drp1, Beclin-1, p62/SQSTM1 and LC3B Ⅱ/Ⅰ in each group of mice
组别 动物数(只) Drp1 Beclin-1 p62/SQSTM1 LC3B Ⅱ/LC3 Ⅰ 正常组 6 0.64±0.03 0.68±0.01 1.04±0.09 1.35±0.34 模型组 6 1.27±0.061) 1.28±0.031) 0.24±0.011) 3.61±1.731) 芪术方低剂量组 6 0.93±0.172) 1.08±0.043) 0.55±0.05 1.35±0.413) 芪术方中剂量组 6 0.74±0.083) 0.82±0.113) 0.86±0.063) 1.24±0.303) 芪术方高剂量组 6 0.66±0.213) 0.68±0.023) 0.93±0.063) 1.21±0.423) 磷脂组 6 0.49±0.143) 0.93±0.073) 1.12±0.023) 1.23±0.473) F值 14.08 50.99 116.50 4.36 P值 <0.001 <0.001 <0.001 0.017 注:与正常组比较,1)P<0.05;与模型组比较,2)P<0.05,3)P<0.01。
-
[1] QUEK J, CHAN KE, WONG ZY, et al. Global prevalence of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in the overweight and obese population: A systematic review and meta-analysis[J]. Lancet Gastroenterol Hepatol, 2023, 8( 1): 20- 30. DOI: 10.1016/S2468-1253(22)00317-X. [2] WONG VWS, EKSTEDT M, WONG GLH, et al. Changing epidemiology, global trends and implications for outcomes of NAFLD[J]. J Hepatol, 2023, 79( 3): 842- 852. DOI: 10.1016/j.jhep.2023.04.036. [3] CHEN JH, ZHOU ZH. Research progress of abnormal lipid metabolism and mitochondrial dysfunction in the pathogenesis and disease process of NAFLD[J]. Chin Hepatol, 2023, 28( 11): 1372- 1375. DOI: 10.3969/j.issn.1008-1704.2023.11.027.陈佳豪, 周振华. 肝细胞脂质代谢异常与线粒体功能障碍在NAFLD发病和疾病进程中的研究进展[J]. 肝脏, 2023, 28( 11): 1372- 1375. DOI: 10.3969/j.issn.1008-1704.2023.11.027. [4] REN QN, SUN QM, FU JF. Dysfunction of autophagy in high-fat diet-induced non-alcoholic fatty liver disease[J]. Autophagy, 2024, 20( 2): 221- 241. DOI: 10.1080/15548627.2023.2254191. [5] XIN YJ, CHEN YY, YANG HL, et al. Effect of Xuanfuhua Decoction on a mouse model of nonalcoholic steatohepatitis induced by high-fat, high-fructose, and high-cholesterol diet[J]. J Clin Hepatol, 2023, 39( 6): 1340- 1350. DOI: 10.3969/j.issn.1001-5256.2023.06.014.辛一敬, 陈逸云, 杨海琳, 等. 旋覆花汤对高脂高果糖高胆固醇饮食诱导非酒精性脂肪性肝炎小鼠模型的影响[J]. 临床肝胆病杂志, 2023, 39( 6): 1340- 1350. DOI: 10.3969/j.issn.1001-5256.2023.06.014. [6] ZHANG QY, ZHOU ZH. Mechanism of non-alcoholic steatohepatitis improved by Qizhu prescription based on AMPK signaling pathway[J]. Chin J Exp Tradit Med Formulae, 2024, 30( 8): 49- 56. DOI: 10.13422/j.cnki.syfjx.20232237.张秋怡, 周振华. 基于AMPK信号通路探讨芪术方改善非酒精性脂肪性肝炎的机制[J]. 中国实验方剂学杂志, 2024, 30( 8): 49- 56. DOI: 10.13422/j.cnki.syfjx.20232237. [7] FAKHOURY-SAYEGH N, TRAK-SMAYRA V, SAYEGH R, et al. Fructose threshold for inducing organ damage in a rat model of nonalcoholic fatty liver disease[J]. Nutr Res, 2019, 62: 101- 112. DOI: 10.1016/j.nutres.2018.11.003. [8] CHEN Z, TIAN RF, SHE ZG, et al. Role of oxidative stress in the pathogenesis of nonalcoholic fatty liver disease[J]. Free Radic Biol Med, 2020, 152: 116- 141. DOI: 10.1016/j.freeradbiomed.2020.02.025. [9] SCHUSTER S, CABRERA D, ARRESE M, et al. Triggering and resolution of inflammation in NASH[J]. Nat Rev Gastroenterol Hepatol, 2018, 15( 6): 349- 364. DOI: 10.1038/s41575-018-0009-6. [10] ZHANG DW, ZHAO HY, LI QS, et al. Effect of AstragalosideIV and ginsenoside Rg1 on autophagy of myocardial tissue injury induced by ischemia-reperfusion injury in hyperlipidemic mice[J]. Chin Arch Tradit Chin Med, 2020, 38( 3): 60- 64. DOI: 10.13193/j.issn.1673-7717.2020.03.016.张东伟, 赵宏月, 李全生, 等. 黄芪甲苷及人参皂苷Rg1对高脂大鼠心肌缺血再灌注损伤后心肌线粒体自噬的影响[J]. 中华中医药学刊, 2020, 38( 3): 60- 64. DOI: 10.13193/j.issn.1673-7717.2020.03.016. [11] SU J, GAO CT, XIE L, et al. Astragaloside II ameliorated podocyte injury and mitochondrial dysfunction in streptozotocin-induced diabetic rats[J]. Front Pharmacol, 2021, 12: 638422. DOI: 10.3389/fphar.2021.638422. [12] LI SD, CHEN XJ, LIU JK, et al. Signaling pathways involved in the active components of Polygonum cuspidatum in treatment of nonalcoholic fatty liver disease and their interaction[J]. J Clin Hepatol, 2022, 38( 4): 902- 907. DOI: 10.3969/j.issn.1001-5256.2022.04.033.李淑娣, 陈欣菊, 刘江凯, 等. 虎杖活性成分治疗非酒精性脂肪性肝病的相关信号通路及相互作用[J]. 临床肝胆病杂志, 2022, 38( 4): 902- 907. DOI: 10.3969/j.issn.1001-5256.2022.04.033. [13] WANG Y, YANG ZY, LI SQ, et al. Regulatory mechanism of Polygonidine on endoplasmic reticulum stress in non⁃alcoholic fatty hepatocytes[J]. Anatomy Research, 2023, 45( 1): 57- 62. DOI: 10.20021/j.cnki.1671-0770.2023.01.10.王懿, 杨志勇, 李书芹, 等. 虎杖苷对非酒精性脂肪性肝细胞内质网应激的调控机制[J]. 解剖学研究, 2023, 45( 1): 57- 62. DOI: 10.20021/j.cnki.1671-0770.2023.01.10. [14] ZHANG PF, CHENG XY, SUN HM, et al. Atractyloside protect mice against liver steatosis by activation of autophagy via ANT-AMPK-mTORC1 signaling pathway[J]. Front Pharmacol, 2021, 12: 736655. DOI: 10.3389/fphar.2021.736655. [15] UENO T, KOMATSU M. Autophagy in the liver: Functions in health and disease[J]. Nat Rev Gastroenterol Hepatol, 2017, 14( 3): 170- 184. DOI: 10.1038/nrgastro.2016.185. [16] MA XW, MCKEEN T, ZHANG JH, et al. Role and mechanisms of mitophagy in liver diseases[J]. Cells, 2020, 9( 4): 837. DOI: 10.3390/cells9040837. [17] LU YY, LI ZJ, ZHANG SQ, et al. Cellular mitophagy: Mechanism, roles in diseases and small molecule pharmacological regulation[J]. Theranostics, 2023, 13( 2): 736- 766. DOI: 10.7150/thno.79876. [18] LI L, JIA QL, WANG XX, et al. Chaihu Shugan San promotes gastric motility in rats with functional dyspepsia by regulating Drp-1-mediated ICC mitophagy[J]. Pharm Biol, 2023, 61( 1): 249- 258. DOI: 10.1080/13880209.2023.2166966. [19] LIU T, YU JN, LIU Y, et al. Effects of serum-free starvation on proliferative capacity of muscle satellite cells and expression of autophagy-related proteins LC3 and Beclin1[J]. Chin J Tissue Eng Res, 2019, 23( 11): 1657- 1661. DOI: 10.3969/j.issn.2095-4344.1062.刘通, 于佳妮, 刘悦, 等. 去血清饥饿条件下肌卫星细胞增殖及自噬蛋白LC3、Beclin1的表达[J]. 中国组织工程研究, 2019, 23( 11): 1657- 1661. DOI: 10.3969/j.issn.2095-4344.1062. [20] SUI XY, XU P, DUAN CZ, et al. Advances in molecular function of p62 protein and its role in diseases[J]. Chin J Biotechnol, 2023, 39( 4): 1374- 1389. DOI: 10.13345/j.cjb.220681.隋馨莹, 徐平, 段昌柱, 等. p62蛋白的分子功能及其在疾病中的研究进展[J]. 生物工程学报, 2023, 39( 4): 1374- 1389. DOI: 10.13345/j.cjb.220681. [21] YAO RQ, REN C, XIA ZF, et al. Organelle-specific autophagy in inflammatory diseases: A potential therapeutic target underlying the quality control of multiple organelles[J]. Autophagy, 2021, 17( 2): 385- 401. DOI: 10.1080/15548627.2020.1725377. -



 PDF下载 ( 4620 KB)
PDF下载 ( 4620 KB)

 下载:
下载: