经颈静脉肝内门体分流术治疗肝细胞癌合并食管胃底静脉曲张破裂出血的效果分析
DOI: 10.12449/JCH241016
Efficacy of transjugular intrahepatic portosystemic shunt in treatment of hepatocellular carcinoma comorbid with esophagogastric variceal bleeding
-
摘要:
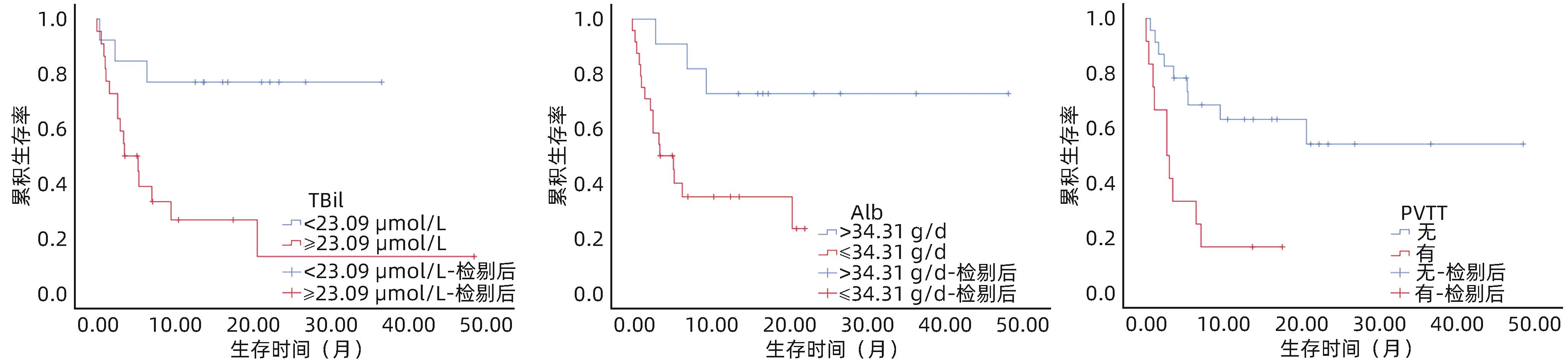
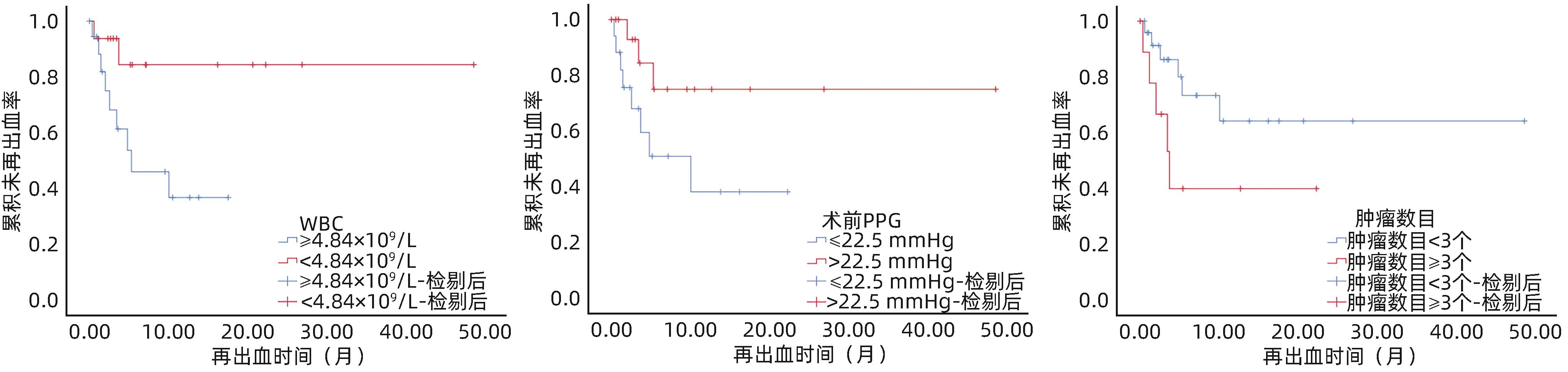
目的 评估经颈静脉肝内门体分流术(TIPS)预防肝细胞癌(HCC)合并食管胃底静脉曲张破裂出血患者发生再出血的疗效,并探索影响预后的因素。 方法 回顾性分析2019年7月—2023年4月南方医科大学南方医院增城院区收治的HCC合并食管胃底静脉曲张破裂出血并接受TIPS治疗的35例患者的临床资料。Kaplan-Meier曲线评估TIPS术后再出血率及生存率。Cox回归模型分析患者术后再出血及生存的影响因素。 结果 所有患者TIPS手术均在技术上成功。中位随访时间16.4个月。随访期间11例(31.4%)患者发生食管胃底静脉曲张再出血,1个月、3个月和1年再出血率分别为5.7%、17.1%和28.6%。TIPS术后再出血的独立预测因子为WBC[风险比(HR)=1.31,95%CI:1.04~1.64,P=0.021]、肿瘤数目≥3个(HR=35.68,95%CI:1.74~733.79,P=0.021)和术前门静脉压力梯度(HR=0.85,95%CI:0.73~0.99,P=0.032)。术后发生分流道失功5例。随访期间,共有19例患者死亡,中位生存期为9.6个月;TIPS术后生存的独立预测因子为门静脉癌栓(PVTT)(HR=7.04,95%CI:1.31~37.78,P=0.023)、血清TBil(HR=1.02,95%CI:1.00~1.03,P=0.042)和血清Alb水平(HR=0.82,95%CI:0.72~0.94,P=0.004)。 结论 TIPS可作为预防HCC患者食管胃底静脉曲张再出血的治疗选择;在WBC、TBil较高或伴有PVTT患者中,患者预后较差,应谨慎决定是否进行TIPS治疗。 -
关键词:
- 癌, 肝细胞 /
- 门体分流术, 经颈静脉肝内 /
- 食管和胃静脉曲张 /
- 出血
Abstract:Objective To investigate the efficacy of transjugular intrahepatic portosystemic shunt (TIPS) in preventing rebleeding in patients with hepatocellular carcinoma (HCC) comorbid with esophagogastric variceal bleeding and the influencing factors for prognosis. Methods A retrospective analysis was performed for the clinical data of 35 HCC patients comorbid with esophagogastric variceal bleeding who were admitted to Zengcheng Branch of Nanfang Hospital, Southern Medical University, and were treated with TIPS from July 2019 to April 2023. The Kaplan-Meier curve was used to assess rebleeding rate and survival rate after TIPS, and the Cox regression model was used to investigate the influencing factors for postoperative rebleeding and survival. Results The TIPS procedure was technically successful in all patients, with a median follow-up time of 16.4 months. During follow-up, 11 patients (31.4%) experienced esophagogastric variceal rebleeding, with the 1-month, 3-month, and 1-year rebleeding rates of 5.7%, 17.1%, and 28.6%, respectively. White blood cell count (WBC) (risk ratio [HR]=1.31, 95% confidence interval [CI]: 1.04 — 1.64, P=0.021), number of tumors ≥3 (HR=35.68, 95%CI: 1.74 — 733.79, P=0.021), and portal pressure gradient before TIPS (HR=0.85, 95%CI: 0.73 — 0.99, P=0.032) were independent predictive factors for rebleeding after TIPS. Shunt dysfunction was observed in 5 patients after surgery. A total of 19 patients died during follow-up, with a median survival time of 9.6 months. Portal vein tumor thrombosis (PVTT) (HR=7.04, 95%CI: 1.31 — 37.78, P=0.023), total bilirubin (TBil) (HR=1.02, 95%CI: 1.00 — 1.03, P=0.042), and serum albumin (HR=0.82, 95%CI: 0.72 — 0.94, P=0.004) were independent predictive factors for survival after TIPS. Conclusion TIPS procedure can be used as a therapeutic option to prevent esophagogastric variceal rebleeding in patients with HCC. Patients with a relatively high level of WBC or TBil or those with PVTT tend to have a poorer prognosis, and the application of TIPS treatment in such patients should be determined with caution. -
表 1 35例患者基线特征
Table 1. Patients’ baseline characteristics
指标 数值 年龄(岁) 56.0(52.0~63.0) 男性[例(%)] 33(94.3) 肝病病因[例(%)] 乙型肝炎 27(77.1) 丙型肝炎 3(8.6) 其他 5(14.3) 门静脉血栓[例(%)] 10(28.6) PVTT[例(%)] 12(34.3) 既往肝性脑病[例(%)] 2(5.7) 实验室指标(TIPS术前) WBC(×109/L) 5.0(3.5~9.1) ALT(U/L) 23.4(18.3~52.9) TBil(μmol/L) 29.7(18.6~38.9) Alb(g/dL) 31.7(29.0~35.4) SCr(μmol/L) 75.2(65.0~122.9) PT(s) 17.2(14.9~19.3) AFP(ng/mL) 11.8(5.6~99.7) 肿瘤数目[例(%)] 1个 14(40.0) 2个 11(31.4) ≥3个 10(28.6) 肿瘤最大直径(mm) 40.0(24.0~65.0) MELD评分(分) 12.7(10.6~20.2) Child-Pugh分级[例(%)] A级 9(25.7) B级 23(65.7) C级 3(8.6) 巴塞罗那分期[例(%)] A期 15(42.9) B期 13(37.1) C期 4(11.4) D期 3(8.6) 急诊TIPS[例(%)] 10(28.6) TIPS术前PPG(mmHg) 22.5(18.0~25.3)1) TIPS术后PPG(mmHg) 9.0(8.0~12.0)1) PPG下降率≥50% 24(68.6)1) 注:1)1例患者未测得术前及术后门静脉压力。PVTT,门静脉癌栓;SCr,血肌酐;PT,凝血酶原时间;AFP,甲胎蛋白。
表 2 影响 HCC患者再出血的单因素和多因素Cox分析
Table 2. Univariate and multivariate Cox analysis affecting rebleeding in patients with HCC
指标 单因素分析 多因素分析 HR(95%CI) P值 HR(95%CI) P值 PVTT 1.95(0.55~6.89) 0.300 实验室指标(TIPS术前) WBC 1.10(1.00~1.20) 0.044 1.31(1.04~1.64) 0.021 TBil 1.00(0.97~1.02) 0.859 Alb 0.96(0.87~1.06) 0.437 肿瘤数目 1个 1.00 2个 1.05(0.21~5.22) 0.954 3.06(0.25~37.60) 0.382 ≥3个 2.78(0.66~11.65) 0.162 35.68(1.74~733.79) 0.021 Child-Pugh分级 A级 1.00 B级 0.68(0.18~2.55) 0.566 C级 1.63(0.29~9.01) 0.577 急诊TIPS 2.25(0.68~7.43) 0.184 TIPS术前PPG 0.93(0.82~1.04) 0.208 0.85(0.73~0.99) 0.032 TIPS术后PPG 0.94(0.82~1.07) 0.341 注:PVTT赋值:有=1,无=0;急诊TIPS赋值:行急诊TIPS=1,未行急诊TIPS(即择期TIPS)=0。
表 3 影响 HCC患者死亡的单因素和多因素Cox分析
Table 3. Univariate and multivariate Cox analysis affecting death in patients with HCC
指标 单因素分析 多因素分析 HR(95%CI) P值 HR(95%CI) P值 男性 5.17(1.11~24.13) 0.037 3.12(0.04~261.77) 0.615 门静脉血栓 3.10(1.25~7.67) 0.015 1.64(0.42~6.39) 0.475 PVTT 3.80(1.48~9.75) 0.005 7.04(1.31~37.78) 0.023 既往肝性脑病 3.96(0.85~18.46) 0.080 实验室指标(TIPS术前) WBC 1.07(0.99~1.16) 0.109 TBil 1.01(1.00~1.02) 0.005 1.02(1.00~1.03) 0.042 Alb 0.94(0.87~1.01) 0.097 0.82(0.72~0.94) 0.004 Cr 1.01(1.00~1.01) 0.043 1.01(1.00~1.02) 0.139 PT 1.12(1.00~1.25) 0.043 INR 5.16(1.05~25.37) 0.044 1.18(0.07~20.50) 0.910 MELD评分(分) 1.11(1.03~1.20) 0.009 Child-Pugh分级 A级 1.00 B级 4.69(1.06~20.77) 0.042 1.61(0.26~10.04) 0.611 C级 7.37(1.18~45.89) 0.032 0.84(0.03~20.52) 0.915 TIPS术前PPG 1.04(0.96~1.13) 0.344 注:门静脉血栓赋值:有=1,无=0;PVTT赋值:有=1,无=0;既往肝性脑病赋值:有=1,无=0。
-
[1] GINÈS P, KRAG A, ABRALDES JG, et al. Liver cirrhosis[J]. Lancet, 2021, 398( 10308): 1359- 1376. DOI: 10.1016/S0140-6736(21)01374-X. [2] European Association for the Study of the Liver. EASL clinical practice guidelines for the management of patients with decompensated cirrhosis[J]. J Hepatol, 2018, 69( 2): 406- 460. DOI: 10.1016/j.jhep.2018.03.024. [3] de FRANCHIS R, FACULTY BV. Expanding consensus in portal hypertension: Report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension[J]. J Hepatol, 2015, 63( 3): 743- 752. DOI: 10.1016/j.jhep.2015.05.022. [4] GIANNINI EG, RISSO D, TESTA R, et al. Prevalence and prognostic significance of the presence of esophageal varices in patients with hepatocellular carcinoma[J]. Clin Gastroenterol Hepatol, 2006, 4( 11): 1378- 1384. DOI: 10.1016/j.cgh.2006.08.011. [5] GARCIA-TSAO G, ABRALDES JG, BERZIGOTTI A, et al. Portal hypertensive bleeding in cirrhosis: Risk stratification, diagnosis, and management: 2016 practice guidance by the American Association for the study of liver diseases[J]. Hepatology, 2017, 65( 1): 310- 335. DOI: 10.1002/hep.28906. [6] DARIUSHNIA SR, HASKAL ZJ, MIDIA M, et al. Quality improvement guidelines for transjugular intrahepatic portosystemic shunts[J]. J Vasc Interv Radiol, 2016, 27( 1): 1- 7. DOI: 10.1016/j.jvir.2015.09.018. [7] LIU L, ZHAO Y, QI XS, et al. Transjugular intrahepatic portosystemic shunt for symptomatic portal hypertension in hepatocellular carcinoma with portal vein tumor thrombosis[J]. Hepatol Res, 2014, 44( 6): 621- 630. DOI: 10.1111/hepr.12162. [8] ZHOU J, SUN HC, WANG Z, et al. Guidelines for the diagnosis and treatment of primary liver cancer(2022 edition)[J]. Liver Cancer, 2023, 12( 5): 405- 444. DOI: 10.1159/000530495. [9] LYU Y, FAN DM, HAN GH. Application status and future prospect of transjugular intrahepatic portosystemic shunt in gastroesophageal variceal bleeding in liver cirrhosis[J]. J Clin Hepatol, 2022, 38( 6): 1229- 1233. DOI: 10.3969/j.issn.1001-5256.2022.06.004.吕勇, 樊代明, 韩国宏. 经颈静脉肝内门体分流术在肝硬化食管胃底静脉曲张破裂出血中的应用现状与未来展望[J]. 临床肝胆病杂志, 2022, 38( 6): 1229- 1233. DOI: 10.3969/j.issn.1001-5256.2022.06.004. [10] GUPTA VF, AGASSI A, MARTIN JG, et al. Intravascular ultrasound guidance for transjugular intrahepatic portosystemic shunt creation reduces laboratory markers of acute liver injury[J]. J Vasc Interv Radiol, 2023, 34( 10): 1680- 1689. e 2. DOI: 10.1016/j.jvir.2023.06.034. [11] ZHANG XW, TSAUO J, TIE J, et al. Emergent transjugular intrahepatic portosystemic shunt creation for acute gastric variceal bleeding in patients with hepatocellular carcinoma[J]. J Vasc Interv Radiol, 2022, 33( 6): 702- 706. DOI: 10.1016/j.jvir.2022.03.012. [12] TSAUO J, TIE J, XUE H, et al. Transjugular intrahepatic portosystemic shunt creation for the prevention of gastric variceal rebleeding in patients with hepatocellular carcinoma: A multicenter retrospective study[J]. J Vasc Interv Radiol, 2021, 32( 7): 963- 969. DOI: 10.1016/j.jvir.2021.04.005. [13] LIU JC, MA JQ, ZHOU C, et al. Potential benefits of underdilation of 8-mm covered stent in transjugular intrahepatic portosystemic shunt creation[J]. Clin Transl Gastroenterol, 2021, 12( 6): e00376. DOI: 10.14309/ctg.0000000000000376. [14] CAO LM, ZHANG YX, LIANG ZH, et al. Clinical efficacy of repeated TACE combined with TIPS in treatment of patients with hepatocellular carcinoma complicated by liver cirrhosis and upper gastrointestinal bleeding[J]. Clin Misdiagn Misther, 2022, 35( 2): 39- 43. DOI: 10.3969/j.issn.1002-3429.2022.02.010.曹莉明, 张勇学, 梁志会, 等. 多次TACE联合TIPS治疗肝癌合并肝硬化上消化道出血的临床效果[J]. 临床误诊误治, 2022, 35( 2): 39- 43. DOI: 10.3969/j.issn.1002-3429.2022.02.010. [15] Chinese Society of Spleen and Portal Hypertension Surgery, Chinese Society of Surgery, Chinese Medical Association. Chinese expert consensus on clinical diagnosis and treatment of portal hypertension with hepatocellular carcinoma(2022 edition)[J]. Chin J Dig Surg, 2022, 21( 4): 444- 455. DOI: 10.3760/cma.j.cn115610-20220223-00104.中华医学会外科学分会脾及门静脉高压外科学组. 门静脉高压合并肝细胞癌临床诊断与治疗中国专家共识(2022版)[J]. 中华消化外科杂志, 2022, 21( 4): 444- 455. DOI: 10.3760/cma.j.cn115610-20220223-00104. [16] WU WY, ZHANG FM, MEI XC, et al. Balloon-compression endoscopic injection sclerotherapy versus transjugular intrahepatic portosystemic shunt for esophageal variceal rebleeding[J]. Surg Endosc, 2023, 37( 7): 5766- 5774. DOI: 10.1007/s00464-023-10085-y. [17] XUE H, ZHANG M, PANG JX, et al. Transjugular intrahepatic portosystemic shunt vs endoscopic therapy in preventing variceal rebleeding[J]. World J Gastroenterol, 2012, 18( 48): 7341- 7347. DOI: 10.3748/wjg.v18.i48.7341. [18] LIU JC, SHI Q, XIAO SP, et al. Using transjugular intrahepatic portosystemic shunt as the first-line therapy in secondary prophylaxis of variceal hemorrhage[J]. J Gastroenterol Hepatol, 2020, 35( 2): 278- 283. DOI: 10.1111/jgh.14761. [19] RIPOLL C, GENESCÀ J, ARAUJO IK, et al. Rebleeding prophylaxis improves outcomes in patients with hepatocellular carcinoma. A multicenter case-control study[J]. Hepatology, 2013, 58( 6): 2079- 2088. DOI: 10.1002/hep.26629. [20] AUGUSTIN S, MUNTANER L, ALTAMIRANO JT, et al. Predicting early mortality after acute variceal hemorrhage based on classification and regression tree analysis[J]. Clin Gastroenterol Hepatol, 2009, 7( 12): 1347- 1354. DOI: 10.1016/j.cgh.2009.08.011. [21] CHEN J, TSENG Y, LUO TC, et al. Prophylactic endoscopic therapy for variceal bleeding in patients with hepatocellular carcinoma[J]. J Cancer, 2019, 10( 14): 3087- 3093. DOI: 10.7150/jca.30434. [22] LEE YR, PARK SY, TAK WY. Treatment outcomes and prognostic factors of acute variceal bleeding in patients with hepatocellular carcinoma[J]. Gut Liver, 2020, 14( 4): 500- 508. DOI: 10.5009/gnl19155. [23] KAWAI T, YASHIMA Y, SUGIMOTO T, et al. Emergency endoscopic variceal ligation following variceal rupture in patients with advanced hepatocellular carcinoma and portal vein tumor thrombosis: A retrospective study[J]. World J Surg Oncol, 2016, 14: 52. DOI: 10.1186/s12957-016-0802-z. [24] LIANG XX, HE LL, YANG JR, et al. Risk factors of rebleeding after endoscopic treatment of patients with portal vein tumor thrombus and esophagogastric variceal bleeding[J]. J Clin Hepatol, 2022, 38( 10): 2290- 2295. DOI: 10.3969/j.issn.1001-5256.2022.10.017.梁秀霞, 何玲玲, 杨君茹, 等. 内镜治疗肝细胞癌合并门静脉癌栓患者食管胃静脉曲张出血后再出血的危险因素分析[J]. 临床肝胆病杂志, 2022, 38( 10): 2290- 2295. DOI: 10.3969/j.issn.1001-5256.2022.10.017. [25] CHANG CJ, HOU MC, LIAO WC, et al. Risk factors of early re-bleeding and mortality in patients with ruptured gastric varices and concomitant hepatocellular carcinoma[J]. J Gastroenterol, 2012, 47( 5): 531- 539. DOI: 10.1007/s00535-011-0518-3. [26] WALLACE M, SWAIM M. Transjugular intrahepatic portosystemic shunts through hepatic neoplasms[J]. J Vasc Interv Radiol, 2003, 14( 4): 501- 507. DOI: 10.1097/01.rvi.0000064846.87207.ab. [27] FONIO P, DISCALZI A, CALANDRI M, et al. Incidence of hepatic encephalopathy after transjugular intrahepatic portosystemic shunt(TIPS) according to its severity and temporal grading classification[J]. Radiol Med, 2017, 122( 9): 713- 721. DOI: 10.1007/s11547-017-0770-6. [28] LIU MY, LI WZ, LI PJ, et al. Comparison of endoscopic therapy and TIPS in prophylaxis and treatment of variceal bleeding in decompensated portal hypertension[J]. J Clin Hepatol, 2023, 39( 7): 1529- 1534. DOI: 10.3969/j.issn.1001-5256.2023.07.003.刘梦莹, 李伟之, 李培杰, 等. 失代偿期门静脉高压并发食管胃静脉曲张出血的防治: 内镜vs经颈静脉肝内门体分流术[J]. 临床肝胆病杂志, 2023, 39( 7): 1529- 1534. DOI: 10.3969/j.issn.1001-5256.2023.07.003. [29] ZHENG MH, CHEN YP, BAI JL, et al. Transjugular intrahepatic portosystemic shunt versus endoscopic therapy in the secondary prophylaxis of variceal rebleeding in cirrhotic patients: Meta-analysis update[J]. J Clin Gastroenterol, 2008, 42( 5): 507- 516. DOI: 10.1097/MCG.0b013e31815576e6. [30] BAI M, QI XS, YANG ZP, et al. Predictors of hepatic encephalopathy after transjugular intrahepatic portosystemic shunt in cirrhotic patients: A systematic review[J]. J Gastroenterol Hepatol, 2011, 26( 6): 943- 951. DOI: 10.1111/j.1440-1746.2011.06663.x. [31] NARDELLI S, GIOIA S, PASQUALE C, et al. Cognitive impairment predicts the occurrence of hepatic encephalopathy after transjugular intrahepatic portosystemic shunt[J]. Am J Gastroenterol, 2016, 111( 4): 523- 528. DOI: 10.1038/ajg.2016.29. [32] BERLIOUX P, ROBIC MA, POIRSON H, et al. Pre-transjugular intrahepatic portosystemic shunts(TIPS) prediction of post-TIPS overt hepatic encephalopathy: The critical flicker frequency is more accurate than psychometric tests[J]. Hepatology, 2014, 59( 2): 622- 629. DOI: 10.1002/hep.26684. -



 PDF下载 ( 1038 KB)
PDF下载 ( 1038 KB)

 下载:
下载: