850例单中心肝细胞癌患者的临床特征与预后分析
DOI: 10.12449/JCH241015
Clinical features and prognosis of hepatocellular carcinoma: A single-center study of 850 cases
-
摘要:
目的 探讨肝细胞癌(HCC)的临床特征及其预后。 方法 收集2014年12月—2022年5月湖北省中医院收治的850例HCC患者病历资料,分析其临床及预后特征。计数资料组间比较采用χ2检验,Kaplan-Meier计算生存时间和生存率,Log-rank检验比较基线特征的生存期差异。 结果 850例HCC患者,以男性为主(82.6%),首诊中位年龄58.0(49.0~66.0)岁,50~69岁年龄段占比最高(59.8%)。HBV感染占比最高(77.4%),首诊74.2%患者合并肝硬化,49.2%有门静脉癌栓,20.2%肝外转移,以肺部转移占比最高(44.2%,76/172)。巴塞罗那分期(BCLC)A(0)、B、C、D期分别为20.4%、22.5%、41.5%、15.6%。患者性别(χ2=16.631,P=0.001)、年龄段(χ2=24.261,P=0.019)、居住地(χ2=39.776,P<0.001)、是否有病毒性肝炎(χ2=8.338,P=0.040)、首诊前是否规律抗病毒(χ2=26.140,P<0.001)的BCLC分期总体分布差异均有统计学意义。随访到489例患者的生存时间,总体中位生存时间19.99个月(95%CI:14.86~25.12),1、3、5、10年总体累积生存率分别为60.7%、39.9%、29.4%、22.7%。不同年龄段(χ2=13.452,P=0.009)、病毒性肝炎病史(χ2=6.123,P=0.013)、首诊前是否规律抗病毒(χ2=15.505,P<0.001)、合并2型糖尿病(χ2=9.820,P=0.002)、肿瘤个数(χ2=57.713,P<0.001)、肿瘤最大直径(χ2=41.862,P<0.001)、门静脉癌栓(χ2=293.909,P<0.001)、首诊肝外转移(χ2=118.329,P<0.001)、BCLC分期(χ2=465.638,P<0.001)、手术切除(χ2=78.860,P<0.001)、局部治疗(χ2=36.216,P<0.001)、免疫检查点抑制剂和/或抗肿瘤血管生成治疗(χ2=7.182,P=0.007)、中药汤剂治疗(χ2=30.050,P<0.001)、不同综合治疗方案(χ2=13.221,P=0.004)的生存时间有差异。259例(30.5%)患者记录了无进展生存期,无进展中位生存时间为10.98个月(95%CI:8.54~13.42)。 结论 HCC患者在性别、年龄、居住地、是否有病毒性肝炎、首诊前规律抗病毒、肿瘤特征、治疗方式、预后均存在流行病学特征,早期发现率低、总体生存时间短,急需开展早筛、早诊、早治工作。 Abstract:Objective To investigate the clinical features and prognosis of hepatocellular carcinoma (HCC). Methods Medical records were collected from 850 HCC patients who were admitted to Hubei Provincial Hospital of Traditional Chinese Medicine from December 2014 to May 2022, and their clinical and prognostic features were analyzed. The chi-square test were used for comparison of categorical data between groups; the Kaplan-Meier method was used to calculate survival time and survival rate, and the log-rank test was used for comparison of survival time based on baseline features. Results Among the 850 HCC patients, male patients accounted for 82.6%, and the median age at initial diagnosis was 58.0 (49.0, 66.0) years, with the highest proportion of patients aged 50 — 69 years (59.8%). The patients with HBV infection accounted for the highest proportion of 77.4%; at initial diagnosis, 49.2% of the patients had portal vein tumor thrombus, and 20.2% of the patients had extrahepatic metastasis, among which pulmonary metastasis accounted for the highest proportion of 44.2% (76/172). The patients with Barcelona Clinic Liver Cancer (BCLC) stage A (0), B, C, and D HCC accounted for 20.4%, 22.5%, 41.5%, and 15.6%, respectively. There was a significant difference in the distribution of BCLC stages between different groups based on sex (χ2=16.631, P=0.001), age (χ2=24.261, P=0.019), place of residence (χ2=39.776, P<0.001), presence or absence of viral hepatitis (χ2=8.338, P=0.040), and presence or absence of regular antiviral therapy before initial diagnosis (χ2=26.140, P<0.001). Follow-up was performed for 489 patients till death, with a median survival time of 19.99 months (95% confidence interval [CI]: 14.86 — 25.12), and the 1-, 3-, 5-, and 10-year cumulative survival rates were 60.7%, 39.9%, 29.4%, and 22.7%, respectively. There was a significant difference in survival time between different groups based on age (χ2=13.452, P=0.009), history of viral hepatitis (χ2=6.123, P=0.013), regular antiviral therapy before initial diagnosis (χ2=15.505, P<0.001), comorbidity with type 2 diabetes (χ2=9.820, P=0.002), the number of tumors (χ2=57.713, P<0.001), maximum tumor diameter (χ2=41.862, P<0.001), portal vein tumor thrombus (χ2=293.909, P<0.001), extrahepatic metastasis at initial diagnosis (χ2=118.329, P<0.001), BCLC stage (χ2=465.638, P<0.001), surgical resection (χ2=78.86, P<0.001), local treatment (χ2=36.216, P<0.001), immune checkpoint inhibitor treatment and/or anti-tumor angiogenesis therapy (χ2=7.182, P=0.007), traditional Chinese medicine decoction treatment (χ2=30.050, P<0.001), and comprehensive treatment regimens (χ2=13.221, P=0.004). Progression-free survival (PFS) was recorded for 259 patients (30.5%), with a median PFS of 10.98 months (95%CI: 8.54 — 13.42). Conclusion HCC patients exhibit epidemiological characteristics in terms of sex, age, place of residence, presence or absence of viral hepatitis, regular antiviral therapy before initial diagnosis, tumor characteristics, treatment modality, and prognosis, with a low early detection rate and a short overall survival time, and therefore, it is urgent to perform early screening, early diagnosis, and early treatment. -
表 1 850例不同特征首诊HCC患者的BCLC分期分布情况
Table 1. BCLC stage distribution of 850 HCC patients with different characteristics at first diagnosis
项目 总计 A(0)期(n=173) B期(n=191) C期(n=353) D期(n=133) χ2值 P值 性别[例(%)] 16.631 0.001 男 702(82.6) 133(76.9) 148(77.5) 313(88.7) 108(81.2) 女 148(17.4) 40(23.1) 43(22.5) 40(11.3) 25(18.8) 年龄[例(%)] 24.261 0.019 <40岁 65(7.6) 9(5.2) 6(3.1) 39(11.0) 11(8.3) 40~49岁 149(17.5) 35(20.2) 31(16.2) 63(17.8) 20(15.0) 50~59岁 256(30.1) 55(31.8) 63(33.0) 101(28.6) 37(27.8) 60~69岁 252(29.6) 53(30.6) 59(30.9) 106(30.0) 34(25.6) ≥70岁 128(15.1) 21(12.1) 32(16.8) 44(12.5) 31(23.3) 居住地[例(%)] 39.776 <0.001 城市 485(57.1) 110(63.6) 120(62.8) 162(45.9) 93(69.9) 城镇 192(22.6) 41(23.7) 40(20.9) 89(25.2) 22(16.5) 农村 173(20.4) 22(12.7) 31(16.2) 102(28.9) 18(13.5) 吸烟[例(%)] 7.427 0.059 否 588(69.2) 119(68.8) 147(25.0) 233(66.0) 89(66.9) 是 262(30.8) 54(31.2) 44(16.8) 120(34.0) 44(33.1) 饮酒[例(%)] 6.499 0.090 否 584(68.7) 127(73.4) 134(70.2) 243(68.8) 80(60.2) 是 266(31.3) 46(26.6) 57(29.8) 110(31.2) 53(39.8) 病毒性肝炎[例(%)] 8.338 0.040 无 122(14.4) 18(10.4) 31(16.2) 45(12.7) 28(21.1) 有 728(85.6) 155(89.6) 160(83.8) 308(87.3) 105(78.9) 首诊前规律抗病毒[例(%)]1) 26.140 <0.001 否 532(73.1) 91(58.7) 112(70.0) 245(79.5) 84(80.0) 是 196(26.9) 64(41.3) 48(30.0) 63(20.5) 21(20.0) 肝硬化[例(%)] 0.823 0.844 无 219(25.8) 44(25.4) 53(27.7) 91(25.8) 31(23.3) 有 631(74.2) 129(74.6) 138(72.3) 262(74.2) 102(76.7) 糖尿病[例(%)] 3.373 0.338 无 732(86.1) 150(86.7) 168(88.0) 306(86.7) 108(81.2) 有 118(13.9) 23(13.3) 23(12.0) 47(13.3) 25(18.8) 高血压[例(%)] 1.065 0.786 无 646(76.0) 136(78.6) 145(75.9) 267(75.6) 98(73.7) 有 204(24.0) 37(21.4) 46(24.1) 86(24.4) 35(26.3) 注:1)728例患者进行了病毒性治疗。
表 2 489例首诊不同基线特征患者的生存分析
Table 2. Survival analysis in 489 patients with different baseline characteristics at first diagnosis
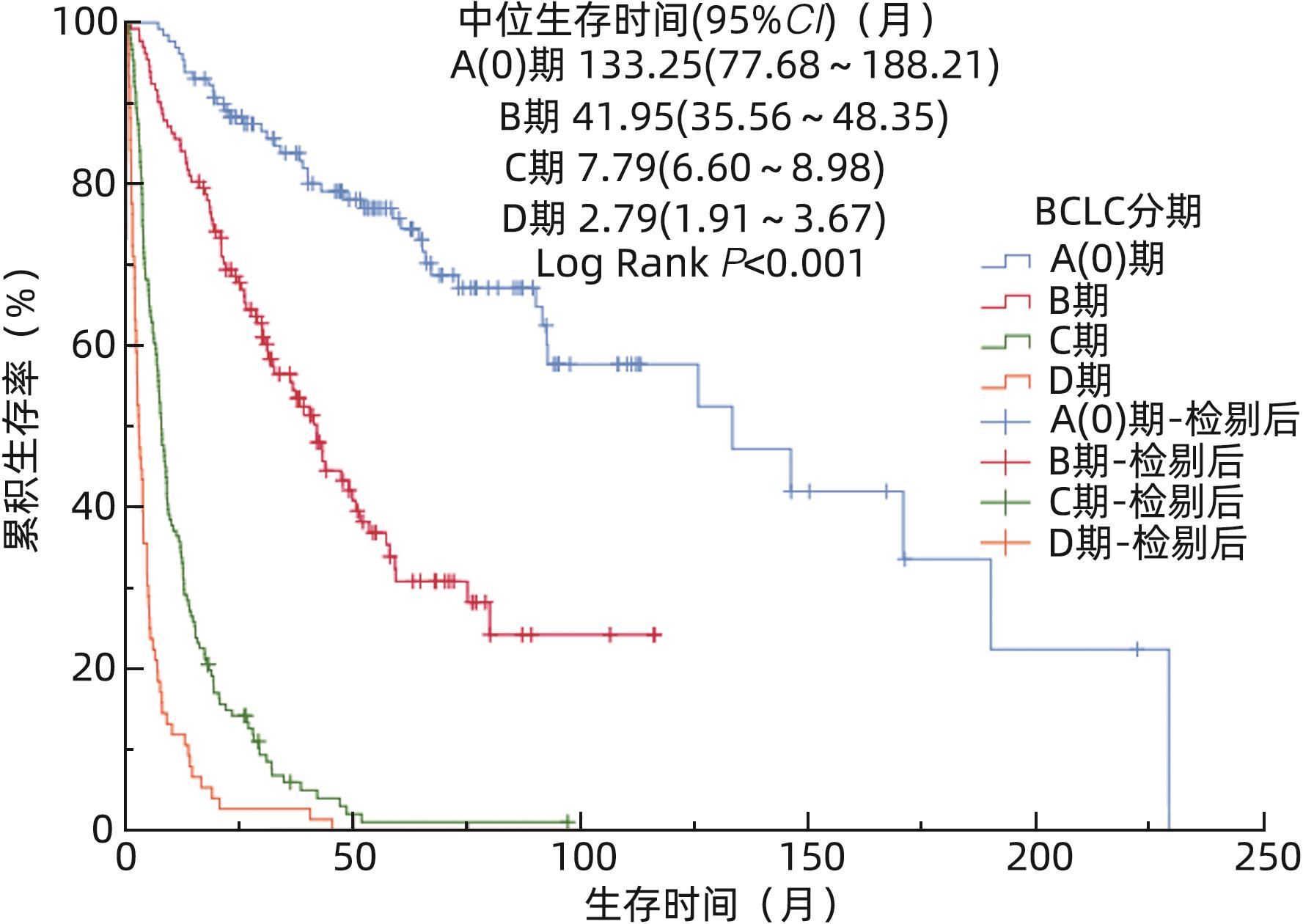
项目 例数(%) 中位生存时间(月) 95%CI χ2值 P值 累积生存率(%) 1年 3年 5年 10年 性别 0.861 0.354 男 390(79.8) 19.23 13.19~25.28 59.7 39.9 27.4 21.5 女 99(20.2) 20.84 11.79~29.89 64.6 40.1 37.2 27.3 年龄 13.452 0.009 <40岁 25(5.1) 18.15 11.49~24.81 68.0 32.0 20.0 15.0 40~49岁 78(16.0) 40.34 20.17~60.51 74.4 53.9 41.6 38.4 50~59岁 141(28.8) 18.51 3.64~33.38 54.6 42.0 30.3 24.5 60~69岁 161(32.9) 20.98 12.63~29.33 62.1 37.7 27.4 14.9 ≥70岁 84(17.2) 12.85 5.39~20.31 53.6 30.6 24.5 21.0 居住地 1.212 0.546 城市 327(66.9) 20.98 13.61~28.35 59.9 40.9 29.3 21.3 城镇 96(19.6) 20.65 10.84~30.46 66.7 40.3 32.7 27.9 农村 66(13.5) 13.94 7.82~20.06 56.1 34.7 25.1 25.1 吸烟 0.101 0.750 否 342(69.9) 19.30 13.53~25.07 62.9 39.6 29.5 22.9 是 147(30.1) 19.99 7.21~32.77 55.8 40.9 29.5 21.4 饮酒 1.739 0.187 否 342(69.9) 20.98 14.82~27.14 63.7 41.3 30.9 24.7 是 147(30.1) 14.30 7.53~21.07 53.7 36.8 25.8 14.6 病毒性肝炎 6.123 0.013 否 86(17.6) 18.51 14.86~22.16 59.3 26.1 19.2 - 是 403(82.4) 21.60 13.32~29.88 61.2 43.1 31.8 24.3 首诊前规律抗病毒1) 15.505 <0.001 否 288(71.5) 13.25 9.52~17.30 54.5 37.1 27.3 20.3 是 115(28.5) 48.08 36.05~60.09 77.4 58.0 42.8 34.6 首诊肝硬化 1.231 0.267 无 133(27.2) 20.98 6.80~35.16 60.2 44.5 31.0 29.3 有 256(72.8) 19.30 13.52~25.09 61.0 38.2 28.9 20.3 合并2型糖尿病 9.820 0.002 否 414(84.7) 22.98 16.40~29.56 62.1 43.6 31.9 24.0 是 75(14.3) 13.81 6.59~21.03 53.3 20.5 15.8 15.8 合并高血压 1.602 0.206 否 372(76.1) 21.93 15.73~28.13 61.8 41.5 30.9 23.9 是 117(23.9) 16.08 10.90~21.26 57.3 34.8 24.9 18.1 肿瘤个数2) 57.713 <0.001 ≤3个 84(49.4) 133.25 33.13~233.37 83.3 70.2 63.0 54.4 ≥4个 44(25.9) 6.97 2.24~11.71 40.9 14.4 14.4 - 巨块或弥漫性 42(24.7) 7.04 3.39~10.69 40.5 15.6 11.7 - 肿瘤最大直径3) 41.862 <0.001 ≤5 cm 53(44.9) 133.25 57.49~209.01 90.6 77.6 74.4 62.7 5~10 cm 28(23.7) 12.85 0.00~38.40 53.6 42.6 33.2 - >10 cm 37(31.4) 7.89 3.11~12.67 43.2 14.8 9.9 - 门静脉癌栓 293.909 <0.001 无 302(61.8) 57.17 44.22~70.13 82.8 61.8 47.1 36.0 有 187(38.2) 5.92 4.68~7.16 25.1 4.5 0.7 - 首诊肝外转移 118.329 <0.001 无 400(81.8) 31.17 22.93~39.41 67.8 47.9 35.8 27.5 有 89(18.2) 5.98 2.78~9.19 29.2 3.5 0.0 0.0 表 续表
Table . continued
项目 例数(%) 中位生存时间(月) 95%CI χ2值 P值 累积生存率(%) 1年 3年 5年 10年 BCLC分期 465.638 <0.001 A(0) 130(26.6) 133.25 77.68~188.82 96.2 83.9 75.8 57.7 B 132(27.0) 41.95 35.50~48.35 84.1 56.5 30.8 - C 151(30.9) 7.79 6.60~8.98 34.4 5.9 1.0 - D 76(15.5) 2.79 1.91~3.67 11.8 2.6 0.0 0.0 手术切除4) 78.860 <0.001 无 356(74.0) 12.00 9.03~14.97 50.0 27.4 18.3 10.4 有 125(26.0) 92.65 40.16~145.15 92.0 75.3 59.3 49.7 局部治疗5) 36.216 <0.001 无 188(39.4) 7.96 5.11~10.81 43.6 25.9 19.4 16.7 有 289(60.6) 32.28 24.72~39.84 71.6 48.1 34.9 25.8 靶免治疗6) 7.182 0.007 无 325(68.3) 14.33 9.87~18.79 54.2 35.9 25.8 21.3 有 151(31.7) 29.95 19.54~40.36 74.2 46.3 35.0 22.9 中药汤剂 30.050 <0.001 无 221(45.2) 9.27 6.31~12.23 46.6 27.9 21.0 16.4 有 268(54.8) 34.68 26.44~42.92 72.9 49.9 36.4 27.9 抗肿瘤综合治疗方案7) 13.221 0.004 局部+靶免 42(17.9) 20.98 13.85~28.11 66.7 30.7 23.4 0.0 局部+中药 95(40.4) 38.89 28.03~49.75 80.0 54.1 37.1 22.8 靶免+中药 22(9.4) 19.20 6.72~31.69 72.7 44.3 35.5 0.0 局部+靶免+中药 76(32.3) 53.42 28.76~78.08 85.5 63.1 46.9 41.1 注:1)403例患者进行了病毒性治疗;2)肿瘤个数共统计170例;3)肿瘤最大直径共统计118例;4)手术切除481例;5)局部治疗477例;6)靶免治疗476例;7)抗肿瘤综合治疗方案235例;-表示数据未获得。
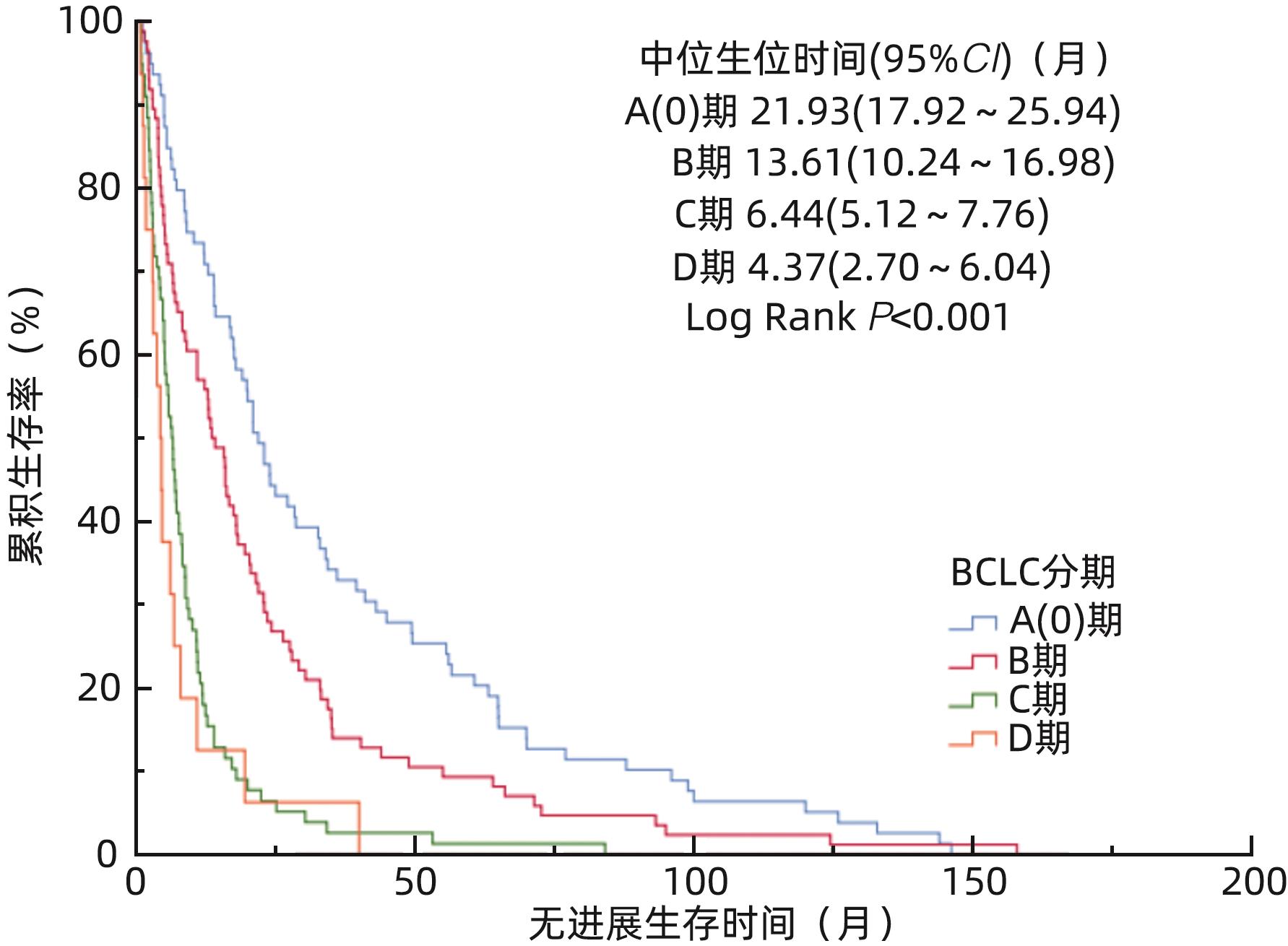
表 3 259例患者BCLC不同分期无进展生存的生存分析
Table 3. Survival analysis of 259 patients with different stages of BCLC progression-free survival
分期 例数 PFS中位生存时间(月) 95%CI 累积无进展生存率(%) 1年 3年 5年 10年 BCLC A(0) 79 21.93 17.92~25.94 73.4 34.2 21.5 6.3 BCLC B 86 13.61 10.24~16.98 57.0 14.0 9.3 2.3 BCLC C 78 6.44 5.12~7.76 17.9 2.6 1.3 0.0 BCLC D 16 4.37 2.70~6.04 12.5 6.3 0.0 0.0 -
[1] WHO. Data visualization tools for exploring the global cancer burden in 2020[EB/OL].( 2020-01-01)[ 2021-06-16]. https://gco.iarc.fr/today/home. https://gco.iarc.fr/today/home [2] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68( 6): 394- 424. DOI: 10.3322/caac.21492. [3] ZHENG RS, ZHANG SW, SUN KX, et al. Cancer statistics in China, 2016[J]. Chin J Oncol, 2023, 45( 3): 212- 220. DOI: 10.3760/cma.j.cn112152-20220922-00647.郑荣寿, 张思维, 孙可欣, 等. 2016年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2023, 45( 3): 212- 220. DOI: 10.3760/cma.j.cn112152-20220922-00647. [4] VOGEL A, MEYER T, SAPISOCHIN G, et al. Hepatocellular carcinoma[J]. Lancet, 2022, 400( 10360): 1345- 1362. DOI: 10.1016/s0140-6736(22)01200-4. [5] MARTEL CD, GEORGES D, BRAY F, et al. Global burden of cancer attributable to infections in 2018: A worldwide incidence analysis[J]. Lancet Glob Health, 2020, 8( 2): e180- e190. DOI: 10.1016/S2214-109X(19)30488-7. [6] TSILIMIGRAS DI, BAGANTE F, SAHARA K, et al. Prognosis after resection of Barcelona clinic liver cancer(BCLC) stage 0, A, and B hepatocellular carcinoma: A comprehensive assessment of the current BCLC classification[J]. Ann Surg Oncol, 2019, 26( 11): 3693- 3700. DOI: 10.1245/s10434-019-07580-9. [7] Specialist Group of Interventional Drugs, Interventionalists Branch of Chinese Medical Doctor Association. Chinese expert consensus on intra-arterial drug and combined drug administration for primary hepatocellular carcinoma[J]. Chin J Intern Med, 2023, 62( 7): 785- 801. DOI: 10.3760/cma.j.cn112138-20230202-00049.中国医师协会介入医师分会介入药物专业组. 原发性肝细胞癌经动脉内用药与联合用药中国专家共识[J]. 中华内科杂志, 2023, 62( 7): 785- 801. DOI: 10.3760/cma.j.cn112138-20230202-00049. [8] General Office of National Health Commission. Standard for diagnosis and treatment of primary liver cancer(2022 edition)[J]. J Clin Hepatol, 2022, 38( 2): 288- 303. DOI: 10.3969/j.issn.1001-5256.2022.02.009.国家卫生健康委办公厅. 原发性肝癌诊疗指南(2022年版)[J]. 临床肝胆病杂志, 2022, 38( 2): 288- 303. DOI: 10.3969/j.issn.1001-5256.2022.02.009. [9] PETRICK JL, FLORIO AA, ZNAOR A, et al. International trends in hepatocellular carcinoma incidence, 1978-2012[J]. Int J Cancer, 2020, 147( 2): 317- 330. DOI: 10.1002/ijc.32723. [10] LI QR, CAO MM, LEI L, et al. Burden of liver cancer: From epidemiology to prevention[J]. Chin J Cancer Res, 2022, 34( 6): 554- 566. DOI: 10.21147/j.issn.1000-9604.2022.06.02. [11] YANG JD, HAINAUT P, GORES GJ, et al. A global view of hepatocellular carcinoma: Trends, risk, prevention and management[J]. Nat Rev Gastroenterol Hepatol, 2019, 16( 10): 589- 604. DOI: 10.1038/s41575-019-0186-y. [12] CAO MM, DING C, XIA CF, et al. Attributable deaths of liver cancer in China[J]. Chin J Cancer Res, 2021, 33( 4): 480- 489. DOI: 10.21147/j.issn.1000-9604.2021.04.05. [13] HUANG DQ, TRAN A, YEH ML, et al. Antiviral therapy substantially reduces HCC risk in patients with chronic hepatitis B infection in the indeterminate phase[J]. Hepatology, 2023, 78( 5): 1558- 1568. DOI: 10.1097/HEP.0000000000000459. [14] WOJCIECHOWSKA J, KRAJEWSKI W, BOLANOWSKI M, et al. Diabetes and cancer: A review of current knowledge[J]. Exp Clin Endocrinol Diabetes, 2016, 124( 5): 263- 275. DOI: 10.1055/s-0042-100910. [15] MAK LY, HUI RW, LEE CH, et al. Glycemic burden and the risk of adverse hepatic outcomes in patients with chronic hepatitis B with type 2 diabetes[J]. Hepatology, 2023, 77( 2): 606- 618. DOI: 10.1002/hep.32716. [16] YOU YL, DENG MH, GONG JP. The association between type 2 diabetes mellitus and hepatocellular carcinoma[J]. J Clin Hepatol, 2018, 34( 8): 1793- 1796. DOI: 10.3969/j.issn.1001-5256.2018.08.045.游宇来, 邓明华, 龚建平. 2型糖尿病与肝细胞癌的关系[J]. 临床肝胆病杂志, 2018, 34( 8): 1793- 1796. DOI: 10.3969/j.issn.1001-5256.2018.08.045. [17] WANG L, XIAN YT, YANG ZQ, et al. Effect and factor analysis of different treatment strategies on prognosis of advanced hepatocellular carcinoma patients[J/CD]. Chin J Interv Radiol Electron Ed, 2018, 6( 2): 104- 108. DOI: 10.3877/cma.j.issn.2095-5782.2018.02.003.王磊, 咸玉涛, 杨正强, 等. 不同治疗方案对晚期肝细胞性肝癌预后的影响及因素分析[J/CD]. 中华介入放射学电子杂志, 2018, 6( 2): 104- 108. DOI: 10.3877/cma.j.issn.2095-5782.2018.02.003. [18] JUN TW, YEH ML, YANG JD, et al. More advanced disease and worse survival in cryptogenic compared to viral hepatocellular carcinoma[J]. Liver Int, 2018, 38( 5): 895- 902. DOI: 10.1111/liv.13613. [19] HE YJ, ZHANG ZM, HE WM, et al. Epidemiological characteristics and prognosis of hepatocellular carcinoma: A single-center observational real-world cohort study of 1 302 cases[J]. J Clin Hepatol, 2019, 35( 5): 1002- 1007. DOI: 10.3969/j.issn.1001-5256.2019.05.014.何雅婧, 张植明, 何伟猛, 等. 1 302例单中心观察性肝细胞癌真实世界队列的流行病学特征与预后[J]. 临床肝胆病杂志, 2019, 35( 5): 1002- 1007. DOI: 10.3969/j.issn.1001-5256.2019.05.014. [20] LIU QG, SONG T, WANG HH. Re-understanding of surgical resection techniques for liver cancer[J]. Chin J Dig Surg, 2024, 23( 1): 75- 79. DOI: 10.3760/cma.j.cn115610-20231214-00253.刘青光, 宋涛, 王欢欢. 肝癌外科手术切除技术的再认识[J]. 中华消化外科杂志, 2024, 23( 1): 75- 79. DOI: 10.3760/cma.j.cn115610-20231214-00253. [21] SHI K, BI Y, ZENG X, et al. Effects of adjuvant huaier granule therapy on survival rate of patients with hepatocellular carcinoma[J]. Front Pharmacol, 2023, 14: 1163304. DOI: 10.3389/fphar.2023.1163304. -



 PDF下载 ( 1142 KB)
PDF下载 ( 1142 KB)

 下载:
下载: