巨噬细胞在原发性胆汁性胆管炎发生发展中的作用
DOI: 10.12449/JCH240932
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:邓宗柒负责收集资料及文章撰写;邰文琳负责文章修改及定稿。
Role of macrophages in the development and progression of primary biliary cholangitis
-
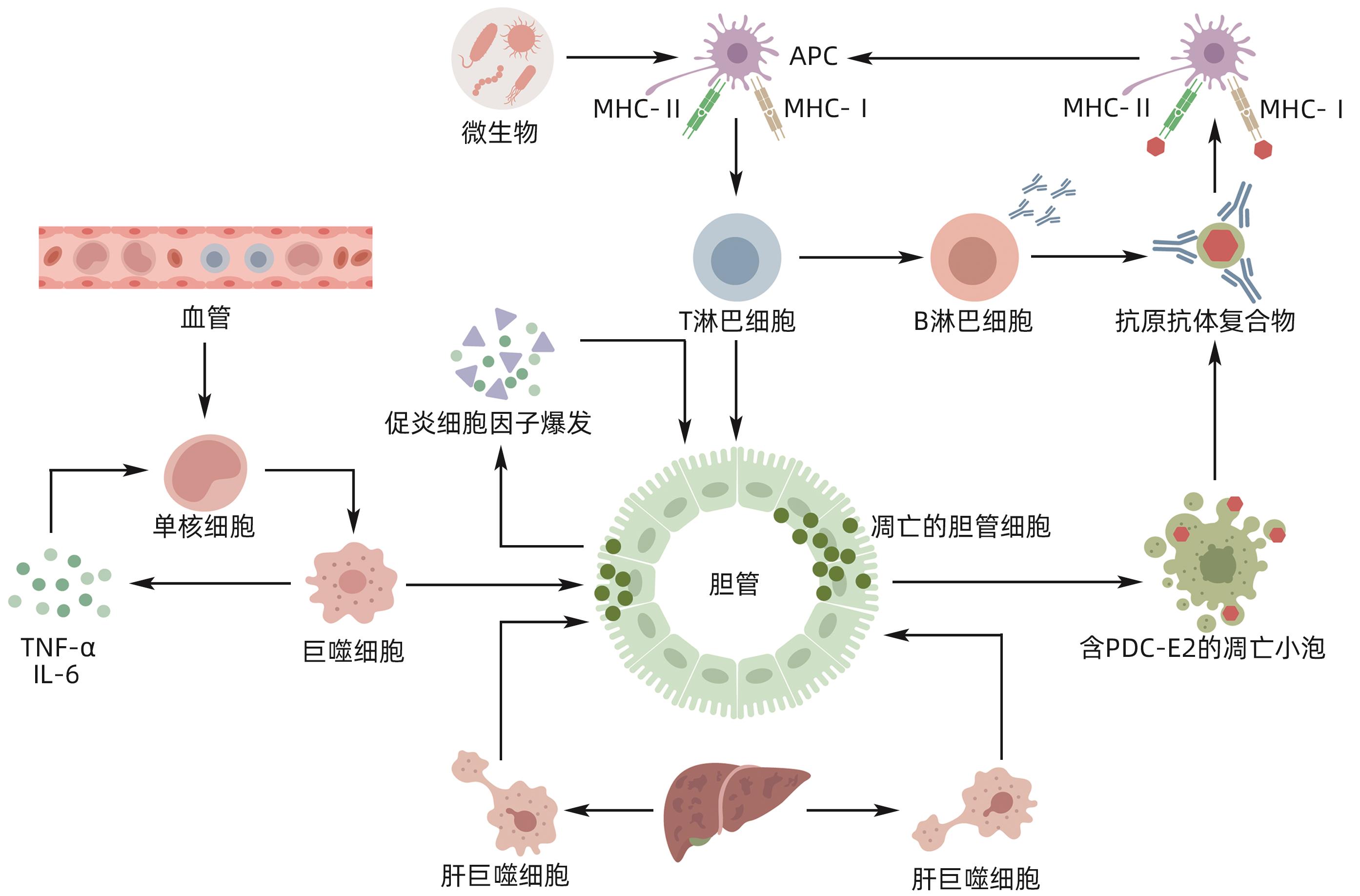
摘要: 原发性胆汁性胆管炎(PBC)是一种持续的炎症性自身免疫性肝病,以肝内小胆管炎症损伤和胆汁淤积为主要特征。目前,PBC的确切发病机制尚不清楚,但一致认为PBC是多种因素协同作用的结果。而在与PBC相关的免疫和炎症级联反应中,巨噬细胞作为必不可少的免疫细胞出现,积极参与对胆管上皮细胞的损伤。本文介绍了巨噬细胞在PBC中的来源定位及异质性变化,综述了巨噬细胞在PBC发病机制中的潜在作用。Abstract: Primary biliary cholangitis (PBC) is a persistent inflammatory autoimmune liver disease characterized by inflammatory injury and cholestasis in the small intrahepatic bile ducts. At present, the exact pathogenesis of PBC remains unknown, but a consensus has been reached on the fact that PBC is the result of the synergistic effect of various factors. In the cascade of immune and inflammatory reactions associated with PBC, macrophages appear as essential immune cells and actively participate in the damage to bile duct epithelial cells. This article introduces the origin and heterogeneity of macrophages in PBC and reviews the potential role of macrophages in the pathogenesis of PBC.
-
Key words:
- Primary Biliary Cholangitis /
- Monocyte /
- Macrophage /
- Pathologic Processes
-
[1] GIANNINI EG, PIERI G, LABANCA S, et al. Characteristics and survival of patients with primary biliary cholangitis and hepatocellular carcinoma[J]. Dig Liver Dis, 2022, 54( 9): 1215- 1221. DOI: 10.1016/j.dld.2022.03.002. [2] TRIVEDI PJ, HIRSCHFIELD GM. Recent advances in clinical practice: epidemiology of autoimmune liver diseases[J]. Gut, 2021, 70( 10): 1989- 2003. DOI: 10.1136/gutjnl-2020-322362. [3] CHEN R, TANG R, MA X, et al. Immunologic responses and the pathophysiology of primary biliary cholangitis[J]. Clin Liver Dis, 2022, 26( 4): 583- 611. DOI: 10.1016/j.cld.2022.06.003. [4] XIANG B, DENG C, QIU F, et al. Single cell sequencing analysis identifies genetics-modulated ORMDL3+ cholangiocytes having higher metabolic effects on primary biliary cholangitis[J]. J Nanobiotechnology, 2021, 19( 1): 406. DOI: 10.1186/s12951-021-01154-2. [5] YOU H, MA X, EFE C, et al. APASL clinical practice guidance: the diagnosis and management of patients with primary biliary cholangitis[J]. Hepatol Int, 2022, 16( 1): 1- 23. DOI: 10.1007/s12072-021-10276-63. [6] ZHANG X, THOMPKINS-JOHNS A, ZIOBER A, et al. Hepatic macrophage types cluster with disease etiology in chronic liver disease and differ compared to normal liver: implications for their biologic and diagnostic role[J]. Int J Surg Pathol, 2023, 31( 3): 268- 279. DOI: 10.1177/10668969221099630. [7] WEN Y, LAMBRECHT J, JU C, et al. Hepatic macrophages in liver homeostasis and diseases-diversity, plasticity and therapeutic opportunities[J]. Cell Mol Immunol, 2021, 18( 1): 45- 56. DOI: 10.1038/s41423-020-00558-8. [8] WANG C, MA C, GONG L, et al. Macrophage polarization and its role in liver disease[J]. Front Immunol, 2021, 12: 803037. doi: 10.3389/fimmu.2021.803037. [9] PENG A, KE P, ZHAO R, et al. Elevated circulating CD14lowCD16+ monocyte subset in primary biliary cirrhosis correlates with liver injury and promotes Th1 polarization[J]. Clin Exp Med, 2016, 16( 4): 511- 521. DOI: 10.1007/s10238-015-0381-2. [10] ZHAO J, ZHAO S, ZHOU G, et al. Altered biliary epithelial cell and monocyte responses to lipopolysaccharide as a TLR ligand in patients with primary biliary cirrhosis[J]. Scand J Gastroenterol, 2011, 46( 4): 485- 494. DOI: 10.3109/00365521.2010.539624. [11] REUVENI D, BREZIS MR, BRAZOWSKI E, et al. Interleukin 23 produced by hepatic monocyte-derived macrophages is essential for the development of murine primary biliary cholangitis[J]. Front Immunol, 2021, 12: 718841. DOI: 10.3389/fimmu.2021.718841. [12] XU J, GUO J, PU XW, et al. Effect of lncRNA-MIAT on M2-type polarization of tumor-associated macrophages and its mechanism[J]. J Jilin Univ(Med Edit), 2022, 48( 6): 1462- 1473. DOI: 10.13481/j.1671-587X.20220612.许静, 郭健, 蒲兴魏, 等. lncRNA-MIAT对肿瘤相关巨噬细胞M2型极化的作用及其机制[J]. 吉林大学学报(医学版), 2022, 48( 6): 1462- 1473. DOI: 10.13481/j.1671-587X.20220612. [13] LIANG Y, QIN BD, SHI H, et al. Polarization analysis of peripheral blood mononuclear cells in patients with primary biliary cholangitis[J]. Chin J Clin Lab Sci, 2018, 36( 10): 725- 728. DOI: 10.13602/j.cnki.jcls.2018.10.02.梁艳, 秦保东, 史虹, 等. 原发性胆汁性胆管炎患者外周血单核细胞极化分析[J]. 临床检验杂志, 2018, 36( 10): 725- 728. DOI: 10.13602/j.cnki.jcls.2018.10.02. [14] XU JM. Tim-3/Galectin-9 pathway regulates macrophage involvement in primary biliary cholangitis[D]. Kunming: Kunming Medical University, 2023.徐加敏. Tim-3/Galectin-9通路调控巨噬细胞参与原发性胆汁性胆管炎的研究[D]. 昆明: 昆明医科大学, 2023. [15] FU HY, XU JM, AI X, et al. The clostridium metabolite P-cresol sulfate relieves inflammation of primary biliary cholangitis by regulating kupffer cells[J]. Cells, 2022, 11( 23): 3782. DOI: 10.3390/cells11233782. [16] RONCA V, MANCUSO C, MILANI C, et al. Immune system and cholangiocytes: A puzzling affair in primary biliary cholangitis[J]. J Leukoc Biol, 2020, 108( 2): 659- 671. DOI: 10.1002/JLB.5MR0320-200R. [17] WANG Q, WANG Y, QIAO W, et al. The effect of serum IL-2 levels on the prognosis of primary biliary cholangitis-related liver failure and the preliminary exploration of its mechanism[J]. Front Immunol, 2022, 13: 995223. DOI: 10.3389/fimmu.2022.995223. [18] BOSSEN L, REBORA P, BERNUZZI F, et al. Soluble CD163 and mannose receptor as markers of liver disease severity and prognosis in patients with primary biliary cholangitis[J]. Liver Int, 2020, 40( 6): 1408- 1414. DOI: 10.1111/liv.14466. [19] FUJINAGA Y, NAMISAKI T, TSUJI Y, et al. Macrophage activation markers predict liver-related complications in primary biliary cholangitis[J]. Int J Mol Sci, 2022, 23( 17): 9814. DOI: 10.3390/ijms23179814. [20] GAO LL, ZHANG YJ, GAO XS, et al. Analysis of differential expression of lncRNA and mRNA in liver tissue of female primary biliary cholangitis patients with poor response to ursodeoxycholic acid[J/CD]. Chin J Liver Dis(Electronic Version), 2023, 15( 2): 47- 53. DOI: 10.3969/j.issn.1674-7380.2023.02.008.高丽丽, 张亦瑾, 高学松, 等. 熊去氧胆酸应答不佳原发性胆汁性胆管炎女性患者肝组织lncRNA、mRNA差异表达分析[J/CD]. 中国肝脏病杂志(电子版), 2023, 15( 2): 47- 53. DOI: 10.3969/j.issn.1674-7380.2023.02.008.. [21] JOHN BV, KHAKOO NS, SCHWARTZ KB, et al. Ursodeoxycholic acid response is associated with reduced mortality in primary biliary cholangitis with compensated cirrhosis[J]. Am J Gastroenterol, 2021, 116( 9): 1913- 1923. DOI: 10.14309/ajg.0000000000001280. [22] ALMISHRI W, SWAIN LA, D’MELLO C, et al. ADAM metalloproteinase domain 17 regulates cholestasis-associated liver injury and sickness behavior development in mice[J]. Front Immunol, 2021, 12: 779119. DOI: 10.3389/fimmu.2021.779119. [23] BOSSEN L, LAU TS, NIELSEN MB, et al. The association between soluble CD163, disease severity, and ursodiol treatment in patients with primary biliary cholangitis[J]. Hepatol Commun, 2023, 7( 4). DOI: 10.1097/HC9.0000000000000068. [24] YANG P, LIU L, SUN L, et al. Immunological feature and transcriptional signaling of Ly6C monocyte subsets from transcriptome analysis in control and hyperhomocysteinemic mice[J]. Front Immunol, 2021, 12: 632333. DOI: 10.3389/fimmu.2021.632333. [25] LEVY C, MANNS M, HIRSCHFIELD G. New treatment paradigms in primary biliary cholangitis[J]. Clin Gastroenterol Hepatol, 2023, 21( 8): 2076- 2087. DOI: 10.1016/j.cgh.2023.02.005. [26] OTSUKA M, EGAWA G, KABASHIMA K. Uncovering the mysteries of langerhans cells, inflammatory dendritic epidermal cells, and monocyte-derived langerhans cell-like cells in the epidermis[J]. Front Immunol, 2018, 9: 1768. DOI: 10.3389/fimmu.2018.01768. [27] HARADA K, SHIMODA S, IKEDA H, et al. Significance of periductal Langerhans cells and biliary epithelial cell-derived macrophage inflammatory protein-3α in the pathogenesis of primary biliary cirrhosis[J]. Liver Int, 2011, 31( 2): 245- 253. DOI: 10.1111/j.1478-3231.2010.02367.x. [28] GUILLOT A, WINKLER M, SILVA AFONSO M, et al. Mapping the hepatic immune landscape identifies monocytic macrophages as key drivers of steatohepatitis and cholangiopathy progression[J]. Hepatology, 2023, 78( 1): 150- 166. DOI: 10.1097/HEP.0000000000000270. [29] KOUROUMALIS E, TSOMIDIS I, VOUMVOURAKI A. Interplay of autophagy, apoptosis, and senescence in primary biliary cholangitis[J]. Explor Dig Dis, 2023, 2: 223- 245. DOI: 10.37349/edd.2023.00028.. [30] FU HY, BAO WM, YANG CX, et al. Kupffer cells regulate natural killer cells via the nk group 2, member D(NKG2D)/retinoic acid early inducible-1(RAE-1) interaction and cytokines in a primary biliary cholangitis mouse model[J]. Med Sci Monit, 2020, 26: e923726. DOI: 10.12659/MSM.923726. [31] SASAKI M, KAKUDA Y, MIYAKOSHI M, et al. Infiltration of inflammatory cells expressing mitochondrial proteins around bile ducts and in biliary epithelial layer may be involved in the pathogenesis in primary biliary cirrhosis[J]. J Clin Pathol, 2014, 67( 6): 470- 476. DOI: 10.1136/jclinpath-2013-201917. [32] WITHEREL CE, SAO K, BRISSON BK, et al. Regulation of extracellular matrix assembly and structure by hybrid M1/M2 macrophages[J]. Biomaterials, 2021, 269: 120667. DOI: 10.1016/j.biomaterials.2021.120667. [33] ZUO T, XIE Q, LIU J, et al. Macrophage-derived cathepsin S remodels the extracellular matrix to promote liver fibrogenesis[J]. Gastroenterology, 2023, 165( 3): 746- 761. e 16. DOI: 10.1053/j.gastro.2023.05.039. -



 PDF下载 ( 838 KB)
PDF下载 ( 838 KB)

 下载:
下载:


