中药复方逆转肝纤维化及早期肝硬化的作用机制
DOI: 10.12449/JCH240924
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:张鹏负责课题设计,资料分析,撰写论文;郑世豪、苟思媛、谢金池、杨先照参与检索文献、修改论文;张鹏、叶永安拟定写作思路并最后定稿。
The mechanism of compound traditional Chinese medicine prescriptions in reversal of liver fibrosis and early liver cirrhosis
-
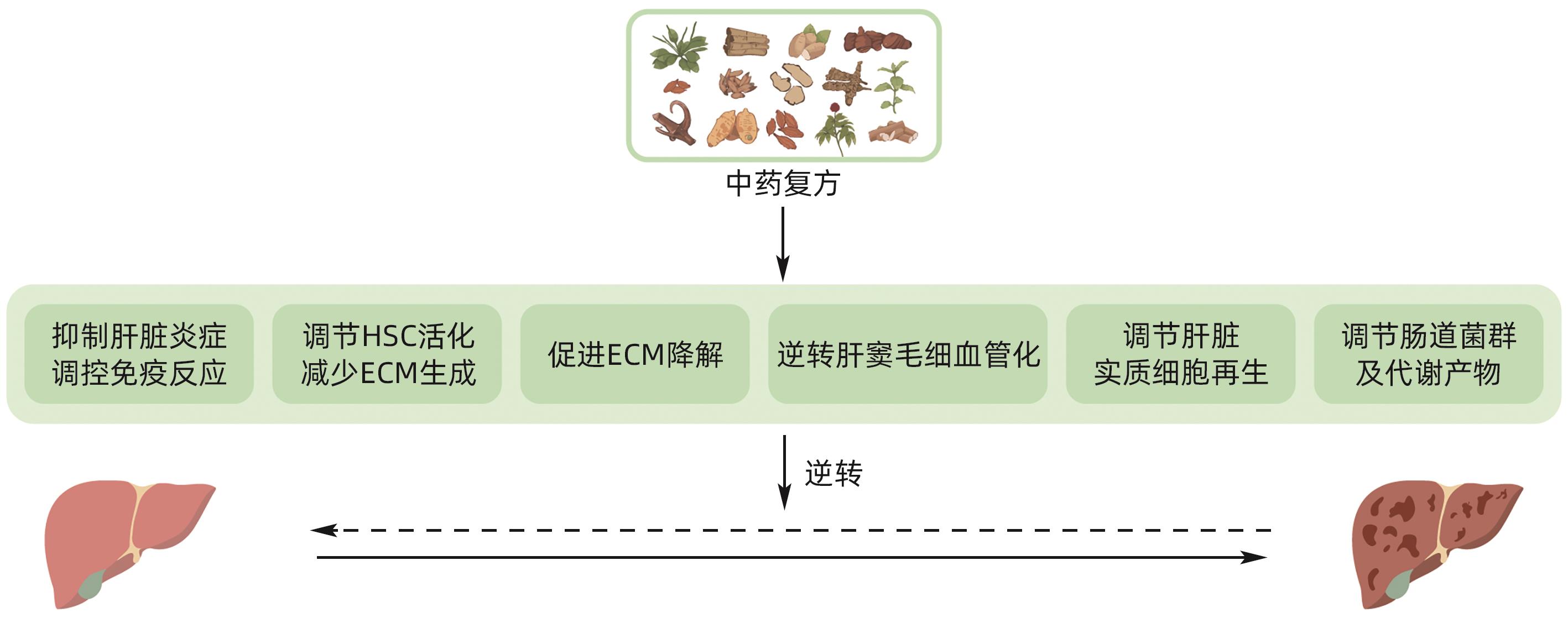
摘要: 肝纤维化、肝硬化是多种慢性肝病进展后的共同结局。研究表明,肝纤维化及一定程度的肝硬化是可以逆转的。中药复方逆转肝纤维化、早期肝硬化疗效确切,但作用机制尚未完全明确。本文通过梳理国内外相关文献,总结了中药复方起效涉及的6个主要机制表型(即抑制肝脏炎症与调控免疫,调控肝星状细胞活化及细胞外基质生成,促进细胞外基质降解,逆转肝窦毛细血管化,调控肝脏细胞再生以及调节肠道菌群),并分析了各个表型领域研究的进展与不足。未来中药复方研究可围绕上述表型进行实验探索和验证,对有确切作用的表型上下游信号进一步深入探究。本文旨在帮助厘清中药复方疗效机制研究的方向和思路,为阐明中药复方科学实质提供依据。Abstract: Liver fibrosis and cirrhosis are the common outcomes of various chronic liver diseases after progression, and studies have shown that liver fibrosis and early liver cirrhosis can be reversed. Compound traditional Chinese medicine prescriptions have a marked therapeutic effect in reversing liver fibrosis and early liver cirrhosis, and their mechanism of action remains unclear. By reviewing related articles in China and globally, this article summarizes the six main phenotypic mechanisms involved in the efficacy of compound traditional Chinese medicine prescriptions, i.e., inhibiting liver inflammation and regulating liver immune response, regulating hepatic stellate cell activation and extracellular matrix (ECM) generation, promoting ECM degradation, reversing hepatic sinusoidal capillarization, regulating hepatocyte regeneration, and regulating gut microbiota, and in addition, this article also analyzes the advances and shortcomings in current studies on each phenotype. Future studies on compound traditional Chinese medicine prescriptions should focus on experimental exploration and rescue experiments to verify the above phenotypes and further explore the upstream and downstream signaling pathways with a marked effect. This article aims to help clarify the direction and ideas of studies on the therapeutic mechanism of compound traditional Chinese medicine prescriptions, in order to provide a basis for clarifying the scientific essence of compound traditional Chinese medicine prescriptions.
-
Key words:
- Liver Fibrosis /
- Liver Cirrhosis /
- Drugs, Chinese Herbal
-
[1] GARCIA-TSAO G, FRIEDMAN S, IREDALE J, et al. Now there are many(stages) where before there was one: in search of a pathophysiological classification of cirrhosis[J]. Hepatol, 2010, 51( 4): 1445- 1449. DOI: 10.1002/hep.23478. [2] CHEUNG F, FENG Y, WANG N, et al. Effectiveness of Chinese herbal medicine in treating liver fibrosis: a systematic review and meta-analysis of randomized controlled trials[J]. Chin Med, 2012, 7( 1): 5. DOI: 10.1186/1749-8546-7-5. [3] LIU YQ, ZHANG C, LI JW, et al. An-Luo-Hua-Xian Pill improves the regression of liver fibrosis in chronic hepatitis B patients treated with entecavir[J]. J Clin Transl Hepatol, 2023, 11( 2): 304- 313. DOI: 10.14218/JCTH.2022.00091. [4] RONG G, CHEN Y, YU Z, et al. Synergistic effect of Biejia-Ruangan on fibrosis regression in patients with chronic hepatitis B treated with entecavir:A multicenter,randomized,double-blind,placebo-controlled trial[J]. J Infect Dis, 2022, 225( 6): 1091- 1099. DOI: 10.1093/infdis/jiaa266. [5] HAMMERICH L, TACKE F. Hepatic inflammatory responses in liver fibrosis[J]. Nat Rev Gastroenterol Hepatol, 2023, 20( 10): 633- 646. DOI: 10.1038/s41575-023-00807-x. [6] GAO CC, BAI J, HAN H, et al. The versatility of macrophage heterogeneity in liver fibrosis[J]. Front Immunol, 2022, 13: 968879. DOI: 10.3389/fimmu.2022.968879. [7] SAVAGE TM, FORTSON KT, de LOS SANTOS-ALEXIS K, et al. Amphiregulin from regulatory T cells promotes liver fibrosis and insulin resistance in non-alcoholic steatohepatitis[J]. Immunity, 2024, 57( 2): 303- 318. DOI: 10.1016/j.immuni.2024.01.009. [8] JIAO J, SASTRE D, FIEL MI, et al. Dendritic cell regulation of carbon tetrachloride-induced murine liver fibrosis regression[J]. Hepatol, 2012, 55( 1): 243- 255. DOI: 10.1002/hep.24621. [9] DUAN BW, LIU YJ, LI XN, et al. An autologous macrophage-based phenotypic transformation-collagen degradation system treating advanced liver fibrosis[J]. Adv Sci(Weinh), 2023, 11( 7): e2306899. DOI: 10.1002/advs.202306899. [10] HOU C, WANG D, ZHAO M, et al. MANF brakes TLR4 signaling by competitively binding S100A8 with S100A9 to regulate macrophage phenotypes in hepatic fibrosis[J]. Acta Pharm Sin B, 2023, 13( 10): 4234- 4252. DOI: 10.1016/j.apsb.2023.07.027. [11] MORONI F, DWYER BJ, GRAHAM C, et al. Safety profile of autologous macrophage therapy for liver cirrhosis[J]. Nat Med, 2019, 25( 10): 1560- 1565. DOI: 10.1038/s41591-019-0599-8. [12] ZHAO ZM, ZHU CW, HUANG JQ, et al. Efficacy and safety of Fuzheng Huayu tablet on persistent advanced liver fibrosis following 2 years entecavir treatment: A single arm clinical objective performance criteria trial[J]. J Ethnopharmacol, 2022, 298: 115599. DOI: 10.1016/j.jep.2022.115599. [13] DONG S, CAI FF, CHEN QL, et al. Chinese herbal formula Fuzheng Huayu alleviates CCl4-induced liver fibrosis in rats: a transcriptomic and proteomic analysis[J]. Acta Pharmacol Sin, 2018, 39( 6): 930- 941. DOI: 10.1038/aps.2017.150. [14] LIU C, HU Y, XU L, et al. Effect of Fuzheng Huayu formula and its actions against liver fibrosis[J]. Chin Med, 2009, 4: 12. DOI: 10.1186/1749-8546-4-12. [15] TAO YY, YAN XC, ZHOU T, et al. Fuzheng Huayu recipe alleviates hepatic fibrosis via inhibiting TNF-alpha induced hepatocyte apoptosis[J]. BMC Complement Altern Med, 2014, 14: 449. DOI: 10.1186/1472-6882-14-449. [16] PING D, QI J, LI M, et al. Fuzheng Huayu recipe alleviates liver fibrosis via inhibiting NLRP3 inflammasome activation in macrophages[J]. J Ethnopharmacol, 2024, 318( Pt B): 117001. DOI: 10.1016/j.jep.2023.117001. [17] ZHANG M, LIU HL, HUANG K, et al. Fuzheng Huayu Recipe prevented and treated CCl4-induced mice liver fibrosis through regulating polarization and chemotaxis of intrahepatic macrophages via CCL2 and CX3CL1[J]. Evid Based Complement Alternat Med, 2020, 2020: 8591892. DOI: 10.1155/2020/8591892. [18] CHENG Q, LI N, CHEN M, et al. Fuzheng Huayu inhibits carbon tetrachloride-induced liver fibrosis in mice through activating hepatic NK cells[J]. J Ethnopharmacol, 2013, 145( 1): 175- 181. DOI: 10.1016/j.jep.2012.10.047. [19] MA Z, XUE X, BAI J, et al. Si-Wu-Tang ameliorates bile duct ligation-induced liver fibrosis via modulating immune environment[J]. Biomed Pharmacother, 2022, 155: 113834. DOI: 10.1016/j.biopha.2022.113834. [20] ZHENG Y, JI S, LI X, et al. Qijia rougan formula ameliorates ECM deposition in hepatic fibrosis by regulating the JAK1/STAT6-microRNA-23a feedback loop in macrophage M2 polarization[J]. Biomed Pharmacother, 2023, 168: 115794. DOI: 10.1016/j.biopha.2023.115794. [21] MO C, XIE SW, GAO L, et al. Baoganning formula alleviates liver fibrosis in mice by inhibiting hepatic IDO1 expression and promoting phenotypic maturation of dendritic cells[J]. J South Med Univ, 2021, 41( 7): 1002- 1011. DOI: 10.12122/j.issn.1673-4254.2021.07.06.莫婵, 谢淑雯, 高磊, 等. 复方保肝宁减轻小鼠肝纤维化的机制:抑制肝脏组织中的IDO1进而促进树突状细胞表型成熟[J]. 南方医科大学学报, 2021, 41( 7): 1002- 1011. DOI: 10.12122/j.issn.1673-4254.2021.07.06. [22] LU W, GAO YH, WANG ZZ, et al. Effects of Anluohuaxianwan on transforming growth factor-β1 and related signaling pathways in rats with carbon liver fibrosis[J]. Chin J Hepatol, 2017, 25( 4): 257- 262. DOI: 10.3760/cma.j.issn.1007-3418.2017.04.005.卢玮, 高玉华, 王珍子, 等. 安络化纤丸对肝纤维化大鼠转化生长因子β1及相应信号通路的影响[J]. 中华肝脏病杂志, 2017, 25( 4): 257- 262. DOI: 10.3760/cma.j.issn.1007-3418.2017.04.005. [23] YANG FR, FANG BW, LOU JS. Effects of Fufang Biejia Ruangan pills on hepatic fibrosis in vivo and in vitro[J]. World J Gastroenterol, 2013, 19( 32): 5326- 5333. DOI: 10.3748/wjg.v19.i32.5326. [24] HIGASHI T, FRIEDMAN SL, HOSHIDA Y. Hepatic stellate cells as key target in liver fibrosis[J]. Adv Drug Deliv Rev, 2017, 121: 27- 42. DOI: 10.1016/j.addr.2017.05.007. [25] KONG M, ZHOU J, KANG A, et al. Histone methyltransferase Suv39h1 regulates hepatic stellate cell activation and is targetable in liver fibrosis[J]. Gut, 2024, gutjnl-2023- 329671. DOI: 10.1136/gutjnl-2023-329671. [26] GU L, ZHAO C, WANG Y, et al. Senescence of hepatic stellate cells by specific delivery of manganese for limiting liver fibrosis[J]. Nano Lett, 2024, 24( 4): 1062- 1073. DOI: 10.1021/acs.nanolett.3c03689. [27] WU K, LIU Y, XIA J, et al. Loss of SLC27A5 activates hepatic stellate cells and promotes liver fibrosis via unconjugated cholic acid[J]. Adv Sci(Weinh), 2024, 11( 2): e2304408. DOI: 10.1002/advs.202304408. [28] ZHONG L, ZHAO J, HUANG L, et al. Runx2 activates hepatic stellate cells to promote liver fibrosis via transcriptionally regulating Itgav expression[J]. Clin Transl Med, 2023, 13( 7): e1316. DOI: 10.1002/ctm2.1316. [29] XING X, CHEN S, LI L, et al. The active components of Fuzheng Huayu Formula and their potential mechanism of action in inhibiting the hepatic stellate cells viability-A network pharmacology and transcriptomics approach[J]. Front Pharmacol, 2018, 9: 525. DOI: 10.3389/fphar.2018.00525. [30] PING DB, SUN X, PENG Y, et al. Cyp4a12-mediated retinol metabolism in stellate cells is the antihepatic fibrosis mechanism of the Chinese medicine Fuzheng Huayu recipe[J]. Chin Med, 2023, 18( 1): 51. DOI: 10.1186/s13020-023-00754-4. [31] LI XM, PENG JH, SUN ZL, et al. Chinese medicine CGA formula ameliorates DMN-induced liver fibrosis in rats via inhibiting MMP2/9, TIMP1/2 and the TGF-β/Smad signaling pathways[J]. Acta Pharmacol Sin, 2016, 37( 6): 783- 793. DOI: 10.1038/aps.2016.35. [32] QI J, PING D, SUN X, et al. A herbal product inhibits carbon tetrachloride-induced liver fibrosis by suppressing the epidermal growth factor receptor signaling pathway[J]. J Ethnopharmacol, 2023, 311: 116419. DOI: 10.1016/j.jep.2023.116419. [33] SONG SL, GONG ZJ, HUANG YQ, et al. JinSanE decoction, a chinese herbal medicine, inhibits expression of TGF-beta1/Smads in experimental hepatic fibrosis in rats[J]. Am J Chin Med, 2006, 34( 6): 1047- 1061. DOI: 10.1142/S0192415X0600451X. [34] SHAO C, XU H, SUN X, et al. Jiawei Taohe Chengqi decoction inhibition of the notch signal pathway affects macrophage reprogramming to inhibit HSCs activation for the treatment of hepatic fibrosis[J]. J Ethnopharmacol, 2023, 321: 117486. DOI: 10.1016/j.jep.2023.117486. [35] MA H, WANG BE, MA XM, et al. Effects of compound 861 on rat hepatic stellate cell collagen synthesis and degradation in vitro[J]. Chin J Hepatol, 1999, 7( S1): 30- 32.马红, 王宝恩, 马雪梅, 等. 复方861对大鼠肝星状细胞胶原合成及降解干预作用的体外研究[J]. 中华肝脏病杂志, 1999, 7( S1): 30- 32. [36] JIAO YT, YANG XZ, LIU RJ, et al. Kangxianyiai decoction alleviate liver fibrosis rats by affecting hepatic stellate cell[J]. LISHIZHEN MEDICINE AND MATERIA MEDICA RESEARCH, 2017, 28( 5): 1099- 1101.焦云涛, 杨先照, 刘蕊洁, 等. 抗纤抑癌方干预肝纤维化大鼠肝星状细胞活化的实验研究[J]. 时珍国医国药, 2017, 28( 5): 1099- 1101. [37] GE HY, ZHANG SH. Research advances in association between matrix metalloproteinases and liver fibrosis[J]. J Clin Hepatol, 2017, 33( 3): 563- 566. DOI: 10.3969/j.issn.1001-5256.2017.03.037.戈宏焱, 张仕华. 基质金属蛋白酶与肝纤维化关系的研究进展[J]. 临床肝胆病杂志, 2017, 33( 3): 563- 566. DOI: 10.3969/j.issn.1001-5256.2017.03.037. [38] ZHAO P, SUN T, LYU C, et al. Scar-degrading endothelial cells as a treatment for advanced liver fibrosis[J]. Adv Sci(Weinh), 2023, 10( 4): e2203315. DOI: 10.1002/advs.202203315. [39] CHEN W, YANG A, JIA J, et al. Lysyl Oxidase(LOX) family members: rationale and their potential as therapeutic targets for liver fibrosis[J]. Hepatol, 2020, 72( 2): 729- 741. DOI: 10.1002/hep.31236. [40] GUO SG, ZHANG W, JIANG T, et al. Influence of serum collected from rat perfused with compound Biejiaruangan drug on hepatic stellate cells[J]. World J Gastroenterol, 2004, 10( 10): 1487- 1494. DOI: 10.3748/wjg.v10.i10.1487. [41] WANG L, LU W, GAO YH, et al. Effect of Anluohuaxianwan on the expression of matrix metalloproteinases and their inhibitors in rat liver with fibrosis[J]. Chin J Hepatol, 2019, 27( 4): 267- 273. DOI: 10.3760/cma.j.issn.1007-3418.2019.04.006.王林, 卢玮, 高玉华, 等. 安络化纤丸对肝纤维化大鼠肝组织基质金属蛋白酶及其抑制物表达的影响[J]. 中华肝脏病杂志, 2019, 27( 4): 267- 273. DOI: 10.3760/cma.j.issn.1007-3418.2019.04.006. [42] LIU H, DONG F, LI G, et al. Liuweiwuling tablets attenuate BDL-induced hepatic fibrosis via modulation of TGF-β/Smad and NF-κB signaling pathways[J]. J Ethnopharmacol, 2018, 210: 232- 241. DOI: 10.1016/j.jep.2017.08.029. [43] LIAO ZM, JIANG F, YE YA, et al. Effects of Kangxianyiai decoction on expression of matrix metalloproteinase in liver fibrosis rats[J]. Clin J Traditional Chin Med, 2009, 21( 1): 63- 65.廖昭铭, 江锋, 叶永安, 等. 抗纤抑癌方对肝纤维化大鼠肝组织基质金属蛋白酶表达的影响[J]. 中医药临床杂志, 2009, 21( 1): 63- 65. [44] GRACIA-SANCHO J, CAPARROS E, FERNANDEZ-IGLESIAS A, et al. Role of liver sinusoidal endothelial cells in liver diseases[J]. Nat Rev Gastroenterol Hepatol, 2021, 18( 6): 411- 431. DOI: 10.1038/s41575-020-00411-3. [45] LU X, LIU P, LIU CH, et al. Effect of Fu Zheng Hua Yu Recipe on hepatic sinusoid capillarization in the rat of dimethyl nitrosamine-induced hepatic fibrosis[J]. J Tra Chin Med, 2003, 44( 2): 136- 139. DOI: 10.3321/j.issn:1001-1668.2003.02.036.陆雄, 刘平, 刘成海, 等. 扶正化瘀方促进二甲基亚硝胺肝纤维化大鼠肝窦毛细血管化逆转作用的实验研究[J]. 中医杂志, 2003, 44( 2): 136- 139. DOI: 10.3321/j.issn:1001-1668.2003.02.036. [46] ZHANG D, ZHANG L, CHEN G, et al. Hepatoprotective effect of Xiayuxue decoction ethyl acetate fraction against carbon tetrachloride-induced liver fibrosis in mice via inducing apoptosis and suppressing activation of hepatic stellate cells[J]. Pharm Biol, 2020, 58( 1): 1229- 1243. DOI: 10.1080/13880209.2020.1855212. [47] ZHOU YN, SUN MY, MU YP, et al. Xuefuzhuyu decoction inhibition of angiogenesis attenuates liver fibrosis induced by CCl4 in mice[J]. J Ethnopharmacol, 2014, 153( 3): 659- 666. DOI: 10.1016/j.jep.2014.03.019. [48] MICHALOPOULOS GK, BHUSHAN B. Liver regeneration: biological and pathological mechanisms and implications[J]. Nat Rev Gastroenterol Hepatol, 2021, 18( 1): 40- 55. DOI: 10.1038/s41575-020-0342-4. [49] SHI Q, XIA Y, WU M, et al. Mi-BMSCs alleviate inflammation and fibrosis in CCl4-and TAA-induced liver cirrhosis by inhibiting TGF-β/Smad signaling[J]. Mater Today Bio, 2024, 25: 100958. DOI: 10.1016/j.mtbio.2024.100958. [50] MEIER RP, MAHOU R, MOREL P, et al. Microencapsulated human mesenchymal stem cells decrease liver fibrosis in mice[J]. Hepatol, 2015, 62( 3): 634- 641. DOI: 10.1016/j.jhep.2014.10.030. [51] PAN Q, WANG YQ, LI GM, et al. Fuzheng Huayu Recipe ameliorates liver fibrosis by restoring balance between epithelial-to-mesenchymal transition and mesenchymal-to-epithelial transition in hepatic stellate cells[J]. Biomed Res Int, 2015, 2015: 935903. DOI: 10.1155/2015/935903. [52] CHEN J, GAO W, ZHOU P, et al. Enhancement of hepatocyte differentiation from human embryonic stem cells by Chinese medicine Fuzhenghuayu[J]. Sci Rep, 2016, 6: 18841. DOI: 10.1038/srep18841. [53] ZHANG Y, JIN DL, DU JH, et al. The effect of Cpd861 on the differentiation of hepatic oval cells in rats[J]. Chin J Micro, 2011, 23( 10): 899- 901.张影, 金德龙, 杜景华, 等. 复方861对大鼠肝脏卵圆细胞分化的影响[J]. 中国微生态学杂志, 2011, 23( 10): 899- 901. [54] HUANG JJ, HUANG HN, WANG ZC, et al. Biejiajianwan alleviate liver fibrosis by affecting SDF-1/CXCR4 signalling pathway on bone marrow mesenchymal stem cell transplantation[J]. Lishizhen Med Mater Med Res, 2018, 29( 7): 1565- 1567. DOI: 10.3969/j.issn.1008-0805.2018.07.009.黄晶晶, 黄鸿娜, 王振常, 等. 鳖甲煎丸干预SDF-1/CXCR4信号通路对骨髓间充质干细胞移植治疗肝纤维化的影响研究[J]. 时珍国医国药, 2018, 29( 7): 1565- 1567. DOI: 10.3969/j.issn.1008-0805.2018.07.009. [55] LIU WL, YOU HJ, CHE NC, et al. The promotion of Yiguanjian on the recovery of liver fibrosis through mesenchymal stem cells:an experimental study[J]. Glo Tra Chin Med, 2014, 7( 6): 401- 405. DOI: 10.3969/j.issn.1674-1749.2014.06.001.刘文兰, 油红捷, 车念聪, 等. 一贯煎促进骨髓间充质干细胞逆转肝纤维化的实验研究[J]. 环球中医药, 2014, 7( 6): 401- 405. DOI: 10.3969/j.issn.1674-1749.2014.06.001. [56] DE MINICIS S, RYCHLICKI C, AGOSTINELLI L, et al. Dysbiosis contributes to fibrogenesis in the course of chronic liver injury in mice[J]. Hepatol, 2014, 59( 5): 1738- 1749. DOI: 10.1002/hep.26695. [57] BAJAJ JS, BETRAPALLY NS, HYLEMON PB, et al. Salivary microbiota reflects changes in gut microbiota in cirrhosis with hepatic encephalopathy[J]. Hepatol, 2015, 62( 4): 1260- 1271. DOI: 10.1002/hep.27819. [58] QIN N, YANG F, LI A, et al. Alterations of the human gut microbiome in liver cirrhosis[J]. Nature, 2014, 513( 7516): 59- 64. DOI: 10.1038/nature13568. [59] CHEN Y, YANG F, LU H, et al. Characterization of fecal microbial communities in patients with liver cirrhosis[J]. Hepatol, 2011, 54( 2): 562- 572. DOI: 10.1002/hep.24423. [60] SORRIBAS M, JAKOB MO, YILMAZ B, et al. FXR modulates the gut-vascular barrier by regulating the entry sites for bacterial translocation in experimental cirrhosis[J]. J Hepatol, 2019, 71( 6): 1126- 1140. DOI: 10.1016/j.jhep.2019.06.017. [61] HE X, LIANG J, LIX, et al. Dahuang zhechong pill ameliorates hepatic fibrosis by regulating gut microbiota and metabolites[J]. J Ethnopharmacol, 2024, 321: 117402. DOI: 10.1016/j.jep.2023.117402. [62] ZHAO Y, ZHAO M, ZHANG Y, et al. Bile acids metabolism involved in the beneficial effects of Danggui Shaoyao San via gut microbiota in the treatment of CCl4 induced hepatic fibrosis[J]. J Ethnopharmacol, 2024, 319( Pt 3): 117383. DOI: 10.1016/j.jep.2023.117383. [63] ZHANG Y, ZHAO M, JIANG X, et al. Comprehensive analysis of fecal microbiome and metabolomics in hepatic fibrosis rats reveal hepatoprotective effects of yinchen wuling powder from the host-microbial metabolic axis[J]. Front Pharmacol, 2021, 12: 713197. DOI: 10.3389/fphar.2021.713197. [64] TRANAH TH, EDWARDS LA, SCHNABL B, et al. Targeting the gut-liver-immune axis to treat cirrhosis[J]. Gut, 2021, 70( 5): 982- 994. DOI: 10.1136/gutjnl-2020-320786. -



 PDF下载 ( 1070 KB)
PDF下载 ( 1070 KB)

 下载:
下载:


