非酒精性脂肪性肝病患者的尿铅水平及其临床意义
DOI: 10.12449/JCH240909
Levels and clinical significance of urinary lead in patients with nonalcoholic fatty liver disease
-
摘要:
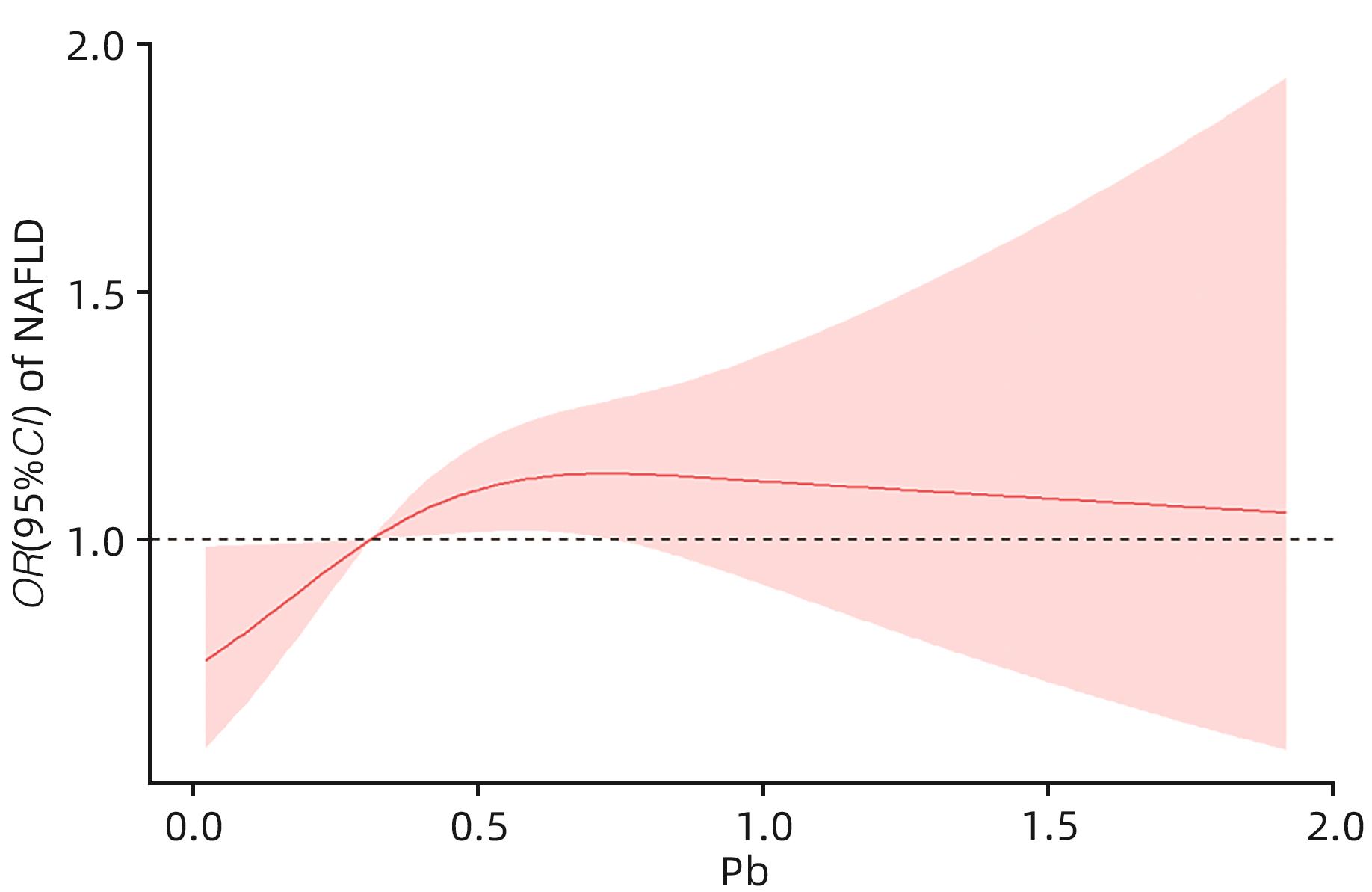
目的 探讨尿铅与非酒精性脂肪性肝病(NAFLD)的关系。 方法 选取2017—2020年美国健康和营养检查调查数据(NHANES)中年龄≥18岁的注册参与者,并排除缺乏肝脏瞬时弹性成像数据、尿铅指标及患有乙型肝炎、丙型肝炎、饮酒量显著的人群。将纳入人群(n=2 492)分为NAFLD组852例,Non-NAFLD组1 640例。采用高效液相色谱-电喷雾电离-串联质谱和在线固相萃取联合同位素稀释等方法定量检测尿铅水平。计量资料两组间比较采用成组t检验或Wilcoxon秩和检验;计数资料两组间比较采用χ2检验或Fisher确切概率法。通过多因素Logistic回归分析、限制性立方样条函数、亚组分析、交互作用,探究尿铅与NAFLD的关联。 结果 NAFLD组尿铅水平高于Non-NAFLD组,差异有统计学意义(Z=-2.023,P=0.043)。调整年龄、性别、种族、婚姻、教育、家庭收入与贫困比比值、BMI、吸烟、饮酒、糖尿病、高血压、高脂血症协变量后,尿铅水平Q3组NAFLD的患病风险显著增加(比值比=1.360,95%CI:1.019~1.817,P=0.037)。尿铅与NAFLD的患病风险存在正向剂量-反应关系(P=0.047)且为非线性关系(Pnon-linear=0.037)。尿铅与种族之间存在显著的交互作用,墨西哥裔美国人尿铅每上升1个四分位数,NAFLD的患病风险增加32.40%(比值比=1.324,95%CI:1.017~1.632,P<0.05)。 结论 尿铅水平与NAFLD患病风险显著相关。 -
关键词:
- 非酒精性脂肪性肝病 /
- 铅 /
- 尿 /
- Logistic模型
Abstract:Objective To investigate the association between urinary lead and nonalcoholic fatty liver disease (NAFLD). Methods The participants, aged ≥18 years, were selected from the 2017 — 2020 National Health and Nutrition Examination Survey (NHANES), with the exclusion of the participants with a lack of liver transient elastography data and urinary lead markers and those with hepatitis B, hepatitis C, and significant alcohol consumption. A total of 2 492 participants were enrolled and divided into NAFLD group with 852 participants and non-NAFLD group with 1 640 participants. High-performance liquid chromatography-electrospray ionization-tandem mass spectrometry and online solid-phase extraction combined with isotope dilution were used to measure urinary lead level. The independent-samples t test or the Wilcoxon rank sum test was used for comparison of continuous data between two groups, and the chi-square test or the Fisher’s exact test was used for comparison of categorical data between two groups. Multivariate Logistic regression analysis, restricted cubic spline, subgroup analysis, and interaction analysis were used to investigate the association between urinary lead and NAFLD. Results The NAFLD group had a significantly higher urinary lead level than the non-NAFLD group (Z=-2.023, P=0.043). After adjustment of the covariates of age, sex, race, marital status, education, family income-to-poverty ratio, body mass index, smoking, drinking, diabetes mellitus, hypertension, and hyperlipidemia, there was a significant increase in the risk of NAFLD in the Q3 urinary lead group (odds ratio [OR]=1.360, 95% confidence interval [CI]: 1.019 — 1.817, P=0.037). There was a positive dose-response relationship between urinary lead and the risk of NAFLD (P=0.047), which was a non-linear relationship (Pnon-linear=0.037). There was a significant interaction between urinary lead and race, and for every quartile increase in urinary lead, the risk of NAFLD in Mexican-Americans was increased by 32.40% (OR=1.324, 95%CI: 1.017 — 1.632, P<0.05). Conclusion Urinary lead level is significantly associated with the risk of NAFLD. -
Key words:
- Non-alcoholic Fatty Liver Disease /
- Lead /
- Urine /
- Logistic Models
-
表 1 研究对象基本特征
Table 1. Basic characteristics of research objects
变量 总计(n=2 492) Non-NAFLD组(n=1 640) NAFLD组(n=852) 统计值 P值 年龄(岁) 51(34~64) 47(31~63) 56(42~65) Z=-7.448 <0.001 年龄分组[例(%)] χ2=84.519 <0.001 18~39岁 810(32.504) 635(38.720) 175(20.540) 40~59岁 802(32.183) 477(29.085) 325(38.146) ≥60岁 880(35.313) 528(32.195) 352(41.315) 性别[例(%)] χ2=15.922 <0.001 男 1 273(51.083) 885(53.963) 388(45.540) 女 1 219(48.917) 755(46.037) 464(54.460) 种族[例(%)] χ2=46.165 <0.001 墨西哥裔美国人 325(13.042) 169(10.305) 156(18.310) 非西班牙裔黑人 669(26.846) 489(29.817) 180(21.127) 非西班牙裔白人 812(32.584) 517(31.524) 295(34.624) 其他 686(27.528) 465(28.354) 221(25.939) 教育程度[例(%)] χ2=4.905 0.086 大专或以上学历 1 380(55.377) 934(56.951) 446(52.347) 高中或同等学力 637(25.562) 402(24.512) 235(27.582) 高中以下 475(19.061) 304(18.537) 171(20.070) 吸烟[例(%)] χ2=1.199 0.293 一生吸烟<100支 1 517(60.875) 1 011(61.646) 506(59.390) 一生吸烟≥100支 975(39.125) 629(38.354) 346(40.610) 婚姻状况[例(%)] χ2=19.404 <0.001 已婚/与伴侣同居 1 442(57.865) 914(55.732) 528(61.972) 从来没有结过婚 518(20.787) 383(23.354) 135(15.845) 丧偶/离婚/分居 532(21.348) 343(20.915) 189(22.183) 饮酒[例(%)] χ2=1.354 0.273 否 286(11.477) 197(12.012) 89(10.446) 是 2 206(88.523) 1 443(87.988) 763(89.554) FMPIR 2.24(1.17~4.14) 2.36(1.17~4.27) 2.07(1.15~4.00) Z=-1.393 0.164 FMPIR分组[例(%)] χ2=1.549 0.461 <1.30 732(29.374) 474(28.902) 258(30.282) 1.30~3.50 936(37.560) 610(37.195) 326(38.263) ≥3.50 824(33.066) 556(33.902) 268(31.455) BMI(kg/m2) 28.40(24.50~33.70) 26.45(23.10~30.42) 32.70(28.70~37.52) Z=-22.603 <0.001 BMI分组[例(%)] χ2=55.042 <0.001 <25 kg/m2 686(27.528) 635(38.720) 51(5.986) 25~30 kg/m2 789(31.661) 559(34.085) 230(26.995) ≥30 kg/m2 1 017(40.811) 446(27.195) 571(67.019) HTN[例(%)] χ2=11.396 <0.001 否 2 068(82.986) 1 391(84.817) 677(79.460) 是 424(17.014) 249(15.183) 175(20.540) HL[例(%)] χ2=77.241 <0.001 否 2 204(88.443) 1 517(92.500) 687(80.634) 是 288(11.557) 123(7.500) 165(19.366) DM[例(%)] χ2=89.765 <0.001 否 2 148(86.196) 1 503(91.646) 645(75.704) 是 344(13.804) 137(8.354) 207(24.296) 尿铅(μg/L) 0.31(0.17~0.55) 0.30(0.16~0.55) 0.32(0.18~0.57) Z=-2.023 0.043 表 2 尿铅与NAFLD的Logistic分析
Table 2. Logistic analysis of urinary lead and NAFLD
变量 模型1 模型2 模型3 OR(95%CI) P值 OR(95%CI) P值 OR(95%CI) P值 尿铅水平 1.050(0.962~1.147) 0.274 1.177(1.020~1.358) 0.026 1.048(0.939~1.169) 0.403 尿铅分类 Q1 1.000 1.000 1.000 Q2 1.237(0.968~1.582) 0.089 1.253(0.975~1.611) 0.078 1.331(0.992~1.788) 0.057 Q3 1.347(1.062~1.711) 0.014 1.310(1.026~1.674) 0.031 1.360(1.019~1.817) 0.037 Q4 1.288(1.017~1.632) 0.036 1.179(0.920~1.511) 0.193 1.321(0.988~1.770) 0.061 注:尿铅水平以每四分位数为间距,尿铅分类以Q1为参照。在模型1中未调整变量;在模型2中调整年龄、性别、种族社会人口学变量;模型3调整所有协变量(年龄、性别、种族、教育、婚姻、FMPIR、BMI、吸烟、饮酒、DM、HTN、HL)。
表 3 尿铅与NAFLD患病风险相关变量的亚组分析及交互作用检验
Table 3. Subgroup analysis and interaction test of variables related to urinary lead and NAFLD risk
变量 OR(95%CI) P值 P交互 变量 OR(95%CI) P值 P交互 年龄分组 0.053 BMI分组 0.165 18~39岁 1.116(0.910~1.370) 0.292 <25 kg/m2 1.174(0.863~1.596) 0.307 40~59岁 1.014(0.833~1.233) 0.892 25~30 kg/m2 0.974(0.818~1.158) 0.763 ≥60岁 1.008(0.843~1.205) 0.931 ≥30 kg/m2 1.095(0.928~1.292) 0.285 性别 0.630 DM 0.164 男 1.064(0.904~1.254) 0.455 是 1.066(0.809~1.404) 0.650 女 1.037(0.890~1.209) 0.640 否 1.047(0.928~1.181) 0.455 吸烟 0.656 HTN 0.783 一生吸烟≥100支 1.029(0.852~1.243) 0.768 是 1.095(0.843~1.423) 0.497 一生吸烟<100支 1.049(0.921~1.196) 0.472 否 1.037(0.918~1.172) 0.560 饮酒 0.321 HL 0.106 是 1.033(0.917~1.163) 0.594 是 0.822(0.592~1.142) 0.243 否 1.272(0.905~1.789) 0.166 否 1.078(0.957~1.215) 0.214 种族 0.007 婚姻 0.410 墨西哥裔美国人 1.324(1.017~1.632) 0.036 已婚/与伴侣同居 1.147(0.998~1.318) 0.053 非西班牙裔黑人 1.039(0.935~1.790) 0.167 从来没有结过婚 0.961(0.731~1.264) 0.777 非西班牙裔白人 1.022(0.863~1.211) 0.801 丧偶/离婚/分居 0.843(0.647~1.099) 0.207 其他 1.016(0.855~1.208) 0.855 FMPIR 0.607 教育 0.358 <1.30 1.079(0.863~1.349) 0.507 高中以下 1.248(0.945~1.648) 0.118 1.30~3.50 1.114(0.932~1.332) 0.234 高中或同等学力 0.918(0.732~1.151) 0.458 ≥3.50 0.975(0.812~1.172) 0.790 大专或以上学历 1.059(0.915~1.227) 0.443 -
[1] TARGHER G, TILG H, BYRNE CD. Non-alcoholic fatty liver disease: A multisystem disease requiring a multidisciplinary and holistic approach[J]. Lancet Gastroenterol Hepatol, 2021, 6( 7): 578- 588. DOI: 10.1016/S2468-1253(21)00020-0. [2] YOUNOSSI ZM, KOENIG AB, ABDELATIF D, et al. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology, 2016, 64( 1): 73- 84. DOI: 10.1002/hep.28431. [3] RIAZI K, AZHARI H, CHARETTE JH, et al. The prevalence and incidence of NAFLD worldwide: A systematic review and meta-analysis[J]. Lancet Gastroenterol Hepatol, 2022, 7( 9): 851- 861. DOI: 10.1016/S2468-1253(22)00165-0. [4] LIU X, JU YW, MANDZHIEVA S, et al. Sporadic Pb accumulation by plants: Influence of soil biogeochemistry, microbial community and physiological mechanisms[J]. J Hazard Mater, 2023, 444( Pt A): 130391. DOI: 10.1016/j.jhazmat.2022.130391. [5] LIU WY, FENG H, ZHENG SL, et al. Pb toxicity on gut physiology and microbiota[J]. Front Physiol, 2021, 12: 574913. DOI: 10.3389/fphys.2021.574913. [6] CUOMO D, FOSTER MJ, THREADGILL D. Systemic review of genetic and epigenetic factors underlying differential toxicity to environmental lead(Pb) exposure[J]. Environ Sci Pollut Res Int, 2022, 29( 24): 35583- 35598. DOI: 10.1007/s11356-022-19333-5. [7] GUO XY, YIN XZ, LIU ZJ, et al. Non-alcoholic fatty liver disease(NAFLD) pathogenesis and natural products for prevention and treatment[J]. Int J Mol Sci, 2022, 23( 24): 15489. DOI: 10.3390/ijms232415489. [8] BOSKABADY M, MAREFATI N, FARKHONDEH T, et al. The effect of environmental lead exposure on human health and the contribution of inflammatory mechanisms, a review[J]. Environ Int, 2018, 120: 404- 420. DOI: 10.1016/j.envint.2018.08.013. [9] TESCHKE R. Aluminum, arsenic, beryllium, cadmium, chromium, cobalt, copper, iron, lead, mercury, molybdenum, nickel, platinum, thallium, titanium, vanadium, and zinc: Molecular aspects in experimental liver injury[J]. Int J Mol Sci, 2022, 23( 20): 12213. DOI: 10.3390/ijms232012213. [10] SOMMAR JN, HEDMER M, LUNDH T, et al. Investigation of lead concentrations in whole blood, plasma and urine as biomarkers for biological monitoring of lead exposure[J]. J Expo Sci Environ Epidemiol, 2014, 24( 1): 51- 57. DOI: 10.1038/jes.2013.4. [11] ZHAI HL, CHEN C, WANG NJ, et al. Blood lead level is associated with non-alcoholic fatty liver disease in the Yangtze River Delta Region of China in the context of rapid urbanization[J]. Environ Health, 2017, 16( 1): 93. DOI: 10.1186/s12940-017-0304-7. [12] VUPPALANCHI R, NOUREDDIN M, ALKHOURI N, et al. Therapeutic pipeline in nonalcoholic steatohepatitis[J]. Nat Rev Gastroenterol Hepatol, 2021, 18( 6): 373- 392. DOI: 10.1038/s41575-020-00408-y. [13] MIKOLASEVIC I, ORLIC L, FRANJIC N, et al. Transient elastography(FibroScan®) with controlled attenuation parameter in the assessment of liver steatosis and fibrosis in patients with nonalcoholic fatty liver disease-Where do we stand?[J]. World J Gastroenterol, 2016, 22( 32): 7236- 7251. DOI: 10.3748/wjg.v22.i32.7236. [14] PENG HY, PAN L, RAN SM, et al. Prediction of MAFLD and NAFLD using different screening indexes: A cross-sectional study in U.S. adults[J]. Front Endocrinol, 2023, 14: 1083032. DOI: 10.3389/fendo.2023.1083032. [15] ZHANG KW, NULALI J, ZHANG CX, et al. The association between serum vitamin A and NAFLD among US adults varied in different BMI groups: A cross-sectional study[J]. Food Funct, 2023, 14( 2): 836- 844. DOI: 10.1039/d2fo02204d. [16] SELVARAJ EA, MÓZES FE, JAYASWAL ANA, et al. Diagnostic accuracy of elastography and magnetic resonance imaging in patients with NAFLD: A systematic review and meta-analysis[J]. J Hepatol, 2021, 75( 4): 770- 785. DOI: 10.1016/j.jhep.2021.04.044. [17] STANFIELD Z, SETZER RW, HULL V, et al. Bayesian inference of chemical exposures from NHANES urine biomonitoring data[J]. J Expo Sci Environ Epidemiol, 2022, 32( 6): 833- 846. DOI: 10.1038/s41370-022-00459-0. [18] RINELLA ME, NEUSCHWANDER-TETRI BA, SIDDIQUI MS, et al. AASLD practice guidance on the clinical assessment and management of nonalcoholic fatty liver disease[J]. Hepatology, 2023, 77( 5): 1797- 1835. DOI: 10.1097/HEP.0000000000000323. [19] WANG LL, YI JY, GUO XL, et al. Associations between life’s essential 8 and non-alcoholic fatty liver disease among US adults[J]. J Transl Med, 2022, 20( 1): 616. DOI: 10.1186/s12967-022-03839-0. [20] SANDERS AP, MAZZELLA MJ, MALIN AJ, et al. Combined exposure to lead, cadmium, mercury, and arsenic and kidney health in adolescents age 12-19 in NHANES 2009-2014[J]. Environ Int, 2019, 131: 104993. DOI: 10.1016/j.envint.2019.104993. [21] CHEN L, SUN QZ, PENG SF, et al. Associations of blood and urinary heavy metals with rheumatoid arthritis risk among adults in NHANES, 1999-2018[J]. Chemosphere, 2022, 289: 133147. DOI: 10.1016/j.chemosphere.2021.133147. [22] BUSER MC, INGBER SZ, RAINES N, et al. Urinary and blood cadmium and lead and kidney function: NHANES 2007-2012[J]. Int J Hyg Environ Health, 2016, 219( 3): 261- 267. DOI: 10.1016/j.ijheh. 2016.01.005. [23] HINAI MA, JANSEN EC, SONG PX, et al. Iron deficiency and vitamin D deficiency are associated with sleep in females of reproductive age: An analysis of NHANES 2005-2018 data[J]. J Nutr, 2024, 154( 2): 648- 657. DOI: 10.1016/j.tjnut.2023.11.030. [24] KIM DW, OCK J, MOON KW, et al. Association between Pb, Cd, and Hg exposure and liver injury among Korean adults[J]. Int J Environ Res Public Health, 2021, 18( 13): 6783. DOI: 10.3390/ijerph18136783. [25] CHUNG SM, MOON JS, YOON JS, et al. The sex-specific effects of blood lead, mercury, and cadmium levels on hepatic steatosis and fibrosis: Korean nationwide cross-sectional study[J]. J Trace Elem Med Biol, 2020, 62: 126601. DOI: 10.1016/j.jtemb.2020.126601. [26] CAVE M, APPANA S, PATEL M, et al. Polychlorinated biphenyls, lead, and mercury are associated with liver disease in American adults: NHANES 2003-2004[J]. Environ Health Perspect, 2010, 118( 12): 1735- 1742. DOI: 10.1289/ehp.1002720. [27] WANG NN, SHENG ZJ, ZHOU SM, et al. Chronic lead exposure exacerbates hepatic glucolipid metabolism disorder and gut microbiota dysbiosis in high-fat-diet mice[J]. Food Chem Toxicol, 2022, 170: 113451. DOI: 10.1016/j.fct.2022.113451. [28] WAN H, WANG YY, ZHANG HJ, et al. Chronic lead exposure induces fatty liver disease associated with the variations of gut microbiota[J]. Ecotoxicol Environ Saf, 2022, 232: 113257. DOI: 10.1016/j.ecoenv.2022.113257. [29] YANG ZR, LI XM, TIAN L, et al. Heavy metals exposure is associated with early liver dysfunction among rural residents aged 40-75 years in southwest China[J]. J Appl Toxicol, 2022, 42( 6): 1044- 1056. DOI: 10.1002/jat.4276. [30] MA L, LIU JY, DONG JX, et al. Toxicity of Pb2+ on rat liver mitochondria induced by oxidative stress and mitochondrial permeability transition[J]. Toxicol Res, 2017, 6( 6): 822- 830. DOI: 10.1039/c7tx00204a. [31] URBANO T, FILIPPINI T, LASAGNI D, et al. Association of urinary and dietary selenium and of serum selenium species with serum alanine aminotransferase in a healthy Italian population[J]. Antioxidants, 2021, 10( 10): 1516. DOI: 10.3390/antiox10101516. [32] LIU J, TAN L, LIU ZY, et al. Blood and urine manganese exposure in non-alcoholic fatty liver disease and advanced liver fibrosis: An observational study[J]. Environ Sci Pollut Res Int, 2023, 30( 9): 22222- 22231. DOI: 10.1007/s11356-022-23630-4. [33] FREDIANI JK, NAIOTI EA, VOS MB, et al. Arsenic exposure and risk of nonalcoholic fatty liver disease(NAFLD) among U.S. adolescents and adults: An association modified by race/ethnicity, NHANES 2005-2014[J]. Environ Health, 2018, 17( 1): 6. DOI: 10.1186/s12940-017-0350-1. [34] HYDER O, CHUNG M, COSGROVE D, et al. Cadmium exposure and liver disease among US adults[J]. J Gastrointest Surg, 2013, 17( 7): 1265- 1273. DOI: 10.1007/s11605-013-2210-9. [35] HUH JH, LEE KJ, LIM JS, et al. High dietary sodium intake assessed by estimated 24-h urinary sodium excretion is associated with NAFLD and hepatic fibrosis[J]. PLoS One, 2015, 10( 11): e0143222. DOI: 10.1371/journal.pone.0143222. [36] LUO J, XING WQ, IPPOLITO JA, et al. Bioaccessibility, source and human health risk of Pb, Cd, Cu and Zn in windowsill dusts from an area affected by long-term Pb smelting[J]. Sci Total Environ, 2022, 842: 156707. DOI: 10.1016/j.scitotenv.2022.156707. [37] MORADNIA M, MOVAHEDIAN ATTAR H, HEIDARI Z, et al. Monitoring of urinary arsenic(As) and lead(Pb) among a sample of pregnant Iranian women[J]. J Environ Health Sci Eng, 2021, 19( 2): 1901- 1909. DOI: 10.1007/s40201-021-00743-5. -



 PDF下载 ( 785 KB)
PDF下载 ( 785 KB)

 下载:
下载:


