原发性胆汁性胆管炎-自身免疫性肝炎重叠综合征合并肺隐球菌病1例报告
DOI: 10.12449/JCH240825
Primary biliary cholangitis-autoimmune hepatitis overlap syndrome comorbid with pulmonary cryptococcosis: A case report
-
摘要: 自身免疫性肝病重叠综合征表现为患者出现一种以上的自身免疫性肝病的生化、免疫、组织学或胆管造影特征,常需联合使用免疫抑制剂治疗。肺隐球菌病是一种由新型隐球菌或格特隐球菌引起的侵袭性肺真菌病,易在免疫功能低下患者中发生。本病例为1例重叠综合征,在免疫抑制治疗过程中发现并治疗肺隐球菌病,在抗真菌治疗过程中肝功能出现异常,根据患者的肝功能情况,评估了更换抗真菌药物的可行性,综合考虑后制定了在密切监测肝功能的情况下,积极治疗新型隐球菌感染的治疗策略,避免了感染的进展。提示在启动免疫抑制治疗前,除了全面评估全身感染灶,对于可疑感染灶也必须保持监测。Abstract: Patients with overlap syndrome (OS) of autoimmune liver disease may present with more than one biochemical, immunological, histological or cholangiography features of autoimmune liver disease (AILD) and often require a combination of immunosuppressants for treatment. Pulmonary cryptococcosis is a type of invasive pneumomycosis caused by Cryptococcus neoformans or Cryptococcus gattii and has a relatively high incidence rate in immunocompromised patients. This case report presents a patient with OS who was found to have pulmonary cryptococcosis during immunosuppressive therapy and developed abnormal liver function during antifungal treatment. Based on the liver function of the patient, the feasibility of adjusting antifungal agents was assessed, and active treatment strategies for novel cryptococcal infection were developed under the close monitoring of liver function, which helped to avoid the progression of infection. It is suggested that before the initiation of immunosuppressive therapy, systemic foci of infection should be comprehensively evaluated, and suspicious foci of infection should be monitored continuously.
-
表 1 药敏检测报告
Table 1. Drug sensitivity test report
抗生素 结果 敏感度 方法 折点 5-氟胞嘧啶 2 WT MIC ≤8 伏立康唑 0.06 WT MIC ≤0.25 卡泊芬净 ≥16 耐药 MIC 米卡芬净 ≥16 耐药 MIC 阿尼芬净 ≥16 耐药 MIC 伊曲康唑 0.12 WT MIC ≤0.25 两性霉素B 0.5 WT MIC ≤0.25 氟康唑 4 WT MIC ≤8 泊沙康唑 0.12 WT MIC ≤0.25 注:患者肺泡灌洗液培养结果为新生隐球菌,为5-氟胞嘧啶、伏立康唑、伊曲康唑、两性霉素B、氟康唑、泊沙康唑野生型菌株。WT,野生型;MIC,最小抑菌浓度。
-
[1] CZAJA AJ, CARPENTER HA. Autoimmune hepatitis overlap syndromes and liver pathology[J]. Gastroenterol Clin North Am, 2017, 46( 2): 345- 364. DOI: 10.1016/j.gtc.2017.01.008. [2] SILVEIRA MG, TALWALKAR JA, ANGULO P, et al. Overlap of autoimmune hepatitis and primary biliary cirrhosis: long-term outcomes[J]. Am J Gastroenterol, 2007, 102( 6): 1244- 1250. DOI: 10.1111/j.1572-0241.2007.01136.x. [3] JIANG Y, XU BH, RODGERS B, et al. Characteristics and inpatient outcomes of primary biliary cholangitis and autoimmune hepatitis overlap syndrome[J]. J Clin Transl Hepatol, 2021, 9( 3): 392- 398. DOI: 10.14218/JCTH.2021.00008. [4] CHALIFOUX SL, KONYN PG, CHOI G, et al. Extrahepatic manifestations of primary biliary cholangitis[J]. Gut Liver, 2017, 11( 6): 771- 780. DOI: 10.5009/gnl16365. [5] GRAVERSGAARD C, SALMON JE, SCHREIBER K. First prospective observational data on pregnancies in patients with primary Sjögren’s syndrome[J]. Lancet Rheumatol, 2023, 5( 6): e306- e307. DOI: 10.1016/S2665-9913(23)00123-6. [6] CHAZOUILLÈRES O, WENDUM D, SERFATY L, et al. Primary biliary cirrhosis-autoimmune hepatitis overlap syndrome: clinical features and response to therapy[J]. Hepatology, 1998, 28( 2): 296- 301. DOI: 10.1002/hep.510280203. [7] Chinese Society of Hepatology, Chinese Medical Association. Guidelines on the diagnosis and management of primary biliary cholangitis(2021)[J]. J Clin Hepatol, 2022, 38( 1): 35- 41.中华医学会肝病学分会. 原发性胆汁性胆管炎的诊断和治疗指南(2021)[J]. 临床肝胆病杂志, 2022, 38( 1): 35- 41. [8] MA L, GAO LL. Diagnosis and treatment of patients with primary biliary cholangitis-autoimmune hepatitis overlap syndrome[J]. J Prac Hepatol, 2023, 26( 2): 301- 304. DOI: 10.3969/j.issn.1672-5069.2023.02.038.马莉, 高丽丽. 原发性胆汁性胆管炎-自身免疫性肝炎重叠综合征诊治进展[J]. 实用肝脏病杂志, 2023, 26( 2): 301- 304. DOI: 10.3969/j.issn.1672-5069.2023.02.038. [9] Chinese Society of Hepatology, Chinese Medical Association. Guidelines on the diagnosis and management of autoimmune hepatitis(2021)[J]. J Clin Hepatol, 2022, 38( 1): 42- 49.中华医学会肝病学分会. 自身免疫性肝炎诊断和治疗指南(2021)[J]. 临床肝胆病杂志, 2022, 38( 1): 42- 49. [10] FREEDMAN BL, DANFORD CJ, PATWARDHAN V, et al. Treatment of overlap syndromes in autoimmune liver disease: a systematic review and Meta-analysis[J]. J Clin Med, 2020, 9( 5): 1449. DOI: 10.3390/jcm9051449. [11] YI L, TAO YH, CHEN ZY, et al. Study on the clinical features and CT findings of pulmonary Cryptococcosis in immunocompetent patient[J]. J Clin Radiol, 2023, 42( 1): 51- 55.易黎, 陶雅红, 陈智勇, 等. 免疫功能正常者肺隐球菌病临床表现及CT特征分析[J]. 临床放射学杂志, 2023, 42( 1): 51- 55. [12] KOHNO S, KAKEYA H, IZUMIKAWA K, et al. Clinical features of pulmonary cryptococcosis in non-HIV patients in Japan[J]. J Infect Chemother, 2015, 21( 1): 23- 30. DOI: 10.1016/j.jiac.2014.08.025. [13] SONG KD, LEE KS, CHUNG MP, et al. Pulmonary cryptococcosis: imaging findings in 23 non-AIDS patients[J]. Korean J Radiol, 2010, 11( 4): 407- 416. DOI: 10.3348/kjr.2010.11.4.407. [14] MA LL, RAO HL, TANG F, et al. Analysis of CT imaging features and clinical pathological features in patients with pulmonary cryptococcosis[J]. Clin J Med Offic, 2022, 50( 12): 1310- 1312, 1316. DOI: 10.16680/j.1671-3826.2022.12.30.马利利, 饶会林, 唐飞, 等. 肺隐球菌病患者肺部CT影像学表现及临床病理特征分析[J]. 临床军医杂志, 2022, 50( 12): 1310- 1312, 1316. DOI: 10.16680/j.1671-3826.2022.12.30. [15] VISNEGARWALA F, GRAVISS EA, LACKE CE, et al. Acute respiratory failure associated with cryptococcosis in patients with AIDS: analysis of predictive factors[J]. Clin Infect Dis, 1998, 27( 5): 1231- 1237. DOI: 10.1086/514984. [16] CHAI CY, WANG T. Clinical analysis of pulmonary cryptococcus infection in the elderly and literature review[J]. Clin Misdiagn Misther, 2023, 36( 2): 1- 4, 10. DOI: 10.3969/j.issn.1002-3429.2023.02.001.柴春艳, 王婷. 老年肺隐球菌感染临床分析并文献复习[J]. 临床误诊误治, 2023, 36( 2): 1- 4, 10. DOI: 10.3969/j.issn.1002-3429.2023.02.001. [17] HOWARD-JONES AR, SPARKS R, PHAM D, et al. Pulmonary cryptococcosis[J]. J Fungi(Basel), 2022, 8( 11): 1156. DOI: 10.3390/jof8111156. -



 PDF下载 ( 1960 KB)
PDF下载 ( 1960 KB)

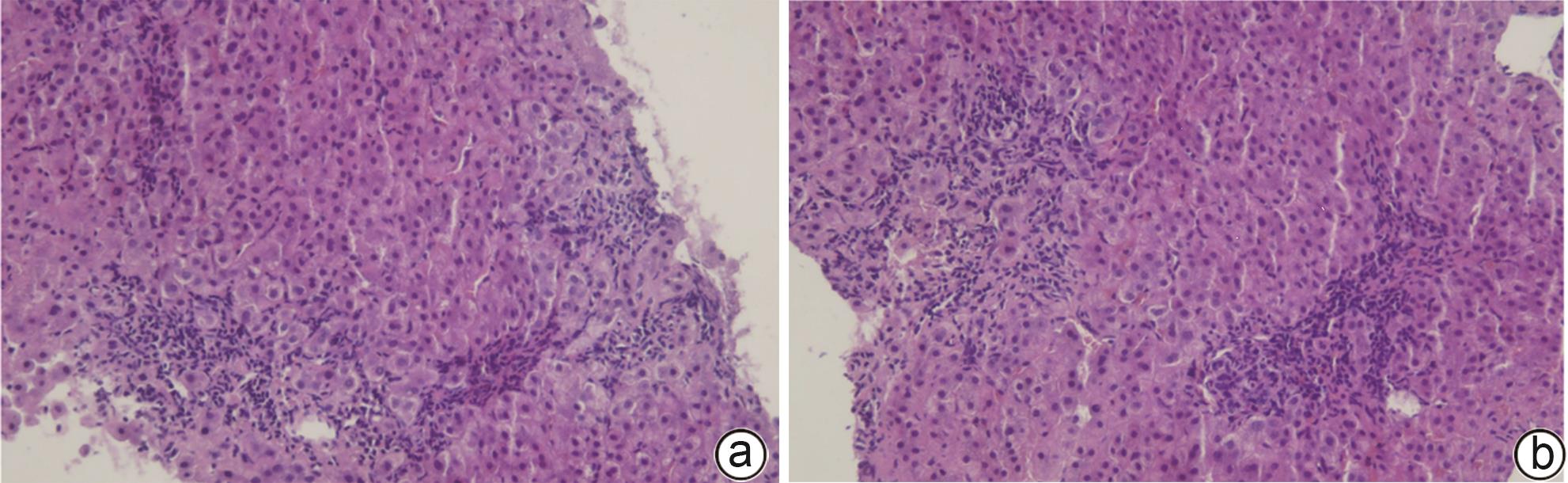
 下载:
下载:




