超声造影联合剪切波弹性成像技术对肝脏良恶性肿瘤诊断价值的Meta分析
DOI: 10.12449/JCH240719
Value of contrast-enhanced ultrasound combined with shear wave elastography in the diagnosis of benign and malignant liver tumors: A Meta-analysis
-
摘要:
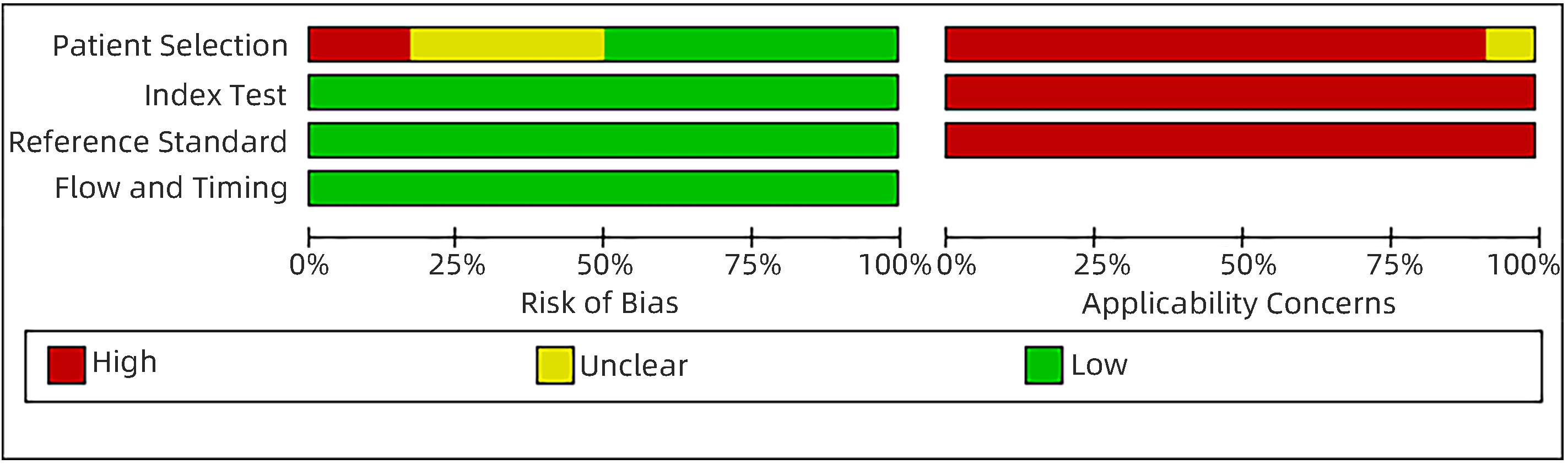
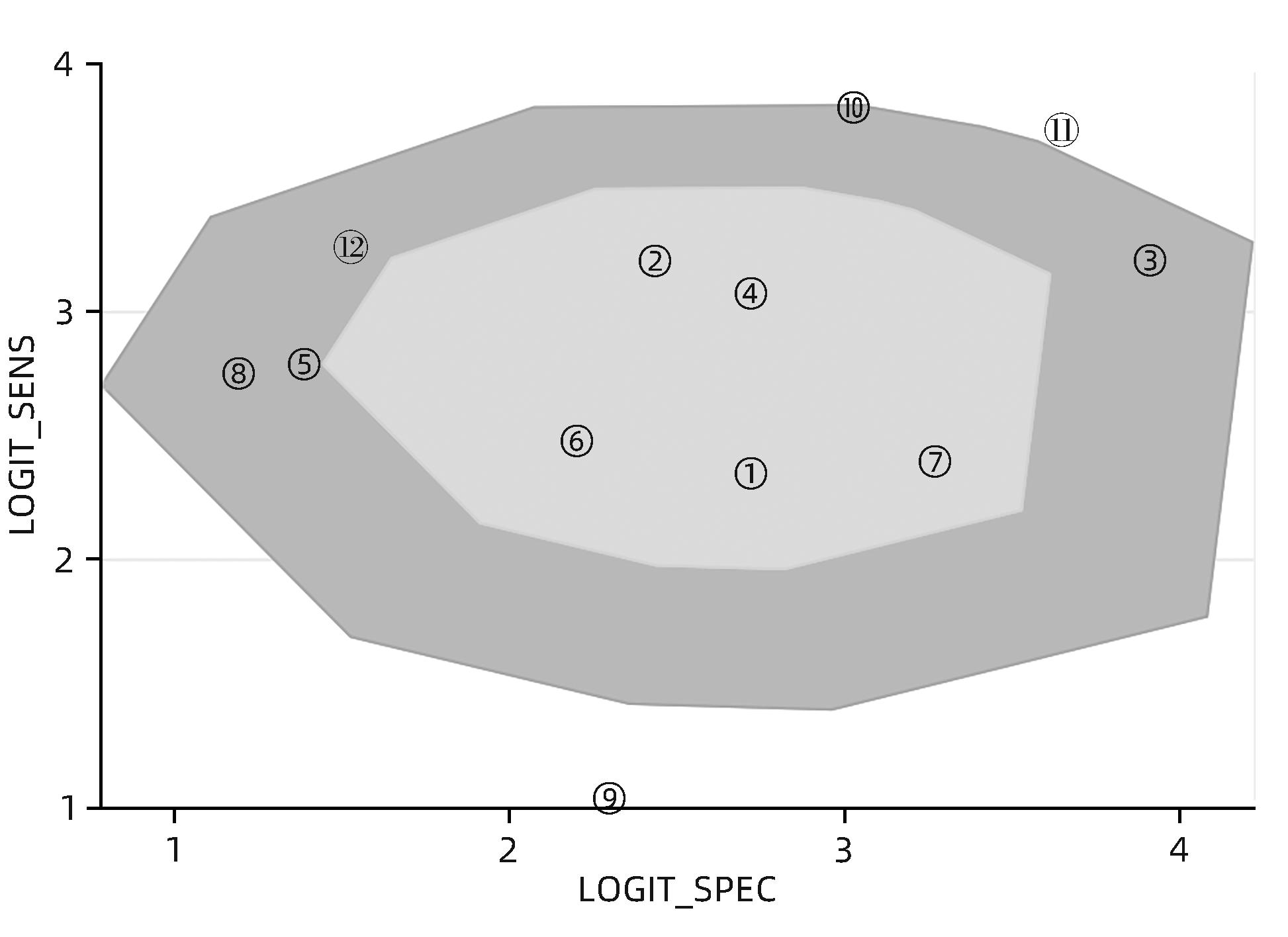
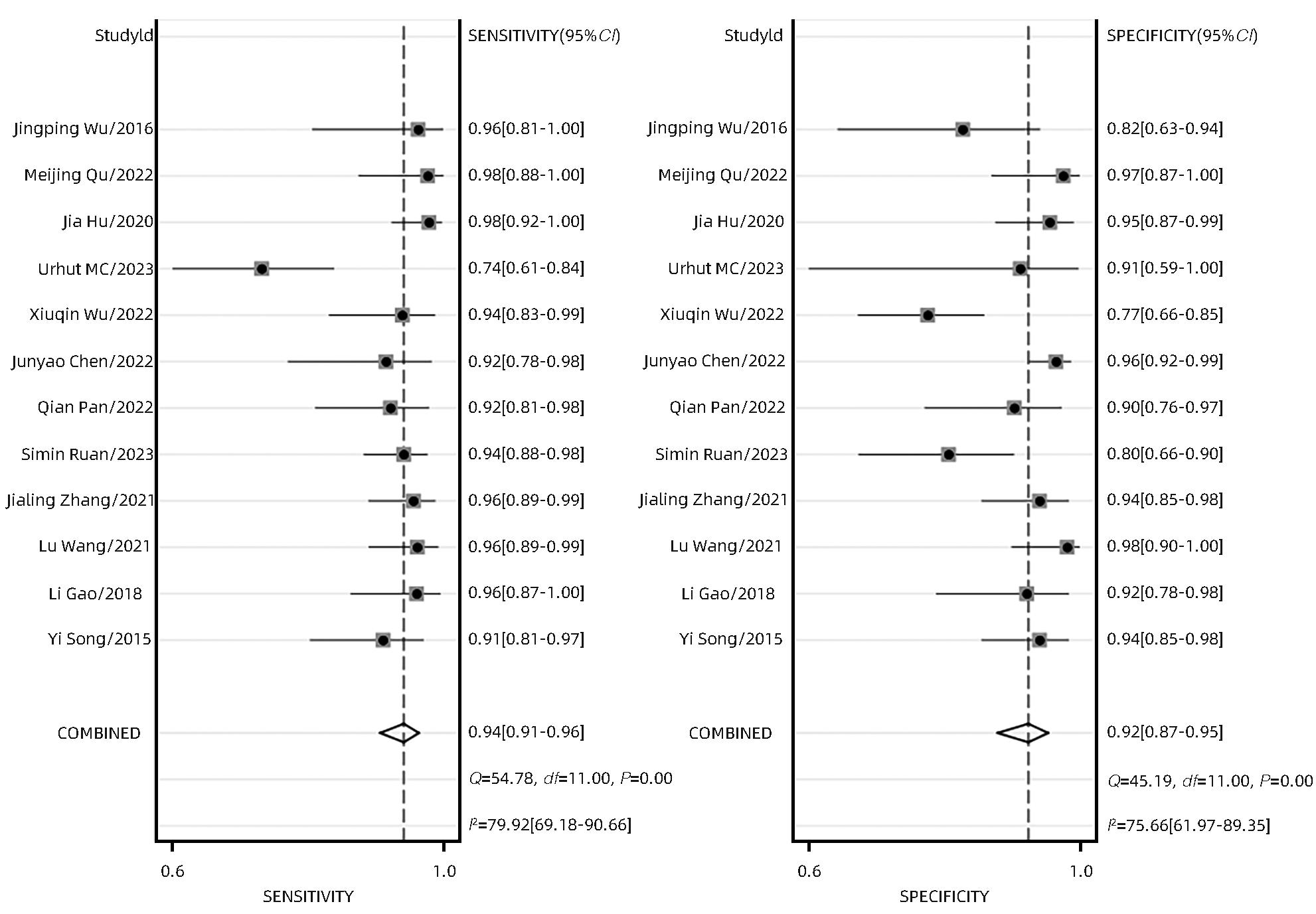
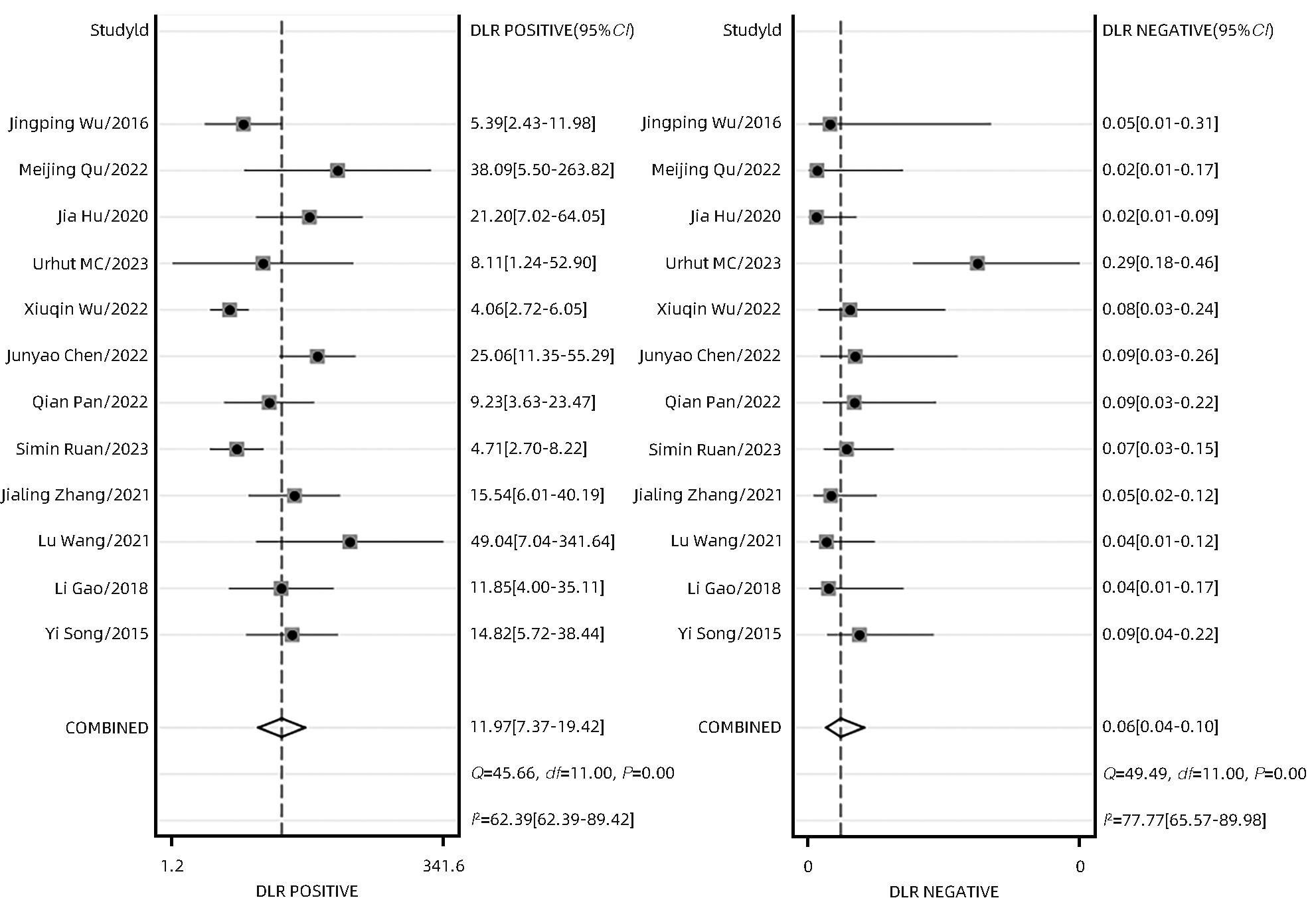
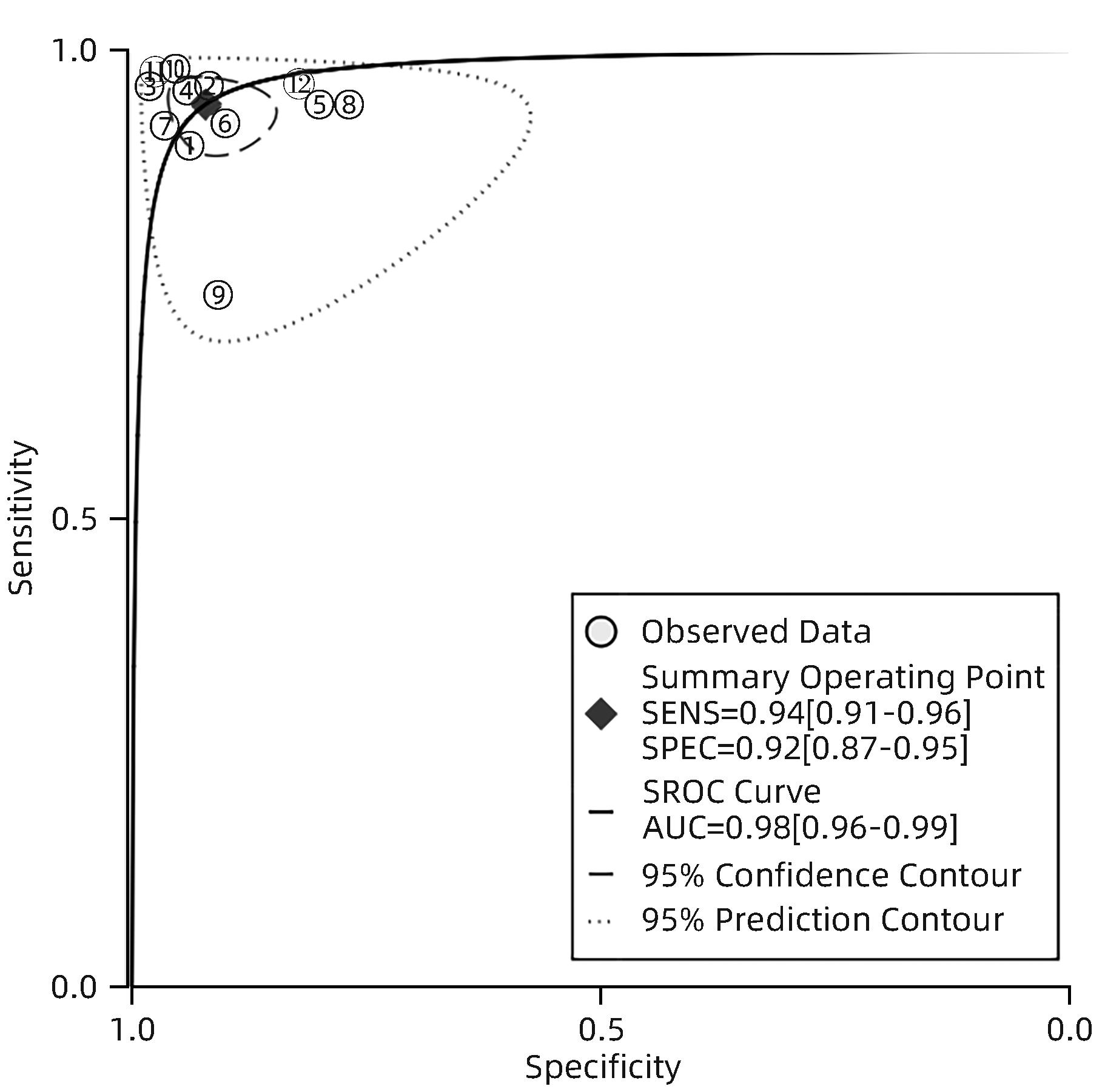
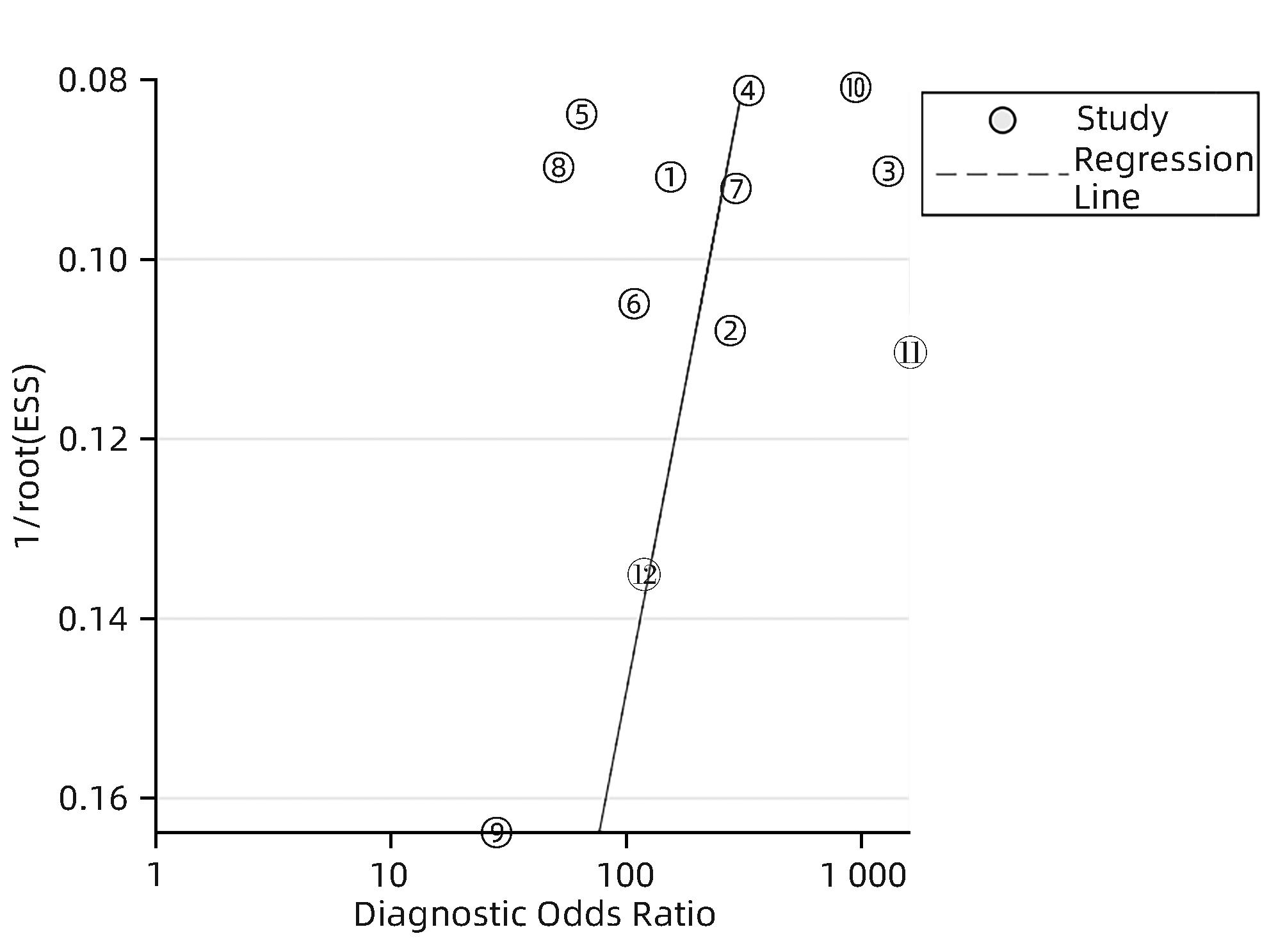
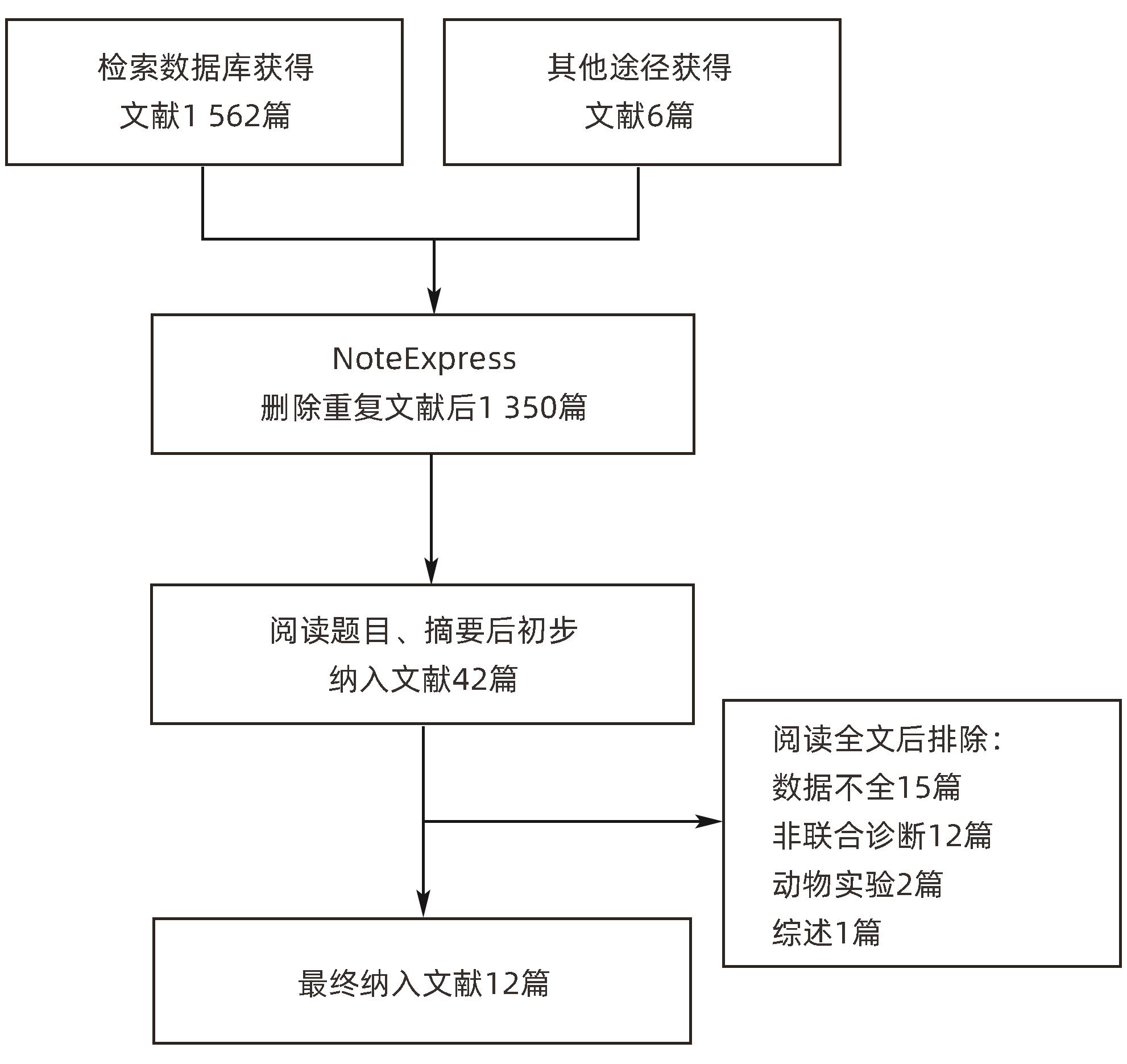
目的 研究超声造影(CEUS)联合剪切波弹性成像(SWE)对肝脏肿瘤的诊断价值。 方法 本研究根据PRISMA指南完成,PROSPERO注册号:CRD42023491288。检索PubMed、Embase、Cochrane Library、中国知网、维普、万方数据库关于CEUS联合SWE诊断肝脏肿瘤的文献,检索时限为2000年1月—2023年10月,经筛选共纳入12篇文献,包含1 328例患者。以QUADAS-2工具对纳入的文献进行质量评估。采用Stata 15.0软件计算合并灵敏度、特异度、阳性似然比、阴性似然比、诊断比值比及异质性,绘制综合受试者工作特征曲线(SROC)并计算曲线下面积(AUC)。 结果 纳入病例中,包含病灶1 457个,其中恶性病灶764个,良性病灶693个,阳性率为52.44%,阴性率为47.56%,计算得到合并灵敏度、特异度、阳性似然比、阴性似然比、诊断比值比分别为0.94(95%CI:0.91~0.96)、0.92(95%CI:0.87~0.95)、12.00(95%CI:7.40~19.40)、0.06(95%CI:0.04~0.10)、191(95%CI:87~417),异质性检验结果为Q=54.78,df=11.00,P<0.001,I2=79.92%,95%CI:69.18%~90.66%,AUC为0.98。 结论 CEUS联合SWE技术对于肝脏良恶性肿瘤具有较高的诊断价值,值得临床推广使用。 Abstract:Objective To investigate the value of contrast-enhanced ultrasound (CEUS) combined with shear wave elastography (SWE) in the diagnosis of liver tumors. Methods This study was conducted according to the PRISMA guideline, with a PROSPERO registration number of CRD42023491288. PubMed, Embase, the Cochrane Library, CNKI, VIP, and Wanfang Data were searched for articles on CEUS combined with SWE in the diagnosis of liver tumors published from January 2000 to October 2023, and a total of 12 articles were included, with 1 328 patients in total. The QUADAS-2 tool was used to assess the quality of the articles included. Stata 15.0 software was used to calculate pooled sensitivity, specificity, positive likelihood ratio, negative likelihood ratio, diagnostic odds ratio, and heterogeneity. The summary receiver operating characteristic (SROC) curve was plotted, and the area under the SROC curve (AUC) was calculated. Results There were 1 457 lesions for the patients included, among whom there were 764 malignant lesions and 693 benign lesions, with a positive rate of 52.44% and a negative rate of 47.56%. Calculations obtained a pooled sensitivity of 0.94 (95% confidence interval [CI]: 0.91 — 0.96), a specificity of 0.92 (95%CI: 0.87 — 0.95), a positive likelihood ratio of 12.00 (95%CI: 7.40 — 19.40), a negative likelihood ratio of 0.06 (95%CI: 0.04 — 0.10), and a diagnostic odds ratio of 191 (95%CI: 87 — 417). The tests for heterogeneity showed Q=54.78, df=11.00, P<0.001, and I2=79.92% (95%CI: 69.18% — 90.66%), with an AUC of 0.98. Conclusion CEUS combined with SWE has a relatively high diagnostic value for benign and malignant liver tumors and thus holds promise for clinical application. -
Key words:
- Ultrasonography /
- Shear-Wave Elastography /
- Liver Neoplasms /
- Meta-Analysis
-
表 1 纳入研究的基本信息
Table 1. Characteristics of included studies
第一作者 发表年份 国家 研究
类型
患者例数(男/女) 病灶个数 病灶个数(恶性/良性) 灵敏度
(%)
特异度
(%)
金标准 TP FP FN TN 宋毅[10] 2015 中国 前瞻性 122(70/52) 52 4 5 61 122(57/65) 91.2 93.8 病理 高莉[11] 2018 中国 前瞻性 80(52/28) 49 3 2 34 88(51/37) 96.1 91.9 病理 王璐[12] 2021 中国 前瞻性 75(43/32) 75 1 3 50 129(78/51) 96.2 98 病理或随访 张家玲[13] 2021 中国 前瞻性 135(83/52) 87 4 4 61 156(91/65) 95.6 93.8 病理或随访 Ruan[14] 2023 中国 回顾性 165(111/54) 114 10 7 40 171(124/47) 94.2 80 病理 潘茜[15] 2022 中国 回顾性 92(47/45) 48 4 4 36 92(52/40) 92.3 90 病理 陈君耀[16] 2022 中国 前瞻性 200(115/85) 33 6 3 158 200(36/164) 91.7 96.3 病理 吴秀琴[17] 2022 中国 回顾性 132(83/49) 47 19 3 63 132(50/82) 94 76.8 病理 Urhuț[18] 2023 罗马尼亚 前瞻性 66(44/22) 45 1 16 10 72(61/11) 73.8 90.9 病理 Hu[19] 2020 中国 前瞻性 136(75/61) 91 3 2 62 158(94/64) 97.8 95.4 病理或影像学 曲美景[20] 2022 中国 前瞻性 79(比例未知) 42 1 1 38 82(43/39) 97.7 97.4 病理或影像学 Wu[21] 2016 中国 前瞻性 46(25/21) 26 5 1 23 55(27/28) 96.3 82.1 病理或影像学 注:TP,真阳性;FP,假阳性;FN,假阴性;TN,真阴性。
-
[1] CHEN QS, SHANG WT, ZENG CT, et al. Theranostic imaging of liver cancer using targeted optical/MRI dual-modal probes[J]. Oncotarget, 2017, 8( 20): 32741- 32751. DOI: 10.18632/oncotarget.15642. [2] ALENEZI AO, KRISHNA S, MENDIRATTA-LALA M, et al. Imaging and management of liver cancer[J]. Semin Ultrasound CT MR, 2020, 41( 2): 122- 138. DOI: 10.1053/j.sult.2019.12.002. [3] HUANG ZR, LI L, HUANG H, et al. Value of multimodal data from clinical and sonographic parameters in predicting recurrence of hepatocellular carcinoma after curative treatment[J]. Ultrasound Med Biol, 2023, 49( 8): 1789- 1797. DOI: 10.1016/j.ultrasmedbio.2023.04.001. [4] WILSON SR, GREENBAUM LD, GOLDBERG BB. Contrast-enhanced ultrasound: what is the evidence and what are the obstacles?[J]. Am J Roentgenol, 2009, 193( 1): 55- 60. DOI: 10.2214/AJR.09.2553. [5] ZHANG P, ZHOU P, TIAN SM, et al. Application of acoustic radiation force impulse imaging for the evaluation of focal liver lesion elasticity[J]. Hepatobiliary Pancreat Dis Int, 2013, 12( 2): 165- 170. DOI: 10.1016/s1499-3872(13)60027-2. [6] MOHER D, LIBERATI A, TETZLAFF J, et al. Preferred reporting items for systematic reviews and meta-analyses: The PRISMA statement[J]. PLoS Med, 2009, 6( 7): e1000097. DOI: 10.1371/journal.pmed.1000097. [7] WADE R, CORBETT M, EASTWOOD A. Quality assessment of comparative diagnostic accuracy studies: Our experience using a modified version of the QUADAS-2 tool[J]. Res Synth Methods, 2013, 4( 3): 280- 286. DOI: 10.1002/jrsm.1080. [8] LI WC, GAO G, LUN ZJ, et al. Identification and treatment of heterogeneity in medical meta-analysis[C]// International Symposium on Computer, Communication, Control and Automation(3CA 2018). Colombo, Sri Lanka. 2018. [9] GJERDEVIK M, HEUCH I. Improving the error rates of the Begg and Mazumdar test for publication bias in fixed effects meta-analysis[J]. BMC Med Res Methodol, 2014, 14: 109. DOI: 10.1186/1471-2288-14-109. [10] SONG Y. The clinical research of real-time shear wave elastography and contrast enhancmented ultrasonography in differential diagnosis of focal liver lesions[D]. Zhengzhou: Zhengzhou University, 2015.宋毅. 实时剪切波弹性成像与超声造影在肝脏局灶性病变中的应用价值[D]. 郑州: 郑州大学, 2015. [11] GAO L, SHI HM, BAI CH. Diagnostic value of contrast-enhanced ultrasound and elastography in benign and malignant liver tumors[J]. Chin Remedies Clin, 2018, 18( 7): 1124- 1125. DOI: 10.11655/zgywylc2018.07.020.高莉, 史红梅, 白彩花. 超声造影与弹性成像在肝脏良恶性肿瘤的诊断价值分析[J]. 中国药物与临床, 2018, 18( 7): 1124- 1125. DOI: 10.11655/zgywylc2018.07.020. [12] WANG L, LU M, WU XB, et al. Value of multimodal ultrasonography in differentiating malignant focal liver lesions from benign ones[J]. J Cancer Contr Treat, 2021, 34( 6): 538- 543. DOI: 10.3969/j.issn.1674-0904.2021.06.009.王璐, 卢漫, 吴晓波, 等. 超声多模态成像鉴别肝脏局灶病变良恶性的价值[J]. 肿瘤预防与治疗, 2021, 34( 6): 538- 543. DOI: 10.3969/j.issn.1674-0904.2021.06.009. [13] ZHANG JL. Clinical value of contrast-enhanced ultrasound and shear wave elastography in the diagnosis of liver tumors[D]. Bengbu: Bengbu Medical College, 2021.张家玲. 超声造影与剪切波弹性成像在肝肿瘤诊断中的临床价值[D]. 蚌埠: 蚌埠医学院, 2021. [14] RUAN SM, HUANG H, CHENG MQ, et al. Shear-wave elastography combined with contrast-enhanced ultrasound algorithm for noninvasive characterization of focal liver lesions[J]. Radiol Med, 2023, 128( 1): 6- 15. DOI: 10.1007/s11547-022-01575-5. [15] PAN Q, WANG SD. Value of contrast-enhanced ultrasound combined with shear wave elastography in the differential diagnosis of benign and malignant nodules in liver parenchyma under the background of liver cirrhosis[J]. J Clin Ultrasound Med, 2022, 24( 2): 119- 122. DOI: 10.3969/j.issn.1008-6978.2022.02.010.潘茜, 王斯达. 超声造影联合剪切波弹性成像对肝硬化背景下肝实质内良恶性结节的鉴别诊断价值[J]. 临床超声医学杂志, 2022, 24( 2): 119- 122. DOI: 10.3969/j.issn.1008-6978.2022.02.010. [16] CHEN JY, LI CY, GUAN HY. Application value of multi-modal ultrasound imaging in screening high risk population of liver cancer[J]. Chin Hepatol, 2022, 27( 3): 288- 291. DOI: 10.14000/j.cnki.issn.1008-1704.2022.03.027.陈君耀, 黎才洋, 官宏勇. 多模态超声成像技术在肝癌高危人群筛查中综合运用策略研究[J]. 肝脏, 2022, 27( 3): 288- 291. DOI: 10.14000/j.cnki.issn.1008-1704.2022.03.027. [17] WU XQ, LING JR, LING J, et al. Application of multimodal ultrasound imaging technology in early screening of liver cancer in middle-aged and elderly people[J]. China Med Equip, 2022, 19( 10): 83- 87. DOI: 10.3969/J.ISSN.1672-8270.2022.10.019.吴秀琴, 凌建容, 凌婧, 等. 多模态超声成像技术在中老年人群早期肝癌筛查中的应用[J]. 中国医学装备, 2022, 19( 10): 83- 87. DOI: 10.3969/J.ISSN.1672-8270.2022.10.019. [18] URHUȚ MC, SĂNDULESCU LD, CIOCÂLTEU A, et al. The clinical value of multimodal ultrasound for the differential diagnosis of hepatocellular carcinoma from other liver tumors in relation to histopathology[J]. Diagnostics, 2023, 13( 20): 3288. DOI: 10.3390/diagnostics13203288. [19] HU J, ZHOU ZY, RAN HL, et al. Diagnosis of liver tumors by multimodal ultrasound imaging[J]. Medicine(Baltimore), 2020, 99( 32): e21652. DOI: 10.1097/MD.0000000000021652. [20] QU MJ. Value of 4-D contrast-enhanced ultrasound combined with shear-wave elastography in the diagnosis of benign and malignant focal liver lesions[D]. Dalian: Dalian Medical University, 2022.曲美景. 四维超声造影联合剪切波弹性成像对肝脏局灶性病变良恶性的诊断价值[D]. 大连: 大连医科大学, 2022. [21] WU JP, SHU R, ZHAO YZ, et al. Comparison of contrast-enhanced ultrasonography with virtual touch tissue quantification in the evaluation of focal liver lesions[J]. J Clin Ultrasound, 2016, 44( 6): 347- 353. DOI: 10.1002/jcu.22335. [22] YANG JD, HAINAUT P, GORES GJ, et al. A global view of hepatocellular carcinoma: Trends, risk, prevention and management[J]. Nat Rev Gastroenterol Hepatol, 2019, 16( 10): 589- 604. DOI: 10.1038/s41575-019-0186-y. [23] CHEN M, GAO N, REN XY, et al. Study on the diagnostic value of contrast-enhanced ultrasound in focal lesions of transplanted liver[J]. Clin J Med Offic, 2023, 51( 3): 279- 281. DOI: 10.16680/j.1671-3826.2023.03.16.陈梅, 高农, 任秀昀, 等. 超声造影对移植肝局灶性病变诊断价值研究[J]. 临床军医杂志, 2023, 51( 3): 279- 281. DOI: 10.16680/j.1671-3826.2023.03.16. [24] LIU FL. Comparison of contrast-enhanced ultrasonography and color Doppler ultrasonography in the diagnosis of hepatic tumors[J]. Guide China Med, 2020, 18( 18): 82- 83. DOI: 10.15912/j.cnki.gocm.2020.18.037.刘凤兰. 超声造影与彩色多普勒超声在肝肿瘤诊断中的效果对比[J]. 中国医药指南, 2020, 18( 18): 82- 83. DOI: 10.15912/j.cnki.gocm.2020.18.037. [25] JOCIUS D, VAJAUSKAS D, SAMUILIS A, et al. Assessing liver fibrosis using 2D-SWE liver ultrasound elastography and dynamic liver scintigraphy with 99mTc-mebrofenin: A comparative prospective single-center study[J]. Medicina(Kaunas), 2023, 59( 3): 479. DOI: 10.3390/medicina59030479. [26] ZHENG Z. Progress in clinical application of shear wave elastography[J]. J Qiqihar Med Univ, 2023, 44( 12): 1166- 1170. DOI: 10.3969/j.issn.1002-1256.2023.12.014.郑直. 剪切波弹性成像临床应用进展[J]. 齐齐哈尔医学院学报, 2023, 44( 12): 1166- 1170. DOI: 10.3969/j.issn.1002-1256.2023.12.014. [27] LIU BR, DONG X, HUANG LP. Diagnostic efficacy of shear wave elastography in evaluating chronic hepatitis B liver fibrosis and related influencing factors[J]. J Clin Hepatol, 2018, 34( 11): 2329- 2333. DOI: 10.3969/j.issn.1001-5256.2018.11.012.刘博儒, 董雪, 黄丽萍. 剪切波弹性成像评估慢性乙型肝炎肝纤维化的价值及影响因素[J]. 临床肝胆病杂志, 2018, 34( 11): 2329- 2333. DOI: 10.3969/j.issn.1001-5256.2018.11.012. -



 PDF下载 ( 0 KB)
PDF下载 ( 0 KB)

 下载:
下载: