第三腰椎骨骼肌指数联合白细胞介素6、激活素A对胰腺癌恶病质的早期预测价值
DOI: 10.12449/JCH240624
Value of skeletal muscle index combined with interleukin-6 and activin A in predicting early-stage pancreatic cancer cachexia
-
摘要:
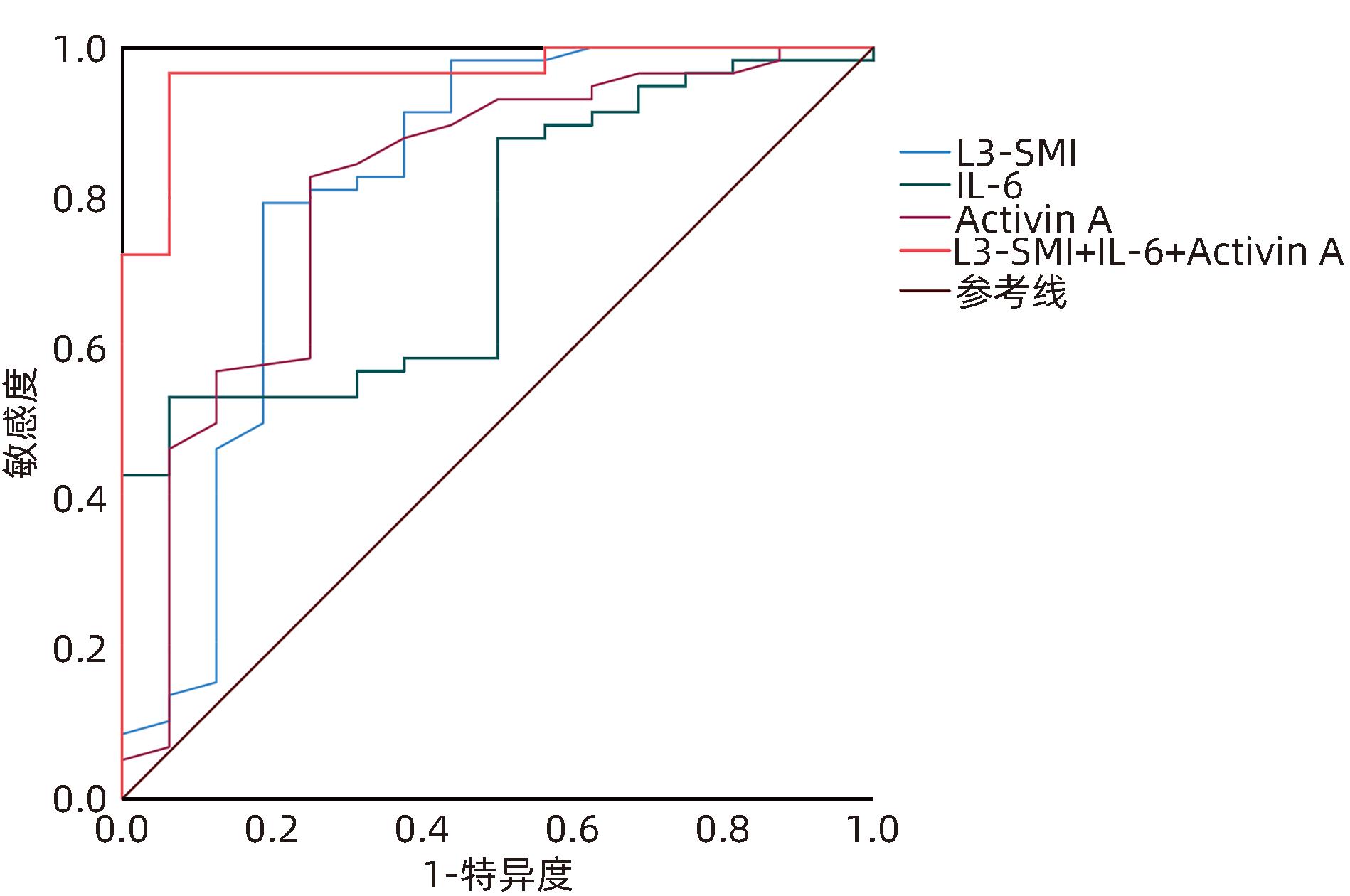
目的 研究第三腰椎骨骼肌指数(L3-SMI)联合白细胞介素6(IL-6)、激活素A(Activin A)检测对胰腺癌恶病质的早期预测价值。 方法 将2020年7月—2023年7月经河北医科大学第四医院确诊的74例胰腺癌患者纳入研究。根据患者入院后是否发生恶病质,分为恶病质组(n=58)、非恶病质组(n=16)。观测患者入院后48 h内的L3-SMI、IL-6、Activin A水平。正态分布的计量资料两组间比较采用成组t检验;计数资料组间比较采用χ2检验。采用多因素Logistic回归分析筛选胰腺癌恶病质的影响因素,并通过受试者工作特征曲线(ROC曲线)分析L3-SMI以及血清IL-6、Activin A单独或联合检测对胰腺癌恶病质的预测价值。ROC曲线下面积(AUC)比较采用Z检验。 结果 恶病质组L3-SMI水平明显低于非恶病质组,血清IL-6、Activin A水平明显高于非恶病质组(t值分别为8.649、3.049、8.100,P值均<0.05)。多因素Logistic回归分析结果显示,L3-SMI(OR=0.266,95%CI:0.103~0.683)以及血清IL-6(OR=4.158,95%CI:1.368~12.333)、Activin A(OR=5.124,95%CI:1.550~16.939)是胰腺癌恶病质发生的影响因素(P值均<0.05)。L3-SMI、IL-6、Activin A预测胰腺癌恶病质的AUC分别为0.851、0.752、0.791,均明显低于三者联合检测的0.946(Z值分别为-2.841、-2.552、-2.647,P值均<0.001),其敏感度、特异度、约登指数最高,分别为90.9%、87.8%、0.788。 结论 L3-SMI联合血清IL-6、Activin A检测对胰腺癌恶病质具有较好的早期预测价值。 Abstract:Objective To investigate the value of L3 skeletal muscle index (L3-SMI) combined with interleukin-6 (IL-6) and activin A in predicting early-stage pancreatic cancer cachexia. Methods A total of 74 patients with pancreatic cancer who were diagnosed in Hebei Medical University Forth Hospital from July 2020 to July 2023 were enrolled, and according to the presence or absence of cachexia after admission, the patient were divided into cachexia group with 58 patients and non-cachexia group with 16 patients. The levels of L3-SMI, IL-6, and activin A were observed within 48 hours after admission. The independent-samples t test was used for comparison of normally distributed continuous data between groups, and the chi-square test was used for comparison of categorical data between groups. A multivariate Logistic regression analysis was used to investigate the influencing factors for pancreatic cancer cachexia; the receiver operating characteristic (ROC) curve was used to analyze the value of L3-SMI, IL-6, and activin A alone or in combination in predicting pancreatic cancer cachexia, and the Z test was used for comparison of the area under the ROC curve (AUC). Results Compared with the non-cachexia group, the cachexia group had a significantly higher level of L3-SMI and significantly lower serum levels of IL-6 and activin A (t=8.649, 3.049, and 8.100, all P<0.05). The multivariate logistic analysis showed that L3-SMI (odds ratio [OR]=0.266, 95% confidence interval [CI]: 0.103 — 0.683, P<0.05), serum IL-6 (OR=4.158, 95%CI: 1.368 — 12.333, P<0.05), and activin A (OR=5.124, 95%CI: 1.550 — 16.939, P<0.05) were influencing factors for pancreatic cancer cachexia. L3-SMI, IL-6, and activin A alone had a significantly lower AUC than the combination of the three indicators in predicting pancreatic cancer cachexia (0.851/0.752/0.791 vs 0.946, Z=-2.841, -2.552, and -2.647, all P<0.001), and the combination of the three indicators had the highest sensitivity (90.9%), specificity (87.8%) and Youden index (0.788). Conclusion L3-SMI combined with serum IL-6 and activin A has a good value in predicting early-stage pancreatic cancer cachexia. -
Key words:
- Pancreatic Neoplasms /
- Muscle, Skeletal /
- Interleukin-6 /
- Activins /
- Cachexia
-
表 1 两组患者基线资料比较
Table 1. Cmparison of the baseline data between the two groups
指标 恶病质组(n=58) 非恶病质组(n=16) χ2值 P值 性别[例(%)] 0.416 0.519 男 31(53.4) 10(62.5) 女 27(46.6) 6(37.5) 年龄[例(%)] 0.083 0.774 ≥65岁 42(72.4) 11(68.7) <65岁 16(27.6) 5(31.3) 肿瘤大小[例(%)] 0.019 0.984 ≥3 cm 47(81.0) 13(81.2) <3 cm 11(19.0) 3(18.8) TNM分期[例(%)] 8.919 0.030 Ⅰ期 0(0.0) 1(6.2) Ⅱ期 11(19.0) 6(37.5) Ⅲ期 20(34.5) 3(18.8) Ⅳ期 27(46.5) 6(37.5) 肿瘤组织学分型[例(%)] 0.783 0.676 低分化 8(13.8) 2(12.5) 中分化 28(48.3) 6(37.5) 高分化 22(37.9) 8(50.0) BMI分类[例(%)] 6.948 0.031 正常体质量 30(51.7) 12(75.0) 低体质量 24(41.4) 1(6.2) 超重或肥胖 4(6.9) 3(18.8) NRS2002[例(%)] 7.485 0.006 ≥3分 40(69.0) 5(31.2) <3分 18(31.0) 11(68.8) PG-SGA[例(%)] 14.233 <0.001 ≥4分 44(75.9) 4(25.0) <4分 14(24.1) 12(75.0) 注:正常体质量,18.5 kg/m2≤BMI<24.0 kg/m2;低体质量,BMI<18.5 kg/m2;超重或肥胖,BMI≥24 kg/m2。
表 2 两组患者L3-SMI、IL-6、Activin A水平比较
Table 2. Cmparison of the level of L3-SMI,IL-6,Activin A between the two groups
指标 恶病质组
(n=58)
非恶病质组
(n=16)
t值 P值 L3-SMI(cm2/m2) 28.44±4.32 39.45±5.16 8.649 <0.001 IL-6(ng/L) 6.52±2.44 4.48±2.08 3.049 0.003 Activin A(ng/L) 0.61±0.15 0.28±0.12 8.100 <0.001 表 3 胰腺癌恶病质发生的多因素Logistic回归分析
Table 3. Multivariate Logistic regression analysis of the occurrence of pancreatic cancer cachexia
因素 β SE Wald P值 OR 95%CI 常数项 -0.954 0.495 4.033 0.045 0.373 0.143~0.977 L3-SMI -1.326 0.482 7.568 0.006 0.266 0.103~0.683 IL-6 1.425 0.567 6.316 0.012 4.158 1.368~12.233 Activin A 1.634 0.610 7.175 0.007 5.124 1.550~16.939 表 4 L3-SMI、IL-6、Activin A单独或联合检测对胰腺癌恶病质的预测价值
Table 4. Predictive value of L3-SMI, IL-6, and Activin A measured alone or in combination for pancreatic cancer cachexia
因素 AUC 特异度(%) 敏感度(%) cut-off值 约登指数 95%CI L3-SMI 0.851 84.6 78.8 32.5 cm2/m2 0.634 0.750~0.953 IL-6 0.752 52.6 82.6 5.2 ng/L 0.353 0.633~0.871 Activin A 0.791 66.7 81.8 0.44 ng/L 0.485 0.674~0.909 L3-SMI+IL-6+Activin A 0.946 87.8 90.9 0.788 0.890~1.000 -
[1] ZHAN HX, LI YZ, HU SY. Tissue wasting and perioperative treatment strategies of pancreatic cancer patients[J]. Chin J Dig Surg, 2021, 20( 4): 407- 413. DOI: 10.3760/cma.j.cn115610-20210217-00079.展翰翔, 李永政, 胡三元. 胰腺癌病人组织消耗与围术期处理策略[J]. 中华消化外科杂志, 2021, 20( 4): 407- 413. DOI: 10.3760/cma.j.cn115610-20210217-00079. [2] ROBERTS DA, WATSON E, MACDONALD C, et al. Management of pain and Cachexia in pancreatic cancer: Protocol for two systematic reviews, network meta-analysis, surveys, and focus groups[J]. JMIR Res Protoc, 2023, 12: e46335. DOI: 10.2196/46335. [3] FAN M, GU XF, ZHANG WL, et al. Atractylenolide I ameliorates cancer cachexia through inhibiting biogenesis of IL-6 and tumour-derived extracellular vesicles[J]. J Cachexia Sarcopenia Muscle, 2022, 13( 6): 2724- 2739. DOI: 10.1002/jcsm.13079. [4] DAITOKU N, MIYAMOTO Y, HIYOSHI Y, et al. Activin A promotes cell proliferation, invasion and migration and predicts poor prognosis in patients with colorectal cancer[J]. Oncol Rep, 2022, 47( 6): 107. DOI: 10.3892/or.2022.8318. [5] Pancreatic Committee of Chinese Anti-Cancer Association. Comprehensive guidelines for the diagnosis and treatment of pancreatic cancer(2018 version)[J]. J Clin Hepatol, 2018, 34( 10): 2109- 2120. DOI: 10.3969/j.issn.1001-5256.2018.10.011.中国抗癌协会胰腺癌专业委员会. 胰腺癌综合诊治指南(2018版)[J]. 临床肝胆病杂志, 2018, 34( 10): 2109- 2120. DOI: 10.3969/j.issn.1001-5256.2018.10.011. [6] BABIC A, ROSENTHAL MH, SUNDARESAN TK, et al. Adipose tissue and skeletal muscle wasting precede clinical diagnosis of pancreatic cancer[J]. Nat Commun, 2023, 14( 1): 4317. DOI: 10.1038/s41467-023-40024-3. [7] SUN H, XU H, LU YY, et al. Clinical value of nutritional risk screening tools in identifying sarcopenia in patients with gastric cancer[J]. J Clin Med Pract, 2023, 27( 2): 78- 83. DOI: 10.7619/jcmp.20223111.孙慧, 徐慧, 陆滢滢, 等. 营养风险筛查工具识别胃癌患者肌减少症的临床价值[J]. 实用临床医药杂志, 2023, 27( 2): 78- 83. DOI: 10.7619/jcmp.20223111. [8] MARTIN A, FREYSSENET D. Phenotypic features of cancer cachexia-related loss of skeletal muscle mass and function: Lessons from human and animal studies[J]. J Cachexia Sarcopenia Muscle, 2021, 12( 2): 252- 273. DOI: 10.1002/jcsm.12678. [9] ZENG X, SHI ZW, YU JJ, et al. Sarcopenia as a prognostic predictor of liver cirrhosis: A multicentre study in China[J]. J Cachexia Sarcopenia Muscle, 2021, 12( 6): 1948- 1958. DOI: 10.1002/jcsm.12797. [10] WAKABAYASHI H, ARAI H, INUI A. The regulatory approval of anamorelin for treatment of cachexia in patients with non-small cell lung cancer, gastric cancer, pancreatic cancer, and colorectal cancer in Japan: Facts and numbers[J]. J Cachexia Sarcopenia Muscle, 2021, 12( 1): 14- 16. DOI: 10.1002/jcsm.12675. [11] YU ZL, SHANG NJ. Correlation between intramuscular fatty infiltration and sarcopenia after radical gastrectomy in elderly patients with gastric cancer[J]. J Mod Oncol, 2022, 30( 19): 3539- 3543. DOI: 10.3969/j.issn.1672-4992.2022.19.018.于子玲, 尚乃舰. 肌内脂肪浸润与老年胃癌根治术后肌少症的相关性[J]. 现代肿瘤医学, 2022, 30( 19): 3539- 3543. DOI: 10.3969/j.issn.1672-4992.2022.19.018. [12] ZHAO ZY, ZHANG YY, ZHAN XB. The value of skeletal muscle index of the third lumbar vertebra in nutritional risk assessment and prognosis of patients with advanced gastric cancer[J]. Mod Med J, 2022, 50( 11): 1371- 1376. DOI: 10.3969/j.issn.1671-7562.2022.11.003.赵志越, 张颖一, 湛先保. 第三腰椎骨骼肌指数在晚期胃癌患者营养风险评估及预后中的价值[J]. 现代医学, 2022, 50( 11): 1371- 1376. DOI: 10.3969/j.issn.1671-7562.2022.11.003. [13] POTOTSCHNIG I, FEILER U, DIWOKY C, et al. Interleukin-6 initiates muscle- and adipose tissue wasting in a novel C57BL/6 model of cancer-associated cachexia[J]. J Cachexia Sarcopenia Muscle, 2023, 14( 1): 93- 107. DOI: 10.1002/jcsm.13109. [14] QIU ZL, WO D, ZHONG XM, et al. Babao Dan alleviates cancer Cachexia in mice via inhibiting IL-6/STAT3 signaling pathway[J]. Integr Cancer Ther, 2023, 22: 15347354231168369. DOI: 10.1177/15347354231168369. [15] SHUKLA SK, MARKOV SD, ATTRI KS, et al. Macrophages potentiate STAT3 signaling in skeletal muscles and regulate pancreatic cancer cachexia[J]. Cancer Lett, 2020, 484: 29- 39. DOI: 10.1016/j.canlet.2020.04.017. [16] XU PC, YOU M, YU SY, et al. Visceral adipose tissue remodeling in pancreatic ductal adenocarcinoma cachexia: The role of activin A signaling[J]. Sci Rep, 2022, 12( 1): 1659. DOI: 10.1038/s41598-022-05660-7. [17] PINJUSIC K, AMBROSINI G, LOURENCO J, et al. Inhibition of anti-tumor immunity by melanoma cell-derived Activin-A depends on STING[J]. Front Immunol, 2024, 14: 1335207. DOI: 10.3389/fimmu.2023.1335207. [18] JIA SQ, ZHOU QY, LIU HM, et al. The mortality trend of digestive tract malignant tumor in China from 2004 to 2018[J]. Chin J Dis Contr Prev, 2021, 25( 9): 1020- 1025. DOI: 10.16462/j.cnki.zhjbkz.2021.09.006.贾善群, 周乾宇, 刘慧敏, 等. 2004―2018年中国消化道恶性肿瘤死亡趋势[J]. 中华疾病控制杂志, 2021, 25( 9): 1020- 1025. DOI: 10.16462/j.cnki.zhjbkz.2021.09.006. [19] CAI J, CHEN HD, LU M, et al. Trend analysis on morbidity and mortality of pancreatic cancer in China, 2005-2015[J]. Chin J Epidemiol, 2021, 42( 5): 794- 800. DOI: 10.3760/cma.j.cn112338-20201115-01328.蔡洁, 陈宏达, 卢明, 等. 2005—2015年中国胰腺癌发病与死亡趋势分析[J]. 中华流行病学杂志, 2021, 42( 5): 794- 800. DOI: 10.3760/cma.j.cn112338-20201115-01328. [20] WANG S, DU L, CHEN H, et al. Paracrine production of IL-6 promotes a hypercoagulable state in pancreatic cancer[J]. Am J Cancer Res, 2021, 11( 12): 5992- 6003. -



 PDF下载 ( 670 KB)
PDF下载 ( 670 KB)

 下载:
下载:


