胆囊肉瘤样癌16例临床诊治及预后分析
DOI: 10.12449/JCH240420
Clinical diagnosis, treatment, and prognosis of gallbladder sarcomatoid carcinoma: An analysis of 16 cases
-
摘要:
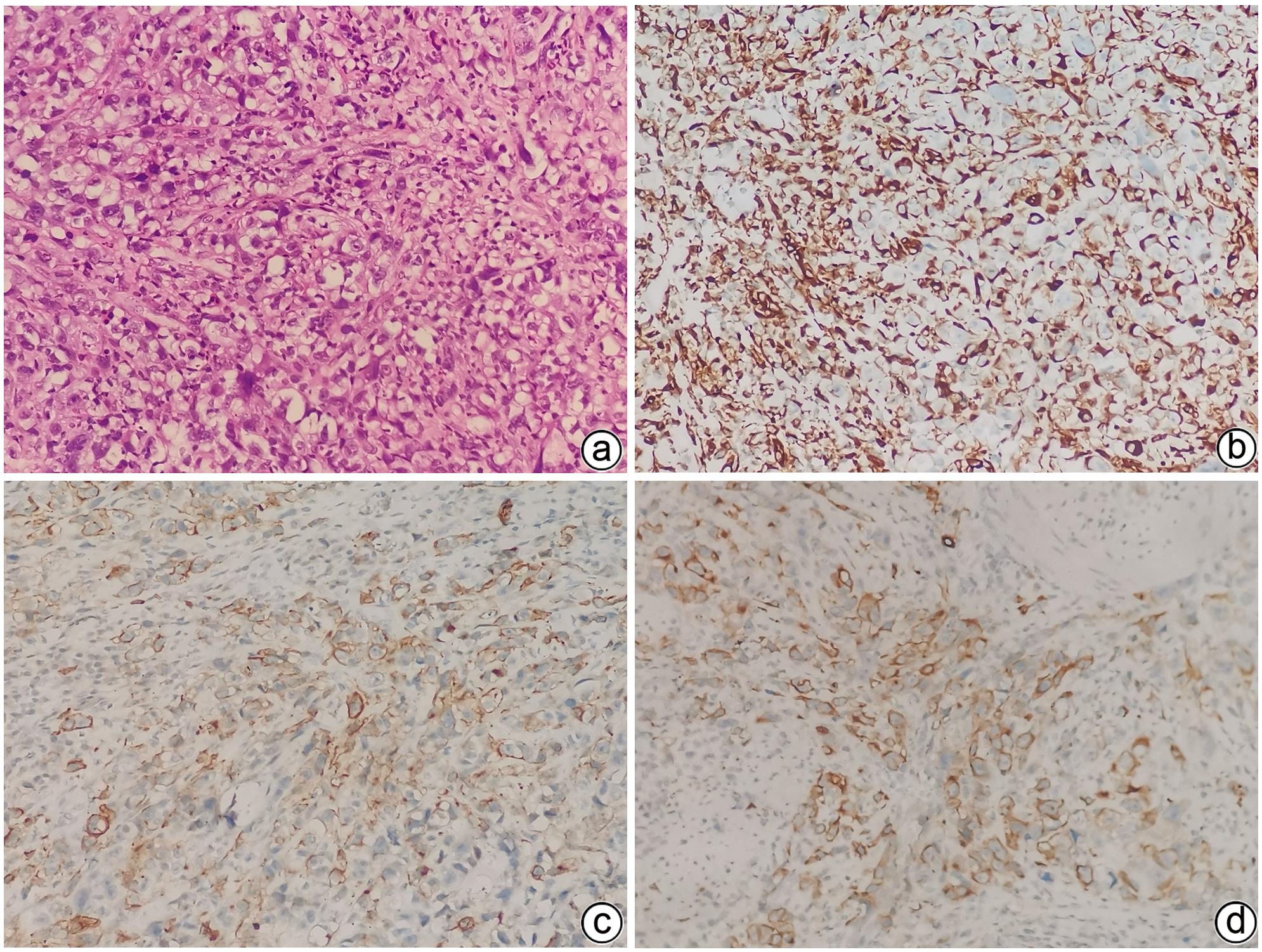
目的 分析胆囊肉瘤样癌(GBSC)的临床病理特征、诊疗方法及预后。 方法 回顾性分析2015年1月—2023年4月郑州大学第一附属医院收治的16例胆囊肉瘤样癌患者的临床资料,包括患者的一般资料、临床表现、影像学特点、病理学特点和治疗方式等,并进行随访。采用Kaplan-Meier法进行生存分析,并绘制生存曲线,Log-rank检验比较组间差异。 结果 16例患者中男6例,女10例,年龄(62.9±8.4)岁。主要临床表现为右上腹痛13例(81.3%)、恶心5例(31.3%)、腹胀4例(25.0%)、纳差3例(18.8%)、乏力2例(12.5%)、发热2例(12.5%)、黄疸1例(6.3%),3例为无症状体检发现。其中81.3%(13/16)的患者初诊时处于疾病晚期(Ⅲ/Ⅳ期)。组织病理学表现:镜下观部分癌细胞呈梭形,核分裂像多见且异形性明显。免疫组化分析显示:Vimentin阳性表达率100%(16/16),AE1/AE3阳性表达率100%(16/16),CK8/18阳性表达率100%(16/16),81.3%(13/16)的患者Ki-67增殖指数高表达(≥50%),中位数为70%(范围:20%~90%)。16例患者均行手术治疗,根治性手术11例,姑息性手术5例,其中R0切除者9例,R1切除者2例,R2切除者5例,7例术后接受辅助治疗。16例患者均取得有效随访,随访0.5~26.0个月,中位随访时间11.0个月。至随访结束,2例患者存活,14例患者死亡,死亡原因均为肿瘤复发或转移,中位生存时间为10.0个月,术后1年、2年累积生存率分别为31.3%、8.3%。预后分析显示TNM分期(χ2=6.727,P=0.009)、手术方式(χ2=7.508,P=0.006)、切缘情况(χ2=7.934,P=0.005)、辅助治疗(χ2=4.608,P=0.032)与患者预后相关。 结论 胆囊肉瘤样癌的临床表现无特异性,确诊依赖免疫组化,大多数患者初诊时疾病处于晚期,总体预后较差,目前尚无针对性治疗方法,切缘阴性的根治性手术及辅助治疗可提高患者的生存率。 Abstract:Objective To investigate the clinicopathological features, diagnosis and treatment methods, and prognosis of gallbladder sarcomatoid carcinoma (GBSC). Methods A retrospective analysis was performed for the clinical data of 16 patients with GBSC who were admitted to The First Affiliated Hospital of Zhengzhou University from January 2015 to April 2023, including general information, clinical manifestations, imaging features, pathological features, and treatment modality, and follow-up was performed for all patients. The Kaplan-Meier method was used to perform the survival analysis and plot the survival curve, and the Log-rank test was used for comparison between groups. Results Among the 16 patients, there were 6 male patients and 10 female patients, with a mean age of 62.9±8.4 years. The main clinical manifestations were right upper abdominal pain in 13 patients (81.3%), nausea in 5 patients (31.3%), abdominal distension in 4 patients (25.0%), poor appetite in 3 patients (18.8%), weakness in 2 patients (12.5%), fever in 2 patients (12.5%), and jaundice in 1 patient (6.3%), and 3 patients were asymptomatic and were found to have this disease by physical examination. Of all patients, 81.3% (13/16) were in the advanced stage (stage Ⅲ/Ⅳ) at the time of initial diagnosis. Histopathological examination showed that some cancer cells were spindle-shaped under the microscope, with marked nuclear division and noticeable heteromorphism. Immunohistochemistry showed a positive expression rate of 100% (16/16) for Vimentin, AE1/AE3, and CK8/18, and Ki-67 proliferation index was highly expressed in 81.3% (13/16) of the patients (≥50%), with a median of 70% (range 20% — 90%). All 16 patients underwent surgical treatment, with radical surgery in 11 patients and palliative surgery in 5 patients, among whom 9 received R0 resection, 2 received R1 resection, and 5 received R2 resection, and 7 patients received adjuvant therapy after surgery. Effective follow-up was achieved for all 16 patients, with a follow-up time of 0.5 — 26.0 months and a median follow-up time of 11.0 months. By the end of follow-up, 2 patients survived and 14 patients died due to tumor recurrence or metastasis, with a median survival time of 10.0 months, and the 1- and 2-year cumulative survival rates after surgery were 31.3% and 8.3%, respectively. The prognostic analysis showed that TNM stage (χ2=6.727, P=0.009), surgical approach (χ2=7.508, P=0.006), margin condition (χ2=7.934, P=0.005), and adjuvant therapy (χ2=4.608, P=0.032) were associated with the prognosis of patients. Conclusion The clinical manifestations of GBSC lack specificity, and a confirmed diagnosis relies on immunohistochemical analysis. Most patients are in the advanced disease at the time of initial diagnosis and tend to have a poor prognosis. There are currently no targeted therapies for this disease, and radical surgery with negative margins and adjuvant therapy can improve the survival rate of patients. -
Key words:
- Gallbladder Neoplasms /
- Immunohistochemistry /
- Prognosis /
- Therapeutics
-
表 1 16例GBSC患者的治疗方式及预后
Table 1. Treatment and prognosis of 16 patients with gallbladder sarcomatoid carcinoma
序号 性别/年龄(岁) TNM分期 手术方式 切缘 辅助治疗 生存时间(月) 1 女/44 Ⅳa 胆囊切除+胆囊床部分肝组织楔形切除+肝十二指肠韧带淋巴结清扫 R0 化疗+免疫 11.0 2 女/59 Ⅰa 胆囊切除 R0 化疗 18.0 3 男/70 Ⅲb 胆囊切除+胆囊床部分肝组织楔形切除+肝十二指肠韧带淋巴结清扫 R0 无 12.0 4 男/68 Ⅱa 胆囊切除+胆囊床部分肝组织楔形切除+肝十二指肠韧带淋巴结清扫 R0 化疗 26.0 5 女/69 Ⅳa 胆囊姑息性切除术 R2 无 4.0 6 女/68 Ⅲb 胆囊切除+胆囊床部分肝组织楔形切除+肝十二指肠韧带淋巴结清扫 R0 化疗+免疫 17.0 7 男/68 Ⅳb 胆囊切除+胆囊床部分肝组织楔形切除+部分十二指肠切除+结肠部分切除+胃肠吻合术 R1 化疗 12.0 8 女/57 Ⅳa 胆囊切除+胆囊床部分肝组织楔形切除+肝十二指肠韧带淋巴结清扫 R0 化疗+免疫 20.0 9 女/64 Ⅱb 胆囊切除 R0 无 20.0 10 男/56 Ⅲb 胆囊切除+胆囊床部分肝组织楔形切除+肝十二指肠韧带淋巴结清扫 R0 无 6.0 11 男/70 Ⅳa 胆囊姑息性切除术+肝门部淋巴结活检 R2 无 7.0 12 女/63 Ⅲb 胆囊切除+胆囊床部分肝组织楔形切除+肝十二指肠韧带淋巴结清扫 R0 化疗+靶向 4.0 13 女/65 Ⅲb 胆囊姑息性切除 R2 无 0.5 14 女/50 Ⅳb 胆囊切除+胆囊床部分肝组织楔形切除+肝十二指肠韧带淋巴结清扫 R1 无 1.0 15 男/58 Ⅲa 剖腹探查+小网膜穿刺活检术 R2 无 10.0 16 女/77 Ⅳb 剖腹探查+胆囊造瘘+胆囊活检术+大网膜穿刺活检 R2 无 2.0 注:至随访结束例2和例4患者仍存活。 表 2 16例GBSC患者预后分析
Table 2. Prognosis analysis of 16 patients with gallbladder sarcomatoid carcinoma
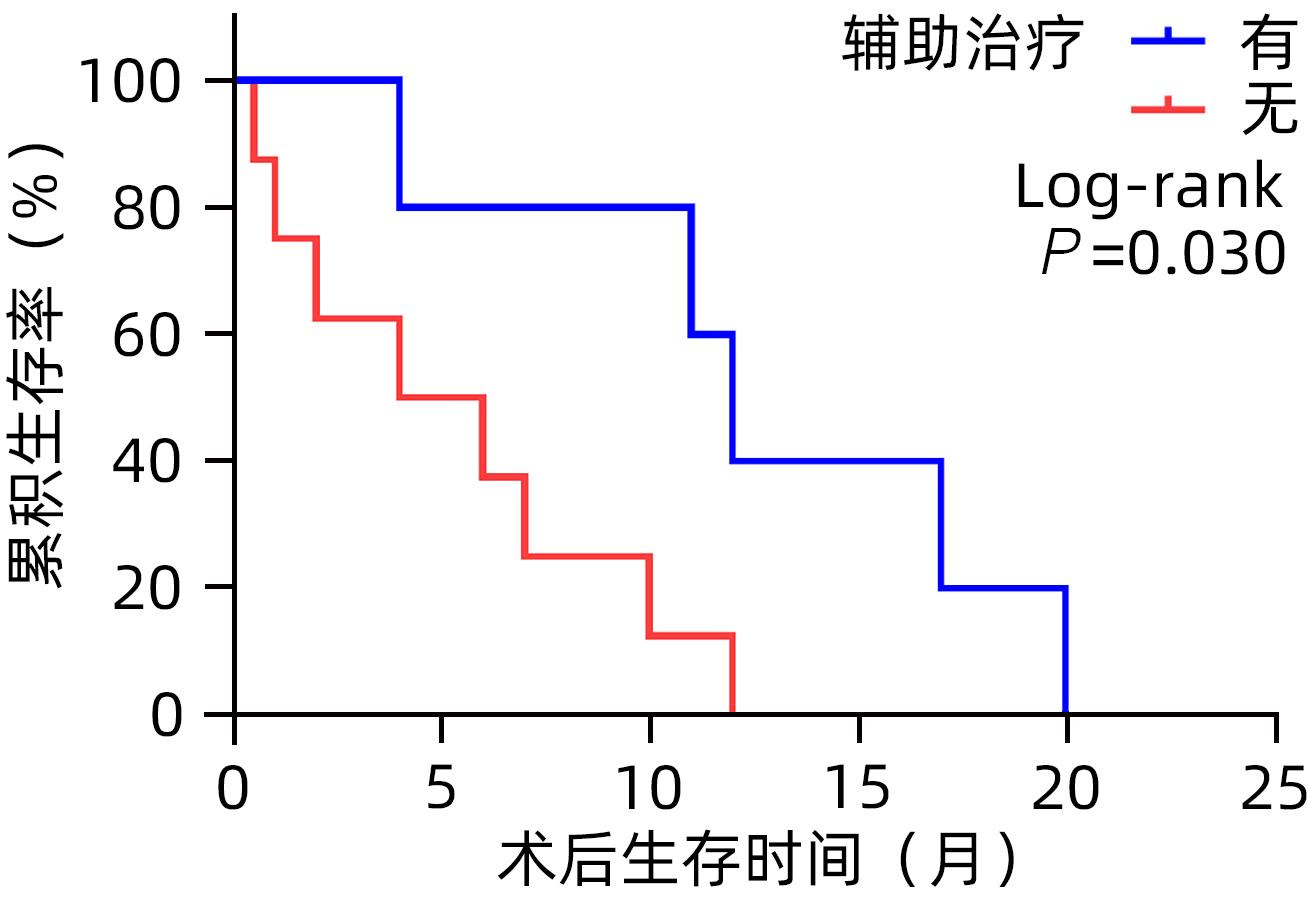
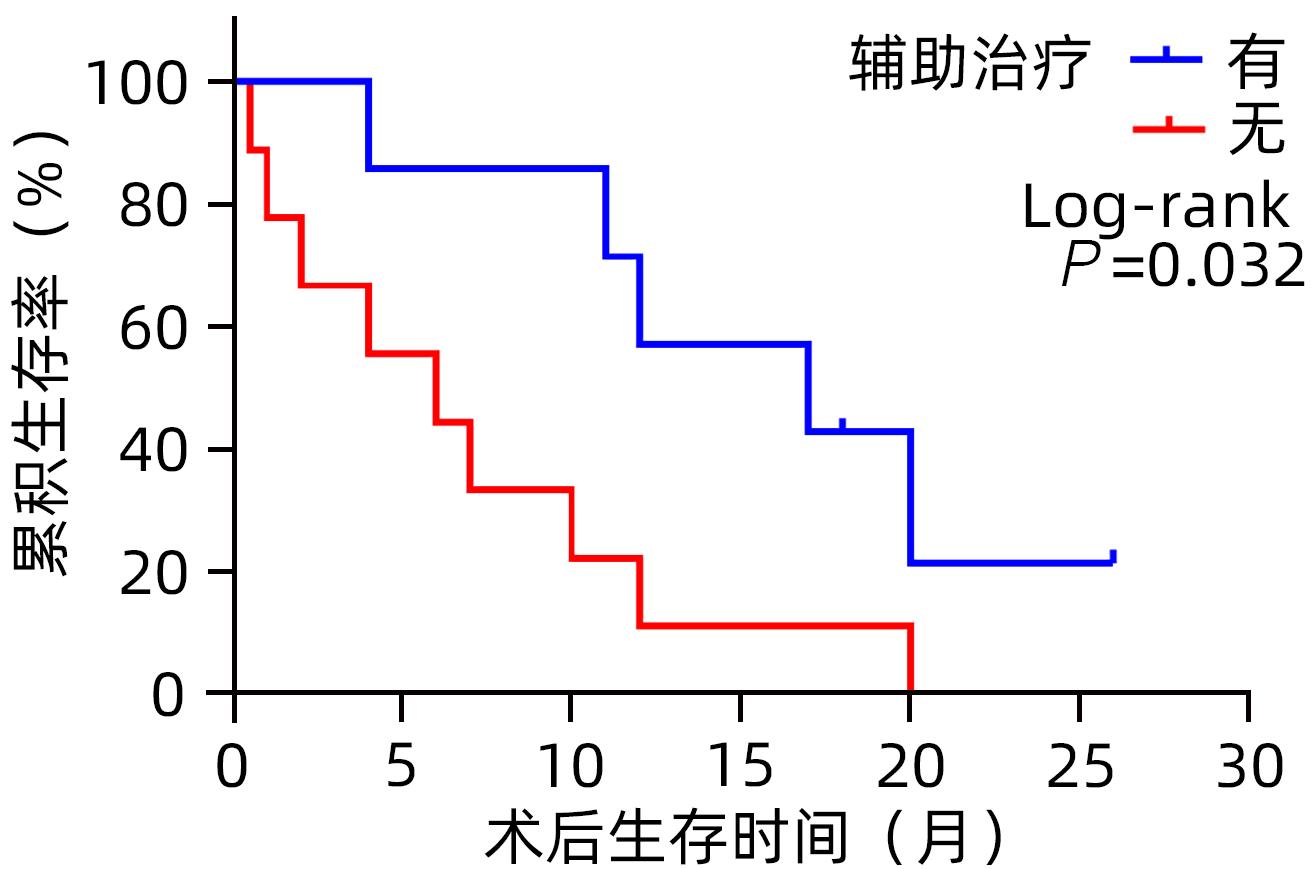
因素 例数 1年累积生存率(%) χ2值 P值 性别 0.174 0.677 男 6 16.7 女 10 40.0 年龄 0.082 0.775 <65岁 8 25.0 ≥65岁 8 37.5 肿瘤大小 1.411 0.235 <5 cm 11 27.3 ≥5 cm 5 40.0 TNM分期 6.727 0.009 Ⅰ/Ⅱ期 3 100 Ⅲ/Ⅳ期 13 15.4 手术方式 根治性 11 63.6 7.508 0.006 姑息性 5 0 切缘 R0 9 55.6 7.934 0.005 R1/R2 7 0 辅助治疗 有 7 57.1 4.608 0.032 无 9 11.1 -
[1] LIMAIEM F, BAYAR R, OMRANI S. Sarcomatoid carcinoma of the gallbladder: A rare and aggressive form of gallbladder cancer[J]. Clin Case Rep, 2023, 11( 1): e6876. DOI: 10.1002/ccr3.6876. [2] ZOU RQ, HU HJ, LV TR, et al. Clinicopathological characteristics and outcome of primary sarcomatoid carcinoma of the gallbladder[J]. Front Oncol, 2022, 12: 1009673. DOI: 10.3389/fonc.2022.1009673. [3] LIU KH, YEH TS, HWANG TL, et al. Surgical management of gallbladder sarcomatoid carcinoma[J]. World J Gastroenterol, 2009, 15( 15): 1876- 1879. DOI: 10.3748/wjg.15.1876. [4] RAHMAN R, SIMOES EJ, SCHMALTZ C, et al. Trend analysis and survival of primary gallbladder cancer in the United States: A 1973-2009 population-based study[J]. Cancer Med, 2017, 6( 4): 874- 880. DOI: 10.1002/cam4.1044. [5] GOTZMANN J, MIKULA M, EGER A, et al. Molecular aspects of epithelial cell plasticity: Implications for local tumor invasion and metastasis[J]. Mutat Res, 2004, 566( 1): 9- 20. DOI: 10.1016/s1383-5742(03)00033-4. [6] FU YT, CHENG AL. Vimentin induced EMT the movers in tumor invasion and metastasis[J]. Med Sci J Cent South China, 2019, 47( 1): 89- 91, 94. DOI: 10.15972/j.cnki.43-1509/r.2019.01.024.付祎婷, 程爱兰. 波形蛋白诱导EMT在肿瘤侵袭转移中的研究进展[J]. 中南医学科学杂志, 2019, 47( 1): 89- 91, 94. DOI: 10.15972/j.cnki.43-1509/r.2019.01.024. [7] HOU JN, XING LH, YUAN YF. A clinical analysis of 114 cases of sarcomatoid carcinoma of the lung[J]. Clin Exp Med, 2018, 18( 4): 555- 562. DOI: 10.1007/s10238-018-0517-2. [8] WANG QB, CUI BK, WENG JM, et al. Clinicopathological characteristics and outcome of primary sarcomatoid carcinoma and carcinosarcoma of the liver[J]. J Gastrointest Surg, 2012, 16( 9): 1715- 1726. DOI: 10.1007/s11605-012-1946-y. [9] DING L, BI ZF, YUAN H, et al. Sarcomatoid carcinoma in the head and neck: A population-based analysis of outcome and survival[J]. Laryngoscope, 2021, 131( 2): E489- E499. DOI: 10.1002/lary.28956. [10] CHENG JY, WANG CH, CHEN JH, et al. Sarcomatoid carcinomas of the liver,gallbladder,and pancreas: A clinicopathological portrait and literature review[J]. J Clin Hepatol, 2020, 36( 10): 2270- 2273. DOI: 10.3969/j.issn.1001-5256.2020.10.022.程捷瑶, 王沧海, 陈建宏, 等. 肝胆胰肉瘤样癌的临床病理特征及文献复习[J]. 临床肝胆病杂志, 2020, 36( 10): 2270- 2273. DOI: 10.3969/j.issn.1001-5256.2020.10.022. [11] RAN SH, CHEN FX, ZHANG YH, et al. The imaging findings of sarcomatoid carcinoma of gallbladder: 6 cases report[J]. Chin J Hepatobiliary Surg, 2023, 29( 5): 370- 372. DOI: 10.3760/cma.j.cn113884-20221230-00485.冉淑华, 陈凤喜, 张雨涵, 等. 胆囊肉瘤样癌6例影像学表现分析[J]. 中华肝胆外科杂志, 2023, 29( 5): 370- 372. DOI: 10.3760/cma.j.cn113884-20221230-00485. [12] KIM MJ, YU E, RO JY. Sarcomatoid carcinoma of the gallbladder with a rhabdoid tumor component[J]. Arch Pathol Lab Med, 2003, 127( 10): e406- e408. DOI: 10.5858/2003-127-e406-SCOTGW. [13] TASKIN OC, AKKAS G, MEMIS B, et al. Sarcomatoid carcinomas of the gallbladder: Clinicopathologic characteristics[J]. Virchows Arch, 2019, 475( 1): 59- 66. DOI: 10.1007/s00428-019-02583-z. [14] HU ZH, LI ZW, SHEN L, et al. Surgical therapy and prognosis of sarcomatoid carcinoma of the gallbladder[J]. Hepatobiliary Pancreat Dis Int, 2010, 9( 2): 175- 179. [15] OKABAYASHI T, SUN ZL, MONTGOMEY RA, et al. Surgical outcome of carcinosarcoma of the gall bladder: A review[J]. World J Gastroenterol, 2009, 15( 39): 4877- 4882. DOI: 10.3748/wjg.15.4877. [16] YUAN ZJ, SHUI YJ, LIU LH, et al. Postoperative recurrent patterns of gallbladder cancer: Possible implications for adjuvant therapy[J]. Radiat Oncol, 2022, 17( 1): 118. DOI: 10.1186/s13014-022-02091-6. [17] QIN Q, LIU M, WANG X. Gallbladder sarcomatoid carcinoma: Seven case reports[J]. World J Clin Cases, 2020, 8( 17): 3881- 3889. DOI: 10.12998/wjcc.v8.i17.3881. [18] BENSON AB, D’ANGELICA MI, ABBOTT DE, et al. Hepatobiliary cancers, version 2.2021, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2021, 19( 5): 541- 565. DOI: 10.6004/jnccn.2021.0022. -



 PDF下载 ( 1085 KB)
PDF下载 ( 1085 KB)


 下载:
下载: