金属夹辅助内镜超声引导组织胶注射治疗合并胃肾分流的肝硬化胃静脉曲张患者的效果初探
DOI: 10.12449/JCH240415
The preliminary therapeutic effect of endoscopic ultrasound-guided tissue adhesive injection with the assistance of metal clips in treatment of cirrhotic patients with gastric varices and gastric-renal shunt
-
摘要:
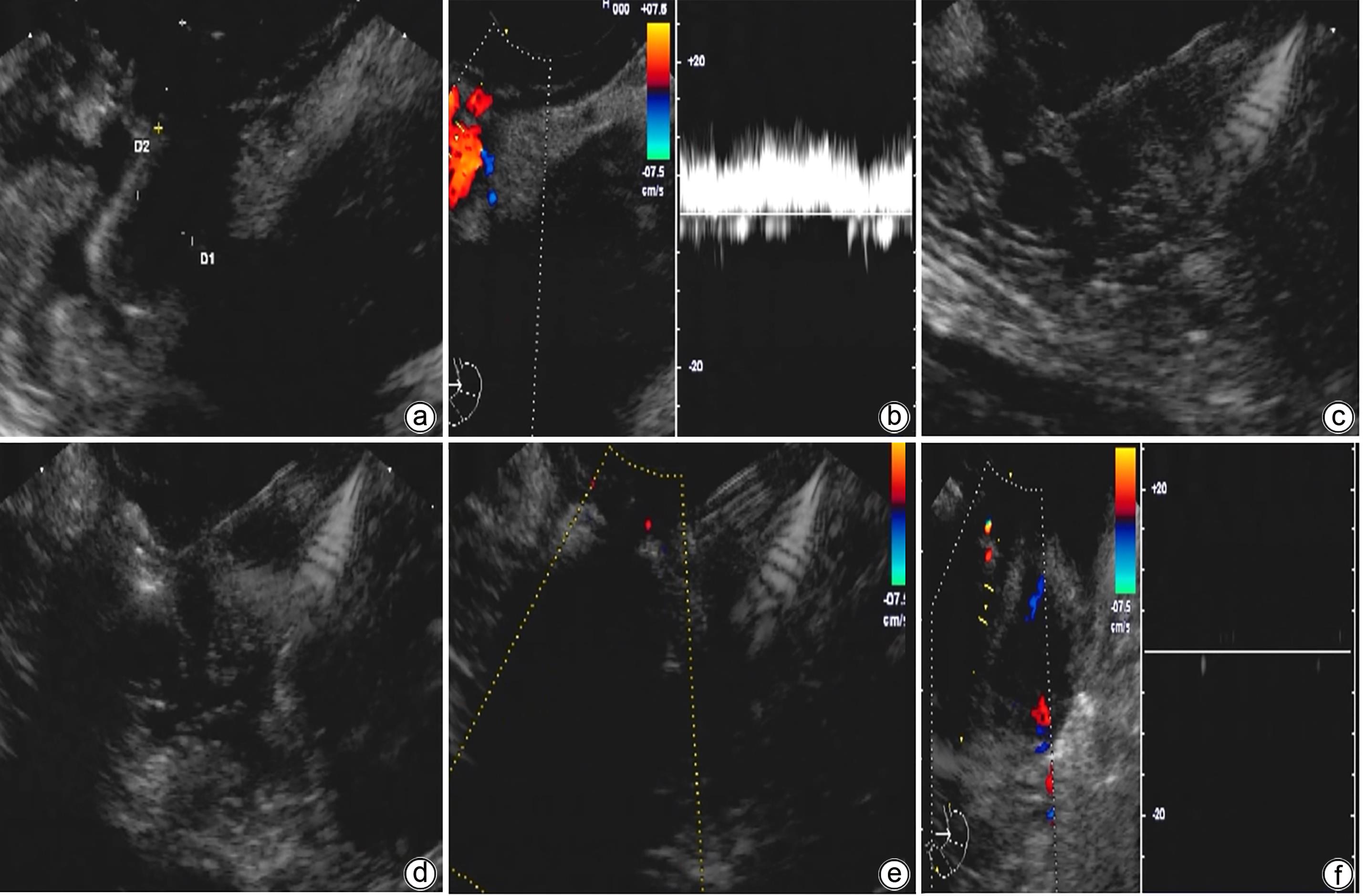
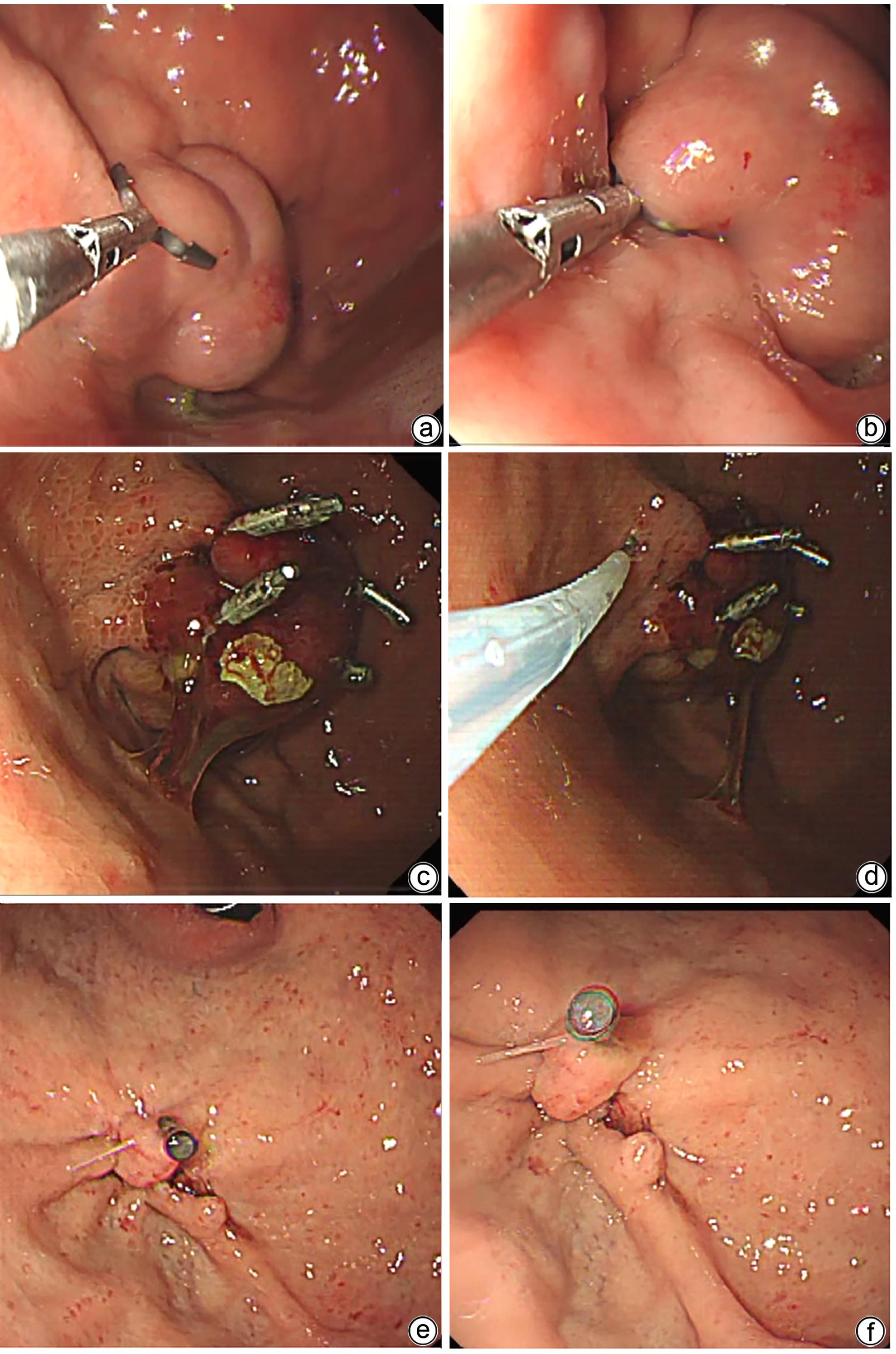
目的 探讨金属夹辅助内镜超声引导组织胶注射治疗合并胃肾分流的胃静脉曲张患者的效果及安全性。 方法 纳入2023年2月—2023年6月因肝硬化伴胃静脉曲张于首都医科大学附属北京地坛医院就诊,证实存在胃肾分流(GRS),并接受金属夹辅助内镜超声引导组织胶注射治疗的患者。主要的评价指标是术后曲张静脉减轻或消失情况,次要评价指标为手术完成情况及并发症。 结果 共11例合并GRS的胃静脉曲张患者纳入研究,男7例,女4例;中位年龄55岁;肝功能Child-Pugh A级1例,Child-Pugh B级7例,Child-Pugh C级3例;分流道最大直径(中位)8 mm,最小直径(中位)4 mm。治疗前靶血管血流中位流速11 cm/s,金属夹阻断后靶血管中位流速5 cm/s;中位组织胶使用量2 mL,聚桂醇使用量均为1 mL。所有患者手术结束后血流信号100%消失,手术成功率100%。随访6周患者均无再出血发生。术后1个月复查胃镜示静脉曲张根除或基本消失9例,静脉曲张改善2例。 结论 对于合并GRS的胃静脉曲张肝硬化患者,金属夹辅助内镜超声引导组织胶注射治疗是一种可行,安全,有效的方法。 Abstract:Objective To investigate the safety and efficacy of endoscopic ultrasound-guided tissue adhesive injection with the assistance of metal clips in the treatment of cirrhotic patients with gastric varices and gastric-renal shunt (GRS). Methods The patients who attended Beijing Ditan Hospital, Capital Medical University, due to liver cirrhosis and gastric varices from February to June 2023 were enrolled, and all patients were confirmed to have GRS and received endoscopic ultrasound-guided tissue adhesive injection with the assistance of metal clips. The primary evaluation index was alleviation or disappearance of varicose veins after surgery, and the secondary evaluation indices were surgical completion and complications. Results A total of 11 patients were enrolled in this study, among whom there were 7 male patients and 4 female patients, with a median age of 55 years. Of all patients, 1 had Child class A liver function, 7 had Child class B liver function, and 3 had Child class C liver function. The maximum (median) diameter of the shunt was 8 mm, and the minimum (median) diameter of the shunt was 4 mm. The median blood flow velocity of the target vessel was 11 cm/s before treatment and 5 cm/s after occlusion with metal clips. The median amount of tissue adhesive injected was 2 mL, and the amount of lauromacrogol used was 1 mL. Disappearance of blood flow signals was observed in all patients after surgery (100%), and the success rate of surgery was 100%. No patient experienced rebleeding after follow-up for 6 weeks. Gastroscopy at 1 month after surgery showed that gastric varices were eradicated or almost disappeared in 9 patients and were alleviated in 2 patients. Conclusion Endoscopic ultrasound-guided tissue adhesive injection with the assistance of metal clips is a feasible, safe, and effective treatment method for cirrhotic patients with gastric varices and GRS. -
Key words:
- Liver Cirrhosis /
- Esophageal and Gastric Varices /
- Metal Clips
-
表 1 11例合并GRS的胃静脉曲张肝硬化患者基本资料及金属夹辅助内镜超声引导组织胶注射治疗情况
Table 1. The data of 11 cirrhotic patients with gastric varices and GRS who received the treatment of endoscopic ultrasound guided tissue glue injection with the assistant of metal clips
编号 性别 年龄(岁) 病因 Child-Pugh 分级 分流道最大直径(mm) 分流道最小直径(mm) 靶血管最大直径(mm) 金属夹数量(个) 聚桂醇用量(mL) 组织胶使用量(mL) 随访时间(d) 并发症情况 静脉曲张改善情况 1 男 55 乙型肝炎 B 7 2 8.5 2 1 2 225 无 基本消失 2 男 40 乙型肝炎 B 9 3 9.6 3 1 2 216 无 基本消失 3 女 54 乙型肝炎 B 8 4 9.3 3 1 2 212 无 基本消失 4 女 65 乙型肝炎 A 8 3 12.2 2 1 3 208 无 基本消失 5 男 67 酒精性肝病 C 6 3 8.9 2 1 2 194 腹腔感染 改善 6 女 49 丙型肝炎 B 7 4 9.8 3 1 2 152 无 基本消失 7 男 61 乙型肝炎 B 10 6 13.0 4 1 3 143 无 基本消失 8 女 64 乙型肝炎 B 7 3 10.1 3 1 3 93 无 基本消失 9 男 60 丙型肝炎 C 9 5 11.5 2 1 3 69 无 改善 10 男 52 乙型肝炎 C 9 5 8.5 2 1 2 54 无 基本消失 11 男 53 丙型肝炎 B 10 6 12.8 4 1 3 47 无 基本消失 -
[1] ZHANG XB, LIU YD, WANG J, et al. Experience for the management of isolated gastric varices[J/CD]. Chin J Gastrointestial Endoscopy(Electronic Editon), 2023, 10( 3): 167- 172. DOI: 10.3877/cma.j.issn.2095-7157.2023.03.005.张晓彬, 刘迎娣, 王娟, 等. 孤立性胃静脉曲张临床诊疗经验[J/CD]. 中华胃肠内镜电子杂志, 2023, 10( 3): 167- 172. DOI: 10.3877/cma.j.issn.2095-7157.2023.03.005. [2] BOSCH J, GARCÍA-PAGÁN JC. Prevention of variceal rebleeding[J]. Lancet, 2003, 361( 9361): 952- 954. DOI: 10.1016/S0140-6736(03)12778-X. [3] LO GH. The role of endoscopy in secondary prophylaxis of esophageal varices[J]. Clin Liver Dis, 2010, 14( 2): 307- 323. DOI: 10.1016/j.cld.2010.03.009. [4] FLEMMING JA, SAXENA V, SHEN H, et al. Facility- and patient-level factors associated with esophageal variceal screening in the USA[J]. Dig Dis Sci, 2016, 61( 1): 62- 69. DOI: 10.1007/s10620-015-3865-8. [5] MAYORGA CA, ROCKEY DC. Clinical utility of a standardized electronic order set for the management of acute upper gastrointestinal hemorrhage in patients with cirrhosis[J]. Clin Gastroenterol Hepatol, 2013, 11( 10): 1342- 1348. DOI: 10.1016/j.cgh.2013.04.021. [6] SIMÓN-TALERO M, ROCCARINA D, MARTÍNEZ J, et al. Association between portosystemic shunts and increased complications and mortality in patients with cirrhosis[J]. Gastroenterology, 2018, 154( 6): 1694- 1705.e4. DOI: 10.1053/j.gastro.2018.01.028. [7] SARIN SK, LAHOTI D, SAXENA SP, et al. Prevalence, classification and natural history of gastric varices: A long-term follow-up study in 568 portal hypertension patients[J]. Hepatology, 1992, 16( 6): 1343- 1349. DOI: 10.1002/hep.1840160607. [8] WANI ZA, BHAT RA, BHADORIA AS, et al. Gastric varices: Classification, endoscopic and ultrasonographic management[J]. J Res Med Sci, 2015, 20( 12): 1200- 1207. DOI: 10.4103/1735-1995.172990. [9] KIM T, SHIJO H, KOKAWA H, et al. Risk factors for hemorrhage from gastric fundal varices[J]. Hepatology, 1997, 25( 2): 307- 312. DOI: 10.1053/jhep.1997.v25.pm0009021939. [10] THAKEB F, SALEM SA, ABDALLAH M, et al. Endoscopic diagnosis of gastric varices[J]. Endoscopy, 1994, 26( 3): 287- 291. DOI: 10.1055/s-2007-1008969. [11] TRIPATHI D, FERGUSON JW, THERAPONDOS G, et al. Review article: Recent advances in the management of bleeding gastric varices[J]. Aliment Pharmacol Ther, 2006, 24( 1): 1- 17. DOI: 10.1111/j.1365-2036.2006.02965.x. [12] de FRANCHIS R, BOSCH J, GARCIA-TSAO G, et al. Baveno VII-Renewing consensus in portal hypertension[J]. J Hepatol, 2022, 76( 4): 959- 974. DOI: 10.1016/j.jhep.2021.12.022. [13] MA JL, HE LL, JIANG Y, et al. Splenic infarction and repeated abdominal infection after endoscopic therapy for esophagogastric varices[J]. J Clin Hepatol, 2022, 38( 9): 2113- 2115. DOI: 10.3969/j.issn.1001-5256.2022.09.030.马佳丽, 何玲玲, 蒋煜, 等. 内镜治疗食管胃底静脉曲张并发脾梗死及反复腹腔感染1例报告[J]. 临床肝胆病杂志, 2022, 38( 9): 2113- 2115. DOI: 10.3969/j.issn.1001-5256.2022.09.030. [14] UPADHYAY AP, ANANTHASIVAN R, RADHAKRISHNAN S, et al. Cortical blindness and acute myocardial infarction following injection of bleeding gastric varices with cyanoacrylate glue[J]. Endoscopy, 2005, 37( 10): 1034. DOI: 10.1055/s-2005-870211. [15] KOK K, BOND RP, DUNCAN IC, et al. Distal embolization and local vessel wall ulceration after gastric variceal obliteration with N-butyl-2-cyanoacrylate: A case report and review of the literature[J]. Endoscopy, 2004, 36( 5): 442- 446. DOI: 10.1055/s-2004-814323. [16] MA JL, CHEN X, HONG S, et al. Metal clips combined with endoscopic histoacryl injection in the treatment of gastric varices with spontaneous portosystemic shunts(with video)[J]. Chin J Dis Endosc, 2020, 37( 2): 35- 38. DOI: 10.3760/cma.j.issn.1007-5232.2020.02.007.马佳丽, 陈旭, 洪珊, 等. 金属夹联合组织胶注射治疗合并自发性门体分流的胃静脉曲张的临床研究(含视频)[J]. 中华消化内镜杂志, 2020, 37( 2): 35- 38. DOI: 10.3760/cma.j.issn.1007-5232.2020.02.007. [17] ZHANG MY, LI P, MOU HJ, et al. Clip-assisted endoscopic cyanoacrylate injection for gastric varices with a gastrorenal shunt: A multicenter study[J]. Endoscopy, 2019, 51( 10): 936- 940. DOI: 10.1055/a-0977-3022. [18] LI HX, YE D, LI P, et al. Endoscopic clipping prior to GVO vs. GVO in IGV1 bleeding: A multicenter retrospective clinical trial[J]. Endosc Int Open, 2019, 7( 11): E1365- E1370. DOI: 10.1055/a-0902-4384. [19] PHILIPS CA, RAJESH S, AUGUSTINE P, et al. Portosystemic shunts and refractory hepatic encephalopathy: Patient selection and current options[J]. Hepat Med, 2019, 11: 23- 34. DOI: 10.2147/HMER.S169024. [20] KHERA PS, MYUNGSU L, JOONSUNG C. Balloon occluded retrograde transvenous obliteration for bleeding gastric varices: Eyes see what the mind knows[J]. Indian J Radiol Imaging, 2017, 27( 1): 100- 104. DOI: 10.4103/0971-3026.202952. [21] SOMBERG KA. TIPS: Safe, effective, better?[J]. Am J Gastroenterol, 1997, 92( 9): 1412- 1416. [22] RIGGIO O, NARDELLI S, MOSCUCCI F, et al. Hepatic encephalopathy after transjugular intrahepatic portosystemic shunt[J]. Clin Liver Dis, 2012, 16( 1): 133- 146. DOI: 10.1016/j.cld.2011.12.008. [23] SOMBERG KA, RIEGLER JL, LABERGE JM, et al. Hepatic encephalopathy after transjugular intrahepatic portosystemic shunts: Incidence and risk factors[J]. Am J Gastroenterol, 1995, 90( 4): 549- 555. [24] ZHANG H, XIAO JQ, TU JJ, et al. Prevention of variceal rebleeding in cirrhotic patients with spontaneous portosystemic shunts: Transjugular intrahepatic portosystemic shunt versus endoscopic treatment[J]. Eur J Gastroenterol Hepatol, 2021, 33( 5): 752- 761. DOI: 10.1097/MEG.0000000000002079. [25] HUANG ZY, ZHANG WH, LV FJ, et al. Efficacy and safety of EUS-guided coil embolization combined with endoscopic cyanoacrylate injection versus balloon-occluded retrograde transvenous obliteration for gastric varices with high-risk ectopic embolism: A multicenter and retrospective cohort study[J]. Endosc Ultrasound, 2023, 12( 1): 74- 83. DOI: 10.4103/EUS-D-21-00260. [26] SAAD WE, SIMON PO, ROSE SC. Balloon-occluded retrograde transvenous obliteration of gastric varices[J]. CardioVascular Interv Radiol, 2014, 37( 2): 299- 315. DOI: 10.1007/s00270-013-0715-y. [27] The Chinese College of Interventionalists. CCI clinical practice guidelines: Management of TIPS for portal hypertension(2019 edition)[J]. J Clin Hepatol, 2019, 35( 12): 2694- 2699. DOI: 10.3969/j.issn.1001-5256.2019.12.010.中国医师协会介入医师协会. 中国门静脉高压经颈静脉肝内门体分流术临床实践指南(2019年版)[J]. 临床肝胆病杂志, 2019, 35( 12): 2694- 2699. DOI: 10.3969/j.issn.1001-5256.2019.12.010. [28] HUANG X, JIANG ZY, JIA QH. Comparison on the effect and safety of endoscopic ligation combined with tissue Sol“sandwich” injection and lauromacrogol injection in the treatment of EVB[J]. J Clin Exp Med, 2023, 22( 22): 2387- 2391. DOI: 10.3969/j.issn.1671-4695.2023.22.010.黄学, 姜志勇, 贾秋红. 内镜套扎术分别联合组织溶胶“三明治”注射及聚桂醇注射治疗EVB的效果及安全性对比[J]. 临床和实验医学杂志, 2023, 22( 22): 2387- 2391. DOI: 10.3969/j.issn.1671-4695.2023.22.010. [29] BARAKAT MT, FOLEY MA, GUGIG R. Initial experience with endoscopic ultrasound-guided coil placement for pediatric gastric variceal hemostasis[J]. J Pediatr Gastroenterol Nutr, 2021, 72( 4): 532- 537. DOI: 10.1097/MPG.0000000000003028. -



 PDF下载 ( 1036 KB)
PDF下载 ( 1036 KB)

 下载:
下载: