原发性胆汁性胆管炎-自身免疫性肝炎重叠综合征合并肺隐球菌病1例报告
DOI: 10.12449/JCH240825
Primary biliary cholangitis-autoimmune hepatitis overlap syndrome comorbid with pulmonary cryptococcosis: A case report
-
摘要: 自身免疫性肝病重叠综合征表现为患者出现一种以上的自身免疫性肝病的生化、免疫、组织学或胆管造影特征,常需联合使用免疫抑制剂治疗。肺隐球菌病是一种由新型隐球菌或格特隐球菌引起的侵袭性肺真菌病,易在免疫功能低下患者中发生。本病例为1例重叠综合征,在免疫抑制治疗过程中发现并治疗肺隐球菌病,在抗真菌治疗过程中肝功能出现异常,根据患者的肝功能情况,评估了更换抗真菌药物的可行性,综合考虑后制定了在密切监测肝功能的情况下,积极治疗新型隐球菌感染的治疗策略,避免了感染的进展。提示在启动免疫抑制治疗前,除了全面评估全身感染灶,对于可疑感染灶也必须保持监测。Abstract: Patients with overlap syndrome (OS) of autoimmune liver disease may present with more than one biochemical, immunological, histological or cholangiography features of autoimmune liver disease (AILD) and often require a combination of immunosuppressants for treatment. Pulmonary cryptococcosis is a type of invasive pneumomycosis caused by Cryptococcus neoformans or Cryptococcus gattii and has a relatively high incidence rate in immunocompromised patients. This case report presents a patient with OS who was found to have pulmonary cryptococcosis during immunosuppressive therapy and developed abnormal liver function during antifungal treatment. Based on the liver function of the patient, the feasibility of adjusting antifungal agents was assessed, and active treatment strategies for novel cryptococcal infection were developed under the close monitoring of liver function, which helped to avoid the progression of infection. It is suggested that before the initiation of immunosuppressive therapy, systemic foci of infection should be comprehensively evaluated, and suspicious foci of infection should be monitored continuously.
-
1. 病例资料
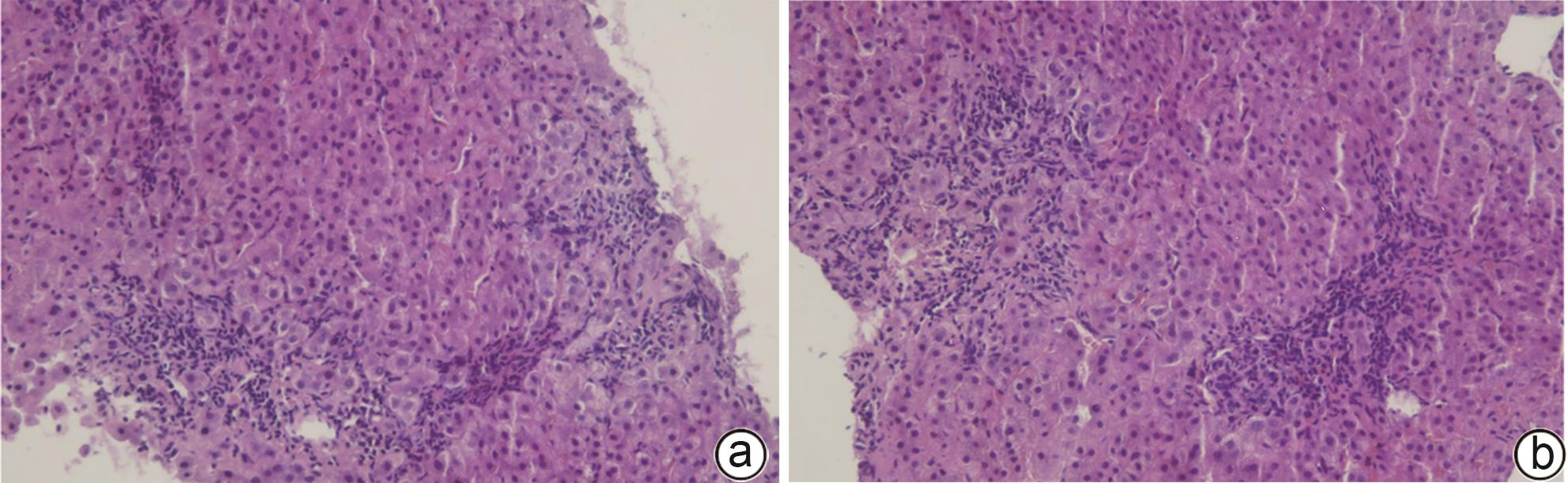
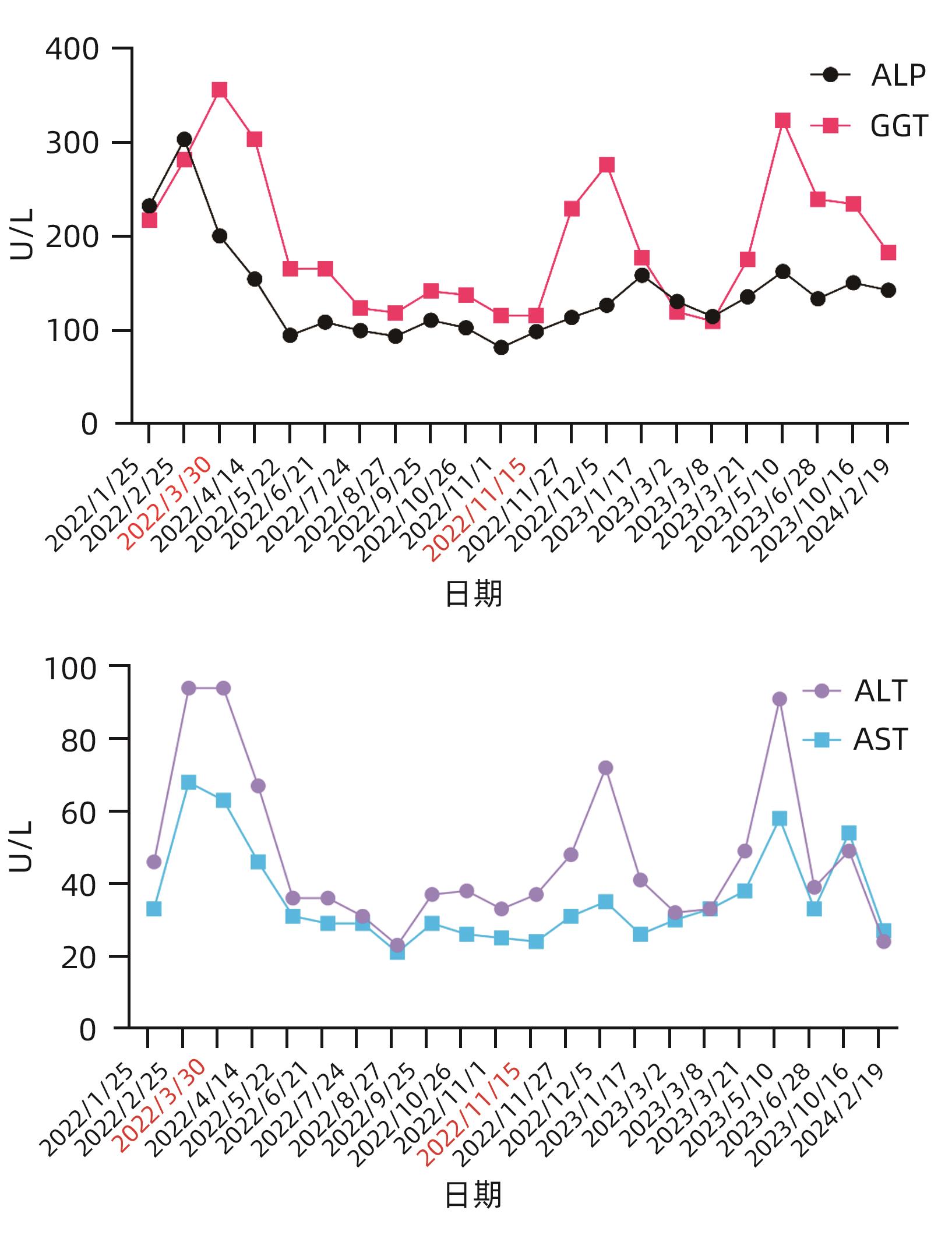
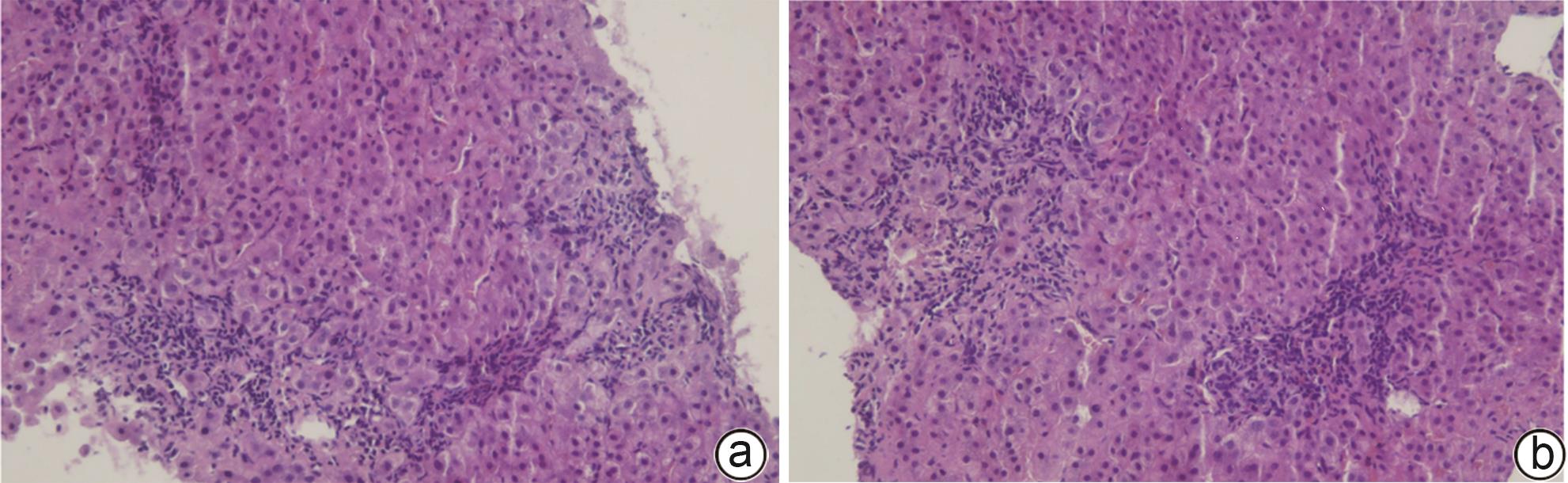
患者男性,55岁,2015年于当地医院体检首次发现肝功能异常,伴有眼干症状。患者未表现口干、牙齿脱落、厌油纳差、恶心呕吐、腹胀腹痛、腹泻、黑便、皮肤黏膜黄染等症状,当时未接受治疗。2017年因肝功能异常于当地医院住院治疗。抗核抗体检测显示1∶320胞浆型(+++),抗SSA抗体为阳性。初步怀疑为自身免疫性肝病(autoimmune liver disease,AILD),进行了保肝和糖皮质激素治疗,转氨酶有所下降。患者出院后自行服用中药治疗,但肝功能反复异常。2022年1月于本院肝炎门诊就诊,完善相关检查。病毒血清学检查:HAV、HBV、HCV、EBV及CMV标志物均阴性,ALT 46 U/L,AST 33 U/L,ALP 233 U/L,GGT 218 U/L。自身抗体:抗Ro-52抗体(++),抗核抗体1∶1 000,余AILD相关抗体均为阴性,IgG 20.40 g/L,患者存在胆汁淤积生化指标异常,怀疑原发性胆汁性胆管炎(PBC),但是AILD特异性抗体阴性,考虑存在重叠可能,建议进行肝活检以确认诊断。患者于2022年1月25日行肝穿刺活检,病理提示(图1):肝脏轻度慢性炎(G2S2),并见界面性炎,淋巴及浆细胞浸润,肝细胞花环样结构、胆管改变,疑为PBC,合并自身免疫性肝炎(AIH)组织学表现。2022年2月患者于本院门诊多学科会诊,再次复查ALT 94 U/L,AST 68 U/L,ALP 304 U/L,GGT 282 U/L,结合IgG及病理学改变,诊断为PBC-AIH重叠综合征。建议采用“优思弗500 mg 每日2次+美卓乐20 mg每日1次+硫唑嘌呤50 mg 每日1次”治疗。治疗6个月后逐渐调整药物剂量为“优思弗500 mg每日2次+美卓乐12 mg每日1次+硫唑嘌呤50 mg每日1次”治疗。启动免疫抑制治疗后,患者ALT、AST、ALP水平逐渐降至正常,尽管GGT仍高于正常值,但也维持在150 U/L以下(图2)。
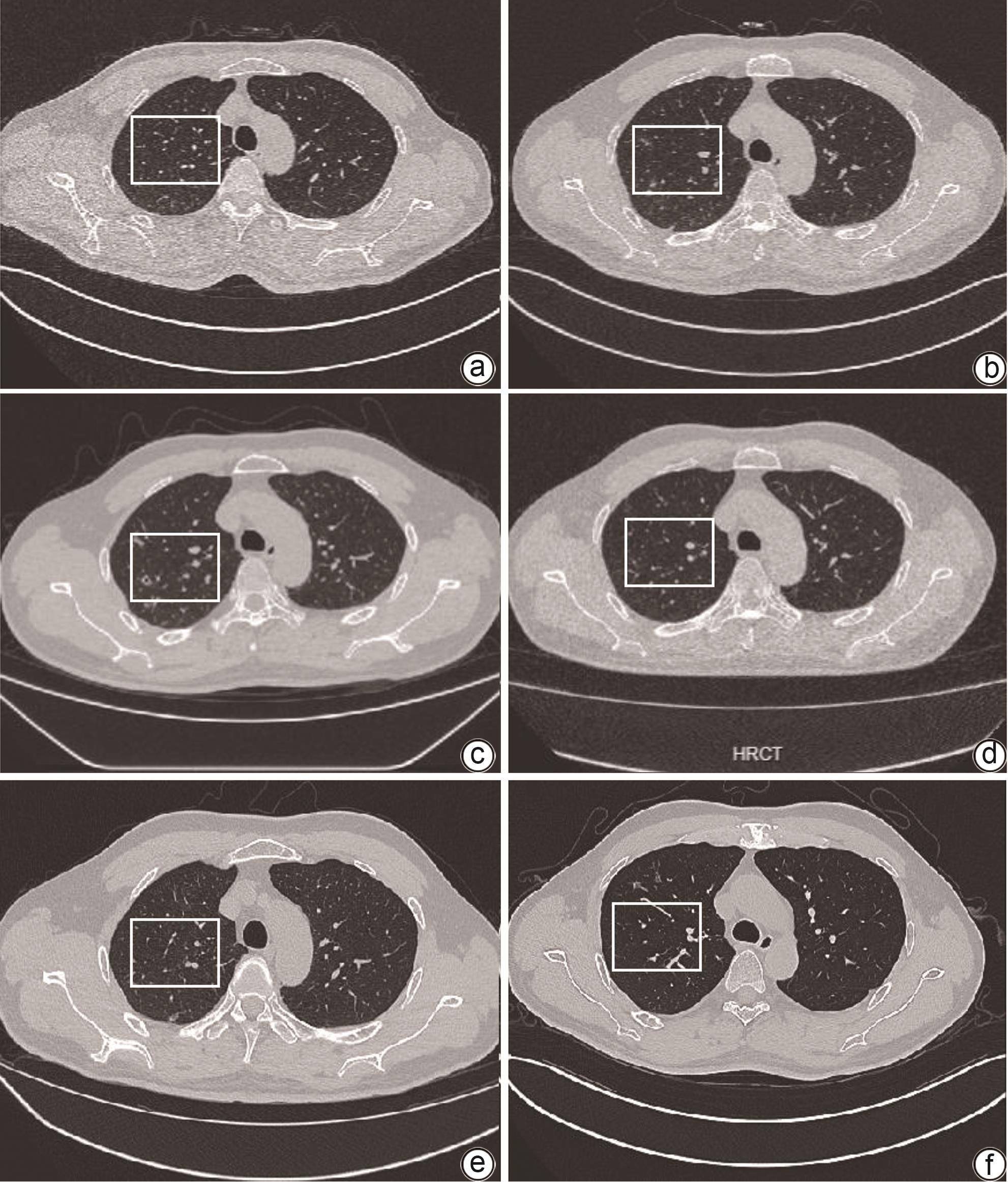
2021年,患者在启动免疫抑制治疗前体检时发现双肺结节,主要分布在右上肺且未进行治疗。2022年2月启动免疫治疗时,全身感染灶筛查中胸部CT显示双肺散在小结节(图3a)。补充血常规、C反应蛋白(CRP)、降钙素原(PCT)及真菌G试验等检测,结果均未显示感染迹象。在密切监测胸部CT的基础上,启动了免疫抑制治疗。2022年10月(免疫抑制治疗启动后8个月)复查发现结节有进展,胸部CT显示双肺多发病灶(图3b),进一步完善检查:G试验、GM试验、γ-干扰素释放试验均为阴性,新生/格特隐球菌荚膜抗原阳性,隐球菌抗原滴度检测阳性(1∶320)。脑脊液未检测到隐球菌,肺泡灌洗液宏基因组测序显示新生隐球菌,患者年轻时曾有短暂“养鸽子”史。综合上述检查结果,考虑肺隐球菌病(pulmonary cryptococcosis,PC),采用伏立康唑200 mg/d抗感染,同时将美卓乐用量调整为8 mg每日1次。治疗过程中,GGT升高至277 U/L,患者自述外院复查胸部CT,病灶无好转,且有偶发咳嗽症状。鉴于伏立康唑效果不佳,且继续使用抗真菌药物存在肝损伤风险,因此决定入院密切观察治疗。于2023年3月1日停用伏立康唑后入院治疗。复查胸部CT显示病灶进展,呈现双肺散在斑片、结节影(图3c)。诊断为PC、PBC-AIH重叠综合征。患者入院期间再次完善肺泡灌洗,未发现结核、肿瘤及其他相关证据。肺泡灌洗液隐球菌培养呈阳性,且为伏立康唑、氟康唑野生型菌株(表1)。随后启动氟康唑400 mg治疗,辅以天晴甘平150 mg每日3次保肝治疗,并于出院后进行随访。在用药期间持续监测患者肝功能变化情况(图2)。患者抗隐球菌感染治疗后复查胸部CT显示双肺病灶明显减小(图3d~f)。
表 1 药敏检测报告Table 1. Drug sensitivity test report抗生素 结果 敏感度 方法 折点 5-氟胞嘧啶 2 WT MIC ≤8 伏立康唑 0.06 WT MIC ≤0.25 卡泊芬净 ≥16 耐药 MIC 米卡芬净 ≥16 耐药 MIC 阿尼芬净 ≥16 耐药 MIC 伊曲康唑 0.12 WT MIC ≤0.25 两性霉素B 0.5 WT MIC ≤0.25 氟康唑 4 WT MIC ≤8 泊沙康唑 0.12 WT MIC ≤0.25 注:患者肺泡灌洗液培养结果为新生隐球菌,为5-氟胞嘧啶、伏立康唑、伊曲康唑、两性霉素B、氟康唑、泊沙康唑野生型菌株。WT,野生型;MIC,最小抑菌浓度。
2. 讨论
AIH、PBC、原发性硬化性胆管炎、免疫球蛋白G4相关硬化性胆管炎都是由自身免疫反应所介导的以肝损伤为特征的AILD。表现出两种不同AILD特征的情况通常被称为重叠综合征[1],以PBC-AIH重叠综合征最为常见。与单纯PBC患者相比,PBC-AIH重叠综合征患者疾病进展较快,发生肝硬化、门静脉高压、胃食管静脉曲张、腹水、消化道出血、肝移植及死亡的风险都显著升高[2]。干燥综合征是PBC-AIH重叠综合征患者最常见的肝外自身免疫性疾病,患者合并干燥综合征并不增加终末期肝病并发症风险[3-5]。
目前国际上PBC-AIH重叠综合征最常用的诊断标准是巴黎标准,要求符合PBC和AIH三项诊断标准中的各两项(同时或者相继出现),即可做出诊断;其中诊断AIH肝组织学改变是必需条件[6-8]。本病例有以下特点:(1)中年男性,慢性起病,反复肝功能异常为主要表现;(2)起病隐匿,无特殊症状;(3)ALP、GGT水平升高,ANA阳性,免疫球蛋白升高;(4)AILD特异性抗体阴性,但具有特异的肝组织学改变,即①淋巴-浆细胞浸润;②界面性肝炎;③汇管区胆管损伤;④玫瑰花样改变。结合上述病理特点,按照新的诊断标准,该患者可确诊为PBC-AIH重叠综合征。
PBC-AIH重叠综合征的治疗要兼顾PBC和AIH两种疾病:PBC患者应用熊去氧胆酸(UDCA)是一线疗法(每天13~15 mg/kg),并需终身服用[7]。AIH目前主要采用非特异性免疫抑制:对于初治的AIH成人患者,建议将泼尼松(龙)联合硫唑嘌呤作为标准治疗方案,即泼尼松(龙)用于诱导缓解,硫唑嘌呤用于维持缓解[9]。UDCA、免疫抑制或两者结合已被用作AILD重叠综合征的一线治疗[10]。患者启动UDCA、泼尼松及硫唑嘌呤联合治疗后,ALT、AST、ALP水平逐渐降至正常,GGT虽仍高于正常值,但也维持在150 U/L以下。
PC是一种由新型隐球菌或格特隐球菌引起的侵袭性肺真菌病。吸入感染是最主要的感染途径,在免疫功能低下患者中感染概率大于免疫正常者,例如有慢性基础疾病、免疫缺陷的患者及经常应用糖皮质激素、免疫抑制剂的患者,在这些患者中通常感染的后果也会更严重[11-12]。PC患者往往没有特异性的临床表现[13-14]。但严重PC患者可能会发生急性呼吸衰竭[15]。PC诊断的主要依据是影像学改变、组织病理学、隐球菌培养和隐球菌抗原检测[16]。对于免疫功能低下的轻症PC患者,推荐每日口服氟康唑400 mg作为一线治疗[17]。对于不能耐受氟康唑的患者,可考虑使用伏立康唑作为二线治疗。本病例患者应用免疫抑制治疗后出现肺部结节进展,且肺泡灌洗液新型隐球菌培养阳性,感染明确,尚未累及中枢神经系统。在本病例中,患者为PBC-AIH重叠综合征,需要综合考虑两种疾病的治疗方案和患者的肝功能情况。由于初次使用伏立康唑效果较差且肝功能受损,考虑换用氟康唑治疗,并在治疗过程中加强保肝治疗,持续监测肝功能。鉴于患者多重基础疾病、免疫抑制状态,推迟抗真菌治疗可能导致不良后果,如PC严重进展或隐球菌脑膜炎。因此,决定入院进行持续治疗,更换为口服氟康唑400 mg,同时进行保肝治疗,并在治疗过程中定期监测肝功能。
患者在启动免疫治疗时,完善了胸部CT且发现肺部结节,但无相关症状,完善了相关真菌试验均为阴性,无法确认有感染灶存在。考虑到机会性感染可能会在免疫抑制治疗中发生,所以在治疗过程中保持监测肺部结节,发现进展后,完善肺泡灌洗液病原学检查和隐球菌抗原检测,明确了PC的诊断,并及时在监测肝功能的同时进行了抗隐球菌治疗。以上提示:有肺部结节但无症状且未能排查出感染存在时,若患者需免疫抑制治疗需注意定期监测肺部结节进展,以免感染的发生和进展,导致严重后果;此外,若患者有肝功能异常情况,抗隐球菌治疗时需注意加强监测肝功能。
重叠综合征的诊断需综合生物化学、免疫学、影像学,特别是组织学检查结果。有肝脏基础疾病的患者感染新型隐球菌后,启动抗真菌治疗时需平衡治疗的有效性和患者的肝功能耐受能力。同时,在启动免疫抑制治疗前,全面评估全身感染灶需格外仔细,在排查出可疑感染灶时要考虑多种可能性,如新型隐球菌等,在治疗过程中也要严格监测,及时发现感染发生。
-
表 1 药敏检测报告
Table 1. Drug sensitivity test report
抗生素 结果 敏感度 方法 折点 5-氟胞嘧啶 2 WT MIC ≤8 伏立康唑 0.06 WT MIC ≤0.25 卡泊芬净 ≥16 耐药 MIC 米卡芬净 ≥16 耐药 MIC 阿尼芬净 ≥16 耐药 MIC 伊曲康唑 0.12 WT MIC ≤0.25 两性霉素B 0.5 WT MIC ≤0.25 氟康唑 4 WT MIC ≤8 泊沙康唑 0.12 WT MIC ≤0.25 注:患者肺泡灌洗液培养结果为新生隐球菌,为5-氟胞嘧啶、伏立康唑、伊曲康唑、两性霉素B、氟康唑、泊沙康唑野生型菌株。WT,野生型;MIC,最小抑菌浓度。
-
[1] CZAJA AJ, CARPENTER HA. Autoimmune hepatitis overlap syndromes and liver pathology[J]. Gastroenterol Clin North Am, 2017, 46( 2): 345- 364. DOI: 10.1016/j.gtc.2017.01.008. [2] SILVEIRA MG, TALWALKAR JA, ANGULO P, et al. Overlap of autoimmune hepatitis and primary biliary cirrhosis: long-term outcomes[J]. Am J Gastroenterol, 2007, 102( 6): 1244- 1250. DOI: 10.1111/j.1572-0241.2007.01136.x. [3] JIANG Y, XU BH, RODGERS B, et al. Characteristics and inpatient outcomes of primary biliary cholangitis and autoimmune hepatitis overlap syndrome[J]. J Clin Transl Hepatol, 2021, 9( 3): 392- 398. DOI: 10.14218/JCTH.2021.00008. [4] CHALIFOUX SL, KONYN PG, CHOI G, et al. Extrahepatic manifestations of primary biliary cholangitis[J]. Gut Liver, 2017, 11( 6): 771- 780. DOI: 10.5009/gnl16365. [5] GRAVERSGAARD C, SALMON JE, SCHREIBER K. First prospective observational data on pregnancies in patients with primary Sjögren’s syndrome[J]. Lancet Rheumatol, 2023, 5( 6): e306- e307. DOI: 10.1016/S2665-9913(23)00123-6. [6] CHAZOUILLÈRES O, WENDUM D, SERFATY L, et al. Primary biliary cirrhosis-autoimmune hepatitis overlap syndrome: clinical features and response to therapy[J]. Hepatology, 1998, 28( 2): 296- 301. DOI: 10.1002/hep.510280203. [7] Chinese Society of Hepatology, Chinese Medical Association. Guidelines on the diagnosis and management of primary biliary cholangitis(2021)[J]. J Clin Hepatol, 2022, 38( 1): 35- 41.中华医学会肝病学分会. 原发性胆汁性胆管炎的诊断和治疗指南(2021)[J]. 临床肝胆病杂志, 2022, 38( 1): 35- 41. [8] MA L, GAO LL. Diagnosis and treatment of patients with primary biliary cholangitis-autoimmune hepatitis overlap syndrome[J]. J Prac Hepatol, 2023, 26( 2): 301- 304. DOI: 10.3969/j.issn.1672-5069.2023.02.038.马莉, 高丽丽. 原发性胆汁性胆管炎-自身免疫性肝炎重叠综合征诊治进展[J]. 实用肝脏病杂志, 2023, 26( 2): 301- 304. DOI: 10.3969/j.issn.1672-5069.2023.02.038. [9] Chinese Society of Hepatology, Chinese Medical Association. Guidelines on the diagnosis and management of autoimmune hepatitis(2021)[J]. J Clin Hepatol, 2022, 38( 1): 42- 49.中华医学会肝病学分会. 自身免疫性肝炎诊断和治疗指南(2021)[J]. 临床肝胆病杂志, 2022, 38( 1): 42- 49. [10] FREEDMAN BL, DANFORD CJ, PATWARDHAN V, et al. Treatment of overlap syndromes in autoimmune liver disease: a systematic review and Meta-analysis[J]. J Clin Med, 2020, 9( 5): 1449. DOI: 10.3390/jcm9051449. [11] YI L, TAO YH, CHEN ZY, et al. Study on the clinical features and CT findings of pulmonary Cryptococcosis in immunocompetent patient[J]. J Clin Radiol, 2023, 42( 1): 51- 55.易黎, 陶雅红, 陈智勇, 等. 免疫功能正常者肺隐球菌病临床表现及CT特征分析[J]. 临床放射学杂志, 2023, 42( 1): 51- 55. [12] KOHNO S, KAKEYA H, IZUMIKAWA K, et al. Clinical features of pulmonary cryptococcosis in non-HIV patients in Japan[J]. J Infect Chemother, 2015, 21( 1): 23- 30. DOI: 10.1016/j.jiac.2014.08.025. [13] SONG KD, LEE KS, CHUNG MP, et al. Pulmonary cryptococcosis: imaging findings in 23 non-AIDS patients[J]. Korean J Radiol, 2010, 11( 4): 407- 416. DOI: 10.3348/kjr.2010.11.4.407. [14] MA LL, RAO HL, TANG F, et al. Analysis of CT imaging features and clinical pathological features in patients with pulmonary cryptococcosis[J]. Clin J Med Offic, 2022, 50( 12): 1310- 1312, 1316. DOI: 10.16680/j.1671-3826.2022.12.30.马利利, 饶会林, 唐飞, 等. 肺隐球菌病患者肺部CT影像学表现及临床病理特征分析[J]. 临床军医杂志, 2022, 50( 12): 1310- 1312, 1316. DOI: 10.16680/j.1671-3826.2022.12.30. [15] VISNEGARWALA F, GRAVISS EA, LACKE CE, et al. Acute respiratory failure associated with cryptococcosis in patients with AIDS: analysis of predictive factors[J]. Clin Infect Dis, 1998, 27( 5): 1231- 1237. DOI: 10.1086/514984. [16] CHAI CY, WANG T. Clinical analysis of pulmonary cryptococcus infection in the elderly and literature review[J]. Clin Misdiagn Misther, 2023, 36( 2): 1- 4, 10. DOI: 10.3969/j.issn.1002-3429.2023.02.001.柴春艳, 王婷. 老年肺隐球菌感染临床分析并文献复习[J]. 临床误诊误治, 2023, 36( 2): 1- 4, 10. DOI: 10.3969/j.issn.1002-3429.2023.02.001. [17] HOWARD-JONES AR, SPARKS R, PHAM D, et al. Pulmonary cryptococcosis[J]. J Fungi(Basel), 2022, 8( 11): 1156. DOI: 10.3390/jof8111156. 期刊类型引用(0)
其他类型引用(8)
-




 PDF下载 ( 1960 KB)
PDF下载 ( 1960 KB)


 下载:
下载:


 下载:
下载: