Lancet|KEYNOTE-966 Ⅲ期临床研究:晚期胆道恶性肿瘤治疗——帕博利珠单抗联合吉西他滨+顺铂vs单用吉西他滨+顺铂
DOI: 10.3969/j.issn.1001-5256.2023.11.033
-
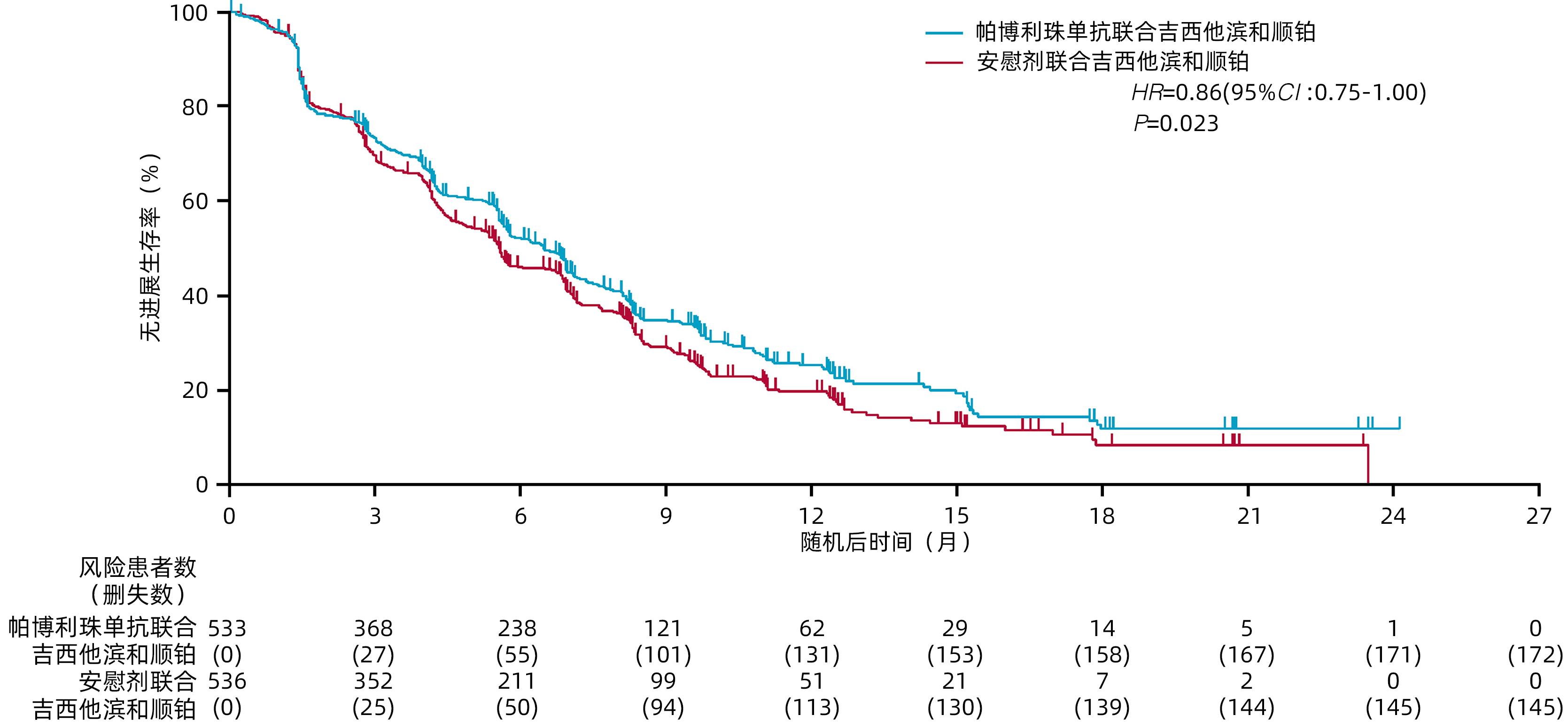
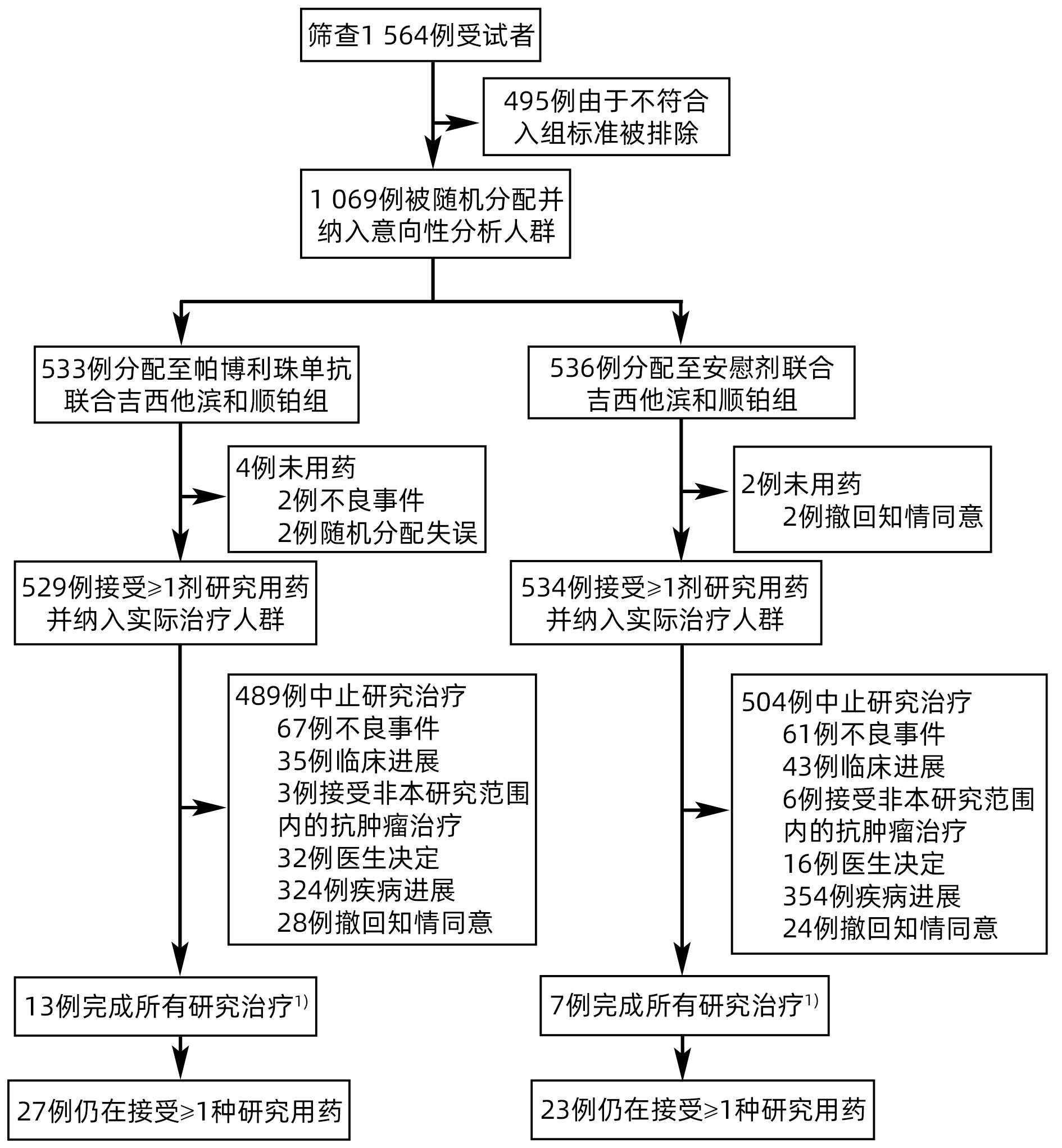
摘要: KEYNOTE-966研究旨在评估免疫检查点抑制剂帕博利珠单抗联合化疗(吉西他滨+顺铂)方案较安慰剂联合化疗(吉西他滨+顺铂)对改善晚期胆道恶性肿瘤(BTC)患者临床结局是否存在差异。纳入患者按1∶1随机分配至帕博利珠单抗200 mg联合化疗组或安慰剂(生理盐水)联合化疗组,化疗方案为吉西他滨(无治疗时间限制)和顺铂(最多8个周期)。主要终点为意向性治疗人群总生存期(OS)。最终1 069例患者被随机分配至帕博利珠单抗联合化疗组(n=533)或安慰剂联合化疗组(n=536)。帕博利珠单抗联合化疗组和安慰剂联合化疗组的中位OS分别为12.7个月和10.9个月[HR=0.83,95%CI:0.72~0.95,单侧P=0.003 4(显著性阈值P=0.020 0)]。帕博利珠单抗联合化疗组和安慰剂联合化疗组分别有369例(70%)和367例(69%)患者发生了3~4级治疗相关不良事件。研究表明,帕博利珠单抗联合吉西他滨和顺铂可能成为初治转移性或不可切除的BTC患者的治疗新策略。
-
表 1 意向性治疗人群基线时的人口统计学资料和临床特征

注: 1)慢性HBV感染包括HBsAg阳性或HBV DNA≥20 IU/mL的患者。临床已控制的HBV感染包括HBcAb阳性、HBsAg阴性且HBV DNA<20 IU/mL的患者。2)慢性HCV感染包括HCV IgG抗体阳性和HCV RNA阳性的患者。既往HCV感染包括HCV IgG抗体阳性但未检测到HCV RNA的患者。 表 2 首次中期分析时意向性治疗人群的疗效反应总结

注:1)疾病稳定包括疾病稳定、非完全缓解或非进展性疾病、无疾病证据的患者。2)无法评估包括基线后基于影像学检查无法评估最佳总体反应的患者。3)未评估包括未行基线后影像学检查的患者。4)使用Kaplan-Meier方法估计。 表 3 最终分析时实际治疗人群中,各组患者中发生率≥15%的全因AE
项目 帕博利珠单抗联合化疗组(n=529) 安慰剂联合化疗组(n=534) 1~2级 3级 4级 5级 1~2级 3级 4级 5级 全因[例(%)] 73(14) 287(54) 133(25) 31(6) 83(16) 270(51) 130(24) 49(9) 中性粒细胞计数减少[例(%)] 73(14) 167(32) 90(17) 0 74(14) 171(32) 82(15) 0 贫血[例(%)] 171(32) 150(28) 2(<1) 0 159(30) 150(28) 4(1) 0 恶心[例(%)] 221(42) 12(2) 0 0 234(44) 12(2) 0 0 血小板计数降低[例(%)] 117(22) 64(12) 30(6) 0 105(20) 67(13) 40(7) 0 乏力[例(%)] 161(30) 25(5) 1(<1) 0 150(28) 22(4) 0 0 便秘[例(%)] 184(35) 2(<1) 0 0 187(35) 3(1) 0 0 食欲减退[例(%)] 137(26) 6(1) 1(<1) 0 140(26) 15(3) 0 0 白细胞计数减少[例(%)] 80(15) 57(11) 4(1) 0 80(15) 44(8) 3(1) 0 发热[例(%)] 127(24) 12(2) 0 0 99(19) 5(1) 0 0 呕吐[例(%)] 108(20) 14(3) 0 0 121(23) 7(1) 0 0 腹泻[例(%)] 92(17) 11(2) 0 0 87(16) 10(2) 0 1(<1) 腹痛[例(%)] 82(16) 10(2) 0 0 103(19) 19(4) 0 0 皮疹[例(%)] 87(16) 3(1) 0 0 47(9) 2(<1) 0 0 ALT升高[例(%)] 72(14) 16(3) 0 0 77(14) 19(4) 2(<1) 0 AST升高[例(%)] 75(14) 12(2) 0 0 99(19) 14(3) 0 0 低镁血症[例(%)] 74(14) 5(1) 0 0 73(14) 5(1) 1(<1) 0 瘙痒[例(%)] 77(15) 0 0 0 51(10) 0 0 0 虚弱[例(%)] 64(12) 10(2) 1(<1) 0 76(14) 19(4) 0 0 外周水肿[例(%)] 73(14) 0 0 0 78(15) 7(1) 0 0 -
[1] VALLE JW, KELLEY RK, NERVI B, et al. Biliary tract cancer[J]. Lancet, 2021, 397( 10272): 428- 444. DOI: 10.1016/s0140-6736(21)00153-7. [2] SUNG H, FERLAY J, SIEGEL RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71( 3): 209- 249. DOI: 10.3322/caac.21660. [3] CLEMENTS O, ELIAHOO J, KIM JU, et al. Risk factors for intrahepatic and extrahepatic cholangiocarcinoma: A systematic review and meta-analysis[J]. J Hepatol, 2020, 72( 1): 95- 103. DOI: 10.1016/j.jhep.2019.09.007. [4] JIANG Y, JIANG L, LI F, et al. The epidemiological trends of biliary tract cancers in the United States of America[J]. BMC Gastroenterol, 2022, 22( 1): 546. DOI: 10.1186/s12876-022-02637-8. [5] JOB S, RAPOUD D, DOS SANTOS A, et al. Identification of four immune subtypes characterized by distinct composition and functions of tumor microenvironment in intrahepatic cholangiocarcinoma[J]. Hepatology, 2020, 72( 3): 965- 981. DOI: 10.1002/hep.31092. [6] KIM RD, CHUNG V, ALESE OB, et al. A phase 2 multi-institutional study of nivolumab for patients with advanced refractory biliary tract cancer[J]. JAMA Oncol, 2020, 6( 6): 888- 894. DOI: 10.1001/jamaoncol.2020.0930. [7] PIHA-PAUL SA, OH DY, UENO M, et al. Efficacy and safety of pembrolizumab for the treatment of advanced biliary cancer: Results from the KEYNOTE-158 and KEYNOTE-028 studies[J]. Int J Cancer, 2020, 147( 8): 2190- 2198. DOI: 10.1002/ijc.33013. [8] DOKI Y, UENO M, HSU CH, et al. Tolerability and efficacy of durvalumab, either as monotherapy or in combination with tremelimumab, in patients from Asia with advanced biliary tract, esophageal, or head-and-neck cancer[J]. Cancer Med, 2022, 11( 13): 2550- 2560. DOI: 10.1002/cam4.4593. [9] ZITVOGEL L, GALLUZZI L, SMYTH MJ, et al. Mechanism of action of conventional and targeted anticancer therapies: reinstating immunosurveillance[J]. Immunity, 2013, 39( 1): 74- 88. DOI: 10.1016/j.immuni.2013.06.014. [10] DE BIASI AR, VILLENA-VARGAS J, ADUSUMILLI PS. Cisplatin-induced antitumor immunomodulation: a review of preclinical and clinical evidence[J]. Clin Cancer Res, 2014, 20( 21): 5384- 5391. DOI: 10.1158/1078-0432.Ccr-14-1298. [11] OH DY, RUTH HE A, QIN S, et al. Durvalumab plus Gemcitabine and cisplatin in advanced biliary tract cancer[J]. NEJM Evid, 2022, 1( 8): EVIDoa2200015. DOI: 10.1056/EVIDoa2200015. [12] TERRAULT NA, LOK ASF, MCMAHON BJ, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance[J]. Hepatology, 2018, 67( 4): 1560- 1599. DOI: 10.1002/hep.29800. [13] MORIZANE C, OKUSAKA T, MIZUSAWA J, et al. Combination gemcitabine plus S-1 versus gemcitabine plus cisplatin for advanced/recurrent biliary tract cancer: the FUGA-BT(JCOG1113) randomized phase III clinical trial[J]. Ann Oncol, 2019, 30( 12): 1950- 1958. DOI: 10.1093/annonc/mdz402. [14] VALLE JW, VOGEL A, DENLINGER CS, et al. Addition of ramucirumab or merestinib to standard first-line chemotherapy for locally advanced or metastatic biliary tract cancer: a randomised, double-blind, multicentre, phase 2 study[J]. Lancet Oncol, 2021, 22( 10): 1468- 1482. DOI: 10.1016/s1470-2045(21)00409-5. -


 PDF下载 ( 1427 KB)
PDF下载 ( 1427 KB)

 下载:
下载: