经肝动脉化疗栓塞术联合抗血管生成药基础上使用程序性死亡受体1抑制剂治疗中晚期肝细胞癌的有效性和安全性分析
DOI: 10.3969/j.issn.1001-5256.2022.05.021
Efficacy and safety of programmed death-1 inhibitor combined with transarterial chemoembolization and anti-angiogenic drugs in treatment of advanced hepatocellular carcinoma
-
摘要:
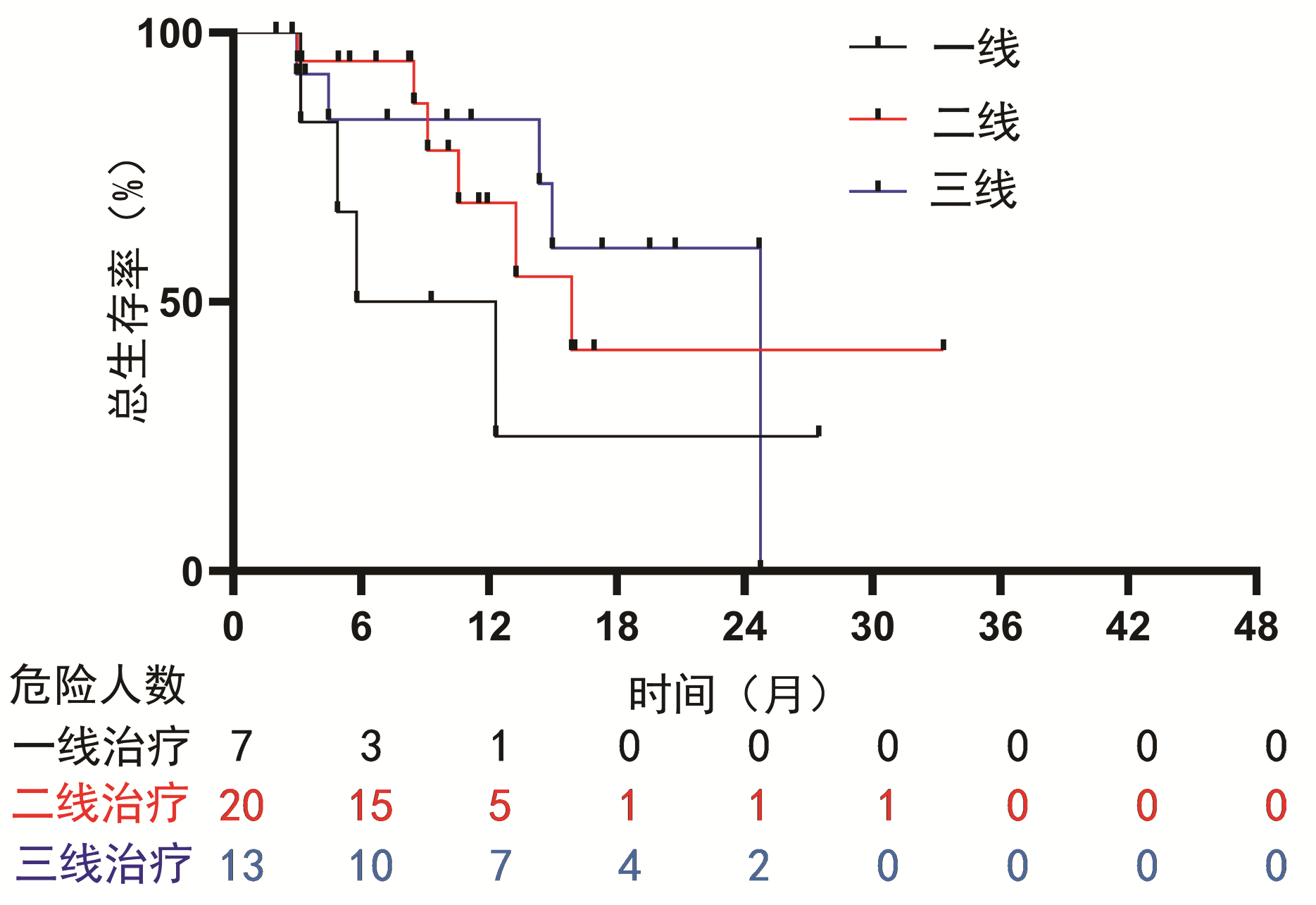
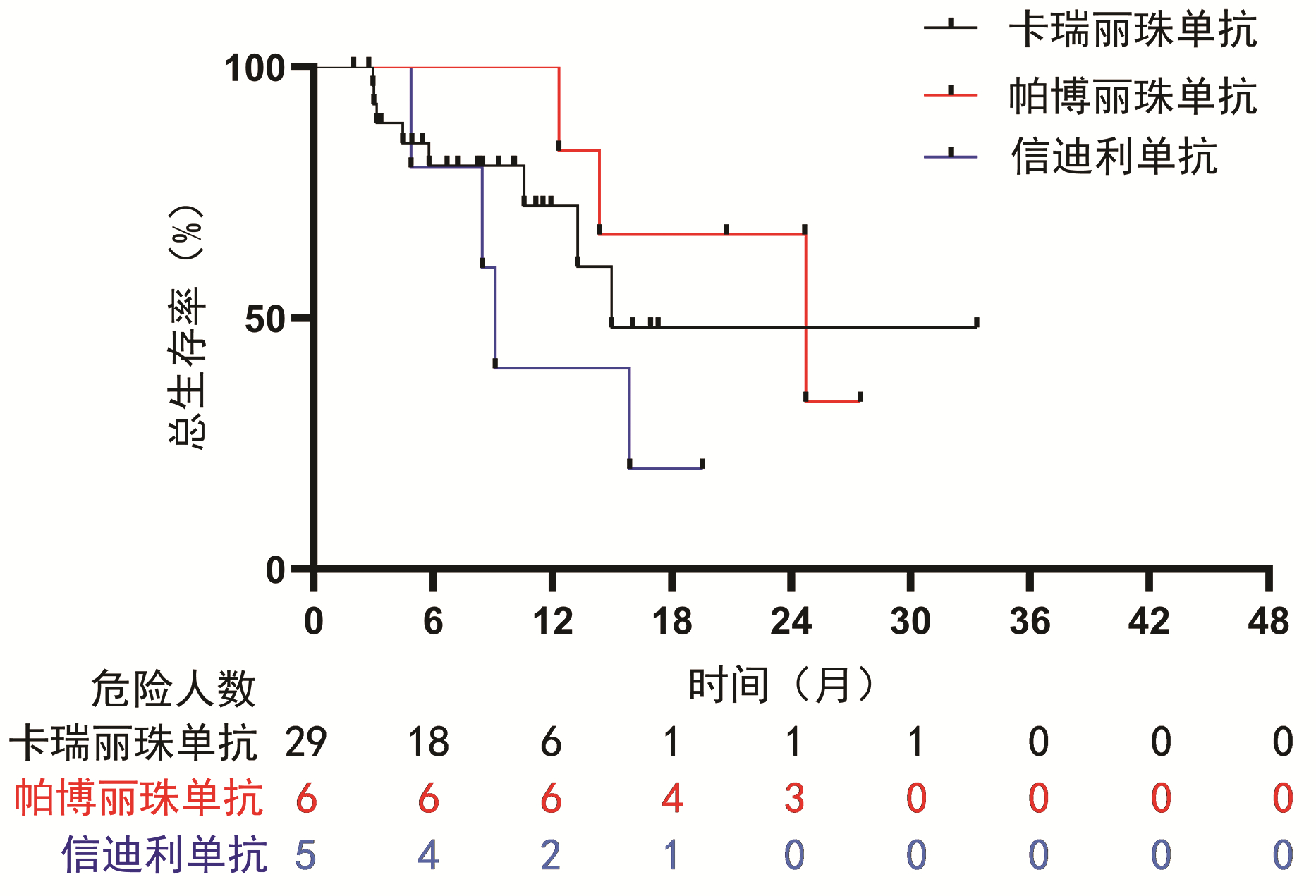
目的 探讨经肝动脉化疗栓塞术(TACE)联合抗血管生成药(TKI)的基础上后续使用程序性死亡受体1(PD-1)抑制剂与TACE+TKI两种方式治疗中晚期肝细胞癌(HCC)的有效性、安全性和预后影响因素。 方法 选取2018年6月—2021年7月在空军军医大学第一附属医院所有接受TACE+TKI+PD-1抑制剂和部分接受TACE+TKI治疗的患者。收集患者的临床资料,采用倾向性评分匹配法平衡组间基线特征。计数资料2组间比较采用χ2检验,TACE次数2组间比较采用Wilcoxon秩和检验,Kaplan-Meier法分析患者的总生存期,单因素和多因素Cox回归模型分析相关预后影响因素。 结果 共筛选到181例中晚期HCC患者,其中TACE+TKI+PD-1抑制剂治疗的患者为50例,倾向性评分匹配后,纳入40例TACE+TKI+PD-1抑制剂治疗患者(观察组)和40例TACE+TKI治疗患者(对照组)。至随访截止时间,中位随访时间为28.6个月(95%CI:22.1~35.1),观察组的中位生存期为15.9个月(95%CI:7.5~24.2),对照组中位生存期为11.2个月(95%CI:5.0~17.5)。Cox回归分析提示PD-1抑制剂的应用(HR=0.42,95%CI:0.23~0.80,P=0.008)、TACE次数(HR=0.67,95%CI:0.46~0.99,P=0.043)、Child-Pugh分级(HR=2.40,95%CI:1.15~5.00,P=0.019)和血管侵犯(HR=3.42,95%CI:1.11~9.42,P=0.031)是患者预后的独立影响因素。观察组与对照组的2级以上不良反应发生率均为40%,未见显著性差异(P=0.818)。 结论 TACE+TKI+PD-1抑制剂较TACE+TKI治疗中晚期HCC患者可以明显延长患者生存期,且不良反应相对可控。 -
关键词:
- 癌, 肝细胞 /
- 化学栓塞, 治疗性 /
- 程序性细胞死亡受体1 /
- 治疗结果
Abstract:Objective To investigate the efficacy and safety of programmed death receptor-1 (PD-1) inhibitor combined with transarterial chemoembolization (TACE) and anti-angiogenic drug tyrosine kinase inhibitor (TKI) versus TACE combined with TKI in the treatment of advanced hepatocellular carcinoma (HCC) and related influencing factors for prognosis. Methods An analysis was performed for all patients who received TACE+TKI+PD-1 inhibitor and some patients who received TACE+TKI in The First Affiliated Hospital of Air Force Medical University from June 2018 to July 2021. Related clinical data were collected, and propensity score matching (PSM) was used to balance the baseline characteristics between groups. The chi-square test was used for comparison of categorical data between two groups; the Wilcoxon rank-sum test was used for comparison of the number of TACE procedures between two groups; the Kaplan-Meier method was used to analyze overall survival (OS), and univariate and multivariate Cox regression models were used to analyze the influencing factors for prognosis. Results A total of 181 patients with advanced HCC were screened out, among whom 50 patients were treated with TACE+TKI+PD-1 inhibitor; after PSM, 40 patients treated with TACE+TKI+PD-1 inhibitor were enrolled as observation group and 40 patients treated with TACE+TKI were enrolled as control group. At the end of follow-up, the median follow-up time was 28.6 (95% confidence interval [CI]: 22.1-35.1) months, and the median OS was 15.9 (95%CI: 7.5-24.2) months in the observation group and 11.2 (95%CI: 5.0-17.5) months in the control group. The Cox regression analysis showed that the application of PD-1 inhibitor (hazard ratio [HR]=0.42, 95%CI: 0.23-0.80, P=0.008), the number of TACE procedures (HR=0.67, 95%CI: 0.46-0.99, P=0.043), Child-Pugh class (HR=2.40, 95%CI: 1.15-5.00, P=0.019), and vascular invasion (HR=3.42, 95%CI: 1.11-9.42, P=0.031) were independent influencing factors for prognosis. The incidence rate of grade > 2 adverse events was 40% for both the observation group and the control group, and there was no significant difference between the two groups (P=0.818). Conclusion Compared with TACE+TKI, TACE+TKI+PD-1 inhibitor can significantly prolong the OS of patients in advanced HCC, with relatively controllable adverse events. -
表 1 患者基线资料
Table 1. Baseline characteristics for the study patients
临床特征 PSM (1∶1匹配)前 PSM(1∶1匹配)后 总计
(n=139)对照组
(n=89)观察组
(n=50)P值 总计
(n=80)对照组
(n=40)观察组
(n=40)P值 男[例(%)] 112(80.6) 72(80.9) 40(80.0) 0.898 63(78.8) 31(77.5) 32(80.0) >0.05 年龄>60岁[例(%)] 46(33.1) 29(32.6) 17(34.0) 0.865 26(32.5) 13(32.5) 13(32.5) 1.000 病因[例(%)] 0.268 0.465 乙型肝炎 119(85.6) 78(87.6) 41(82.0) 69(86.2) 36(90.0) 33(82.5) 丙型肝炎 5(3.6) 4(4.5) 1(2.0) 1(1.2) 0 1(2.5) 其他 15(10.8) 7(7.9) 8(16.0) 10(12.5) 4(10.0) 6(15.0) 靶向药物类型[例(%)] 0.971 >0.05 索拉非尼或仑伐替尼 104(74.8) 66(74.2) 38(76.0) 59(73.8) 30(75.0) 29(72.5) 阿帕替尼或瑞戈非尼 35(25.2) 23(25.8) 12(24.0) 21(26.2) 10(25.0) 11(27.5) Child-Pugh评分[例(%)] 0.898 0.780 A级 112(80.6) 72(80.9) 40(80.0) 64(80.0) 31(77.5) 33(82.5) B级 27(19.4) 17(19.1) 10(20.0) 16(20.0) 9(22.5) 7(17.5) ECOG评分[例(%)] 0.949 0.789 0分 108(77.7) 69(77.5) 39(78.0) 62(77.5) 32(80.0) 30(75.0) 1分 31(22.3) 20(22.5) 11(22.0) 18(22.5) 8(20.0) 10(25.0) BCLC分期[例(%)] 0.961 >0.05 B期 58(41.7) 37(41.6) 21(42.0) 31(38.7) 15(37.5) 16(40.0) C期 81(58.3) 52(58.4) 29(58.0) 49(61.3) 25(62.5) 24(60.0) AFP[例(%)] 0.856 0.819 ≤400 ng/mL 57(41.0) 37(41.6) 20(40.0) 32(40.0) 15(37.5) 17(42.5) >400 ng/mL 82(59.0) 52(58.4) 30(60.0) 48(60.0) 25(62.5) 23(57.5) 腹水[例(%)] 0.767 >0.05 无 115(82.7) 73(82.0) 42(84.0) 65(81.2) 32(80.0) 33(82.5) 少量 24(17.3) 16(18.0) 8(16.0) 15(18.8) 8(20.0) 7(17.5) 肝外转移[例(%)] 0.236 0.823 无 76(54.7) 52(58.4) 24(48.0) 38(47.5) 20(50.0) 18(45.0) 有 63(45.3) 37(41.6) 26(52.0) 42(52.5) 20(50.0) 22(55.0) 血管侵犯[例(%)] 0.683 0.817 无 92(66.2) 60(67.4) 32(64.0) 50(62.5) 24(60.0) 26(65.0) 有 47(33.8) 29(32.6) 18(36.0) 30(37.5) 16(40.0) 14(35.0) Up-to-7标准[例(%)] 0.208 0.482 未超出 57(41.0) 40(44.9) 17(34.0) 28(35.0) 16(40.0) 12(30.0) 超出 82(59.0) 49(55.1) 33(66.0) 52(65.0) 24(60.0) 28(70.0) TACE次数 0.038 0.765 1次 78 55 23 42 20 22 2次 33 21 12 19 10 9 3次 14 6 8 11 7 4 ≥4次 14 7 7 8 3 5 表 2 单因素与多因素分析预后影响因素
Table 2. Univariate and multivariate analysis to explore prognostic factors
临床特征 单因素分析 多因素分析 HR(95%CI) P值 HR(95%CI) P值 应用PD-1抑制剂(ref: 未应用) 0.47(0.26~0.87) 0.017 0.42(0.23~0.80) 0.008 男(ref: 女) 1.21(0.59~2.50) 0.602 年龄>60岁(ref: ≤60岁) 1.27(0.69~2.32) 0.441 病因 乙型肝炎(ref: 其他) 3 007.25(0~2.64×1087) 0.935 丙型肝炎(ref: 其他) 3 060.73(0~2.68×1087) 0.935 索拉非尼和仑伐替尼(ref: 阿帕替尼和瑞戈非尼) 0.84(0.43~1.67) 0.636 Child-Pugh C级(ref: B级) 2.42(1.36~4.70) 0.008 2.40(1.15~5.00) 0.019 ECOG 1分(ref: 0分) 1.41(0.71~2.78) 0.323 BCLC C期(ref: B期) 2.07(1.09~3.91) 0.026 0.85(0.29~2.53) 0.769 AFP>400 ng/mL(ref: ≤400) 1.02(0.57~1.83) 0.952 腹水(ref: 无) 1.88(0.95~3.72) 0.069 肝外转移(ref: 无) 1.82(1.01~3.27) 0.045 0.73(0.21~2.53) 0.617 血管侵犯(ref: 无) 2.30(1.30~4.07) 0.004 3.24(1.11~9.42) 0.031 超过Up-to-7标准(ref: 否) 1.31(0.73~2.38) 0.368 TACE次数每增加1次 0.64(0.46~0.87) 0.005 0.67(0.46~0.99) 0.043 表 3 不良反应情况
Table 3. Adverse events
不良反应 观察组(n=40) 对照组(n=40) 所有级别 3级 4级 所有级别 3级 4级 乏力[例(%)] 23(57.5) 1(2.5) 0 24(60.0) 3(7.5) 0 腹泻[例(%)] 23(57.5) 2(5.0) 0 20(50.0) 2(5.0) 0 发热[例(%)] 14(35.0) 1(2.5) 0 11(27.5) 2(5.0) 0 高血压[例(%)] 13(32.5) 3(7.5) 0 17(42.5) 3(7.5) 0 手足皮肤反应[例(%)] 11(27.5) 4(10.0) 1(2.5) 15(37.5) 4(10.0) 1(2.5) 皮疹[例(%)] 3(7.5) 2(5.0) 0 3(7.5) 1(2.5) 0 甲状腺功能减退[例(%)] 3(7.5) 1(2.5) 0 1(2.5) 0 0 免疫性肺炎[例(%)] 1(2.5) 0 1(2.5) 0 0 0 -
[1] VILLANUEVA A. Hepatocellular carcinoma[J]. N Engl J Med, 2019, 380(15): 1450-1462. DOI: 10.1056/NEJMra1713263. [2] LLOVET JM, KELLEY RK, VILLANUEVA A, et al. Hepatocellular carcinoma[J]. Nat Rev Dis Primers, 2021, 7(1): 6. DOI: 10.1038/s41572-020-00240-3. [3] European Association for the Study of the Liver, European Organisation for Research and Treatment of Cancer. EASL-EORTC clinical practice guidelines: Management of hepatocellular carcinoma[J]. J Hepatol, 2012, 56(4): 908-943. DOI: 10.1016/j.jhep.2011.12.001. [4] LLOVET JM, ZUCMAN-ROSSI J, PIKARSKY E, et al. Hepatocellular carcinoma[J]. Nat Rev Dis Primers, 2016, 2: 16018. DOI: 10.1038/nrdp.2016.18. [5] FORNER A, REIG M, BRUIX J. Hepatocellular carcinoma[J]. Lancet, 2018, 391(10127): 1301-1314. DOI: 10.1016/S0140-6736(18)30010-2. [6] VOGEL A, CERVANTES A, CHAU I, et al. Hepatocellular carcinoma: ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2018, 29(Suppl 4): iv238-iv255. DOI: 10.1093/annonc/mdy308. [7] HARTKE J, JOHNSON M, GHABRIL M. The diagnosis and treatment of hepatocellular carcinoma[J]. Semin Diagn Pathol, 2017, 34(2): 153-159. DOI: 10.1053/j.semdp.2016.12.011. [8] LLOVET JM, REAL MI, MONTAÑA X, et al. Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: A randomised controlled trial[J]. Lancet, 2002, 359(9319): 1734-1739. DOI: 10.1016/S0140-6736(02)08649-X. [9] LO CM, NGAN H, TSO WK, et al. Randomized controlled trial of transarterial lipiodol chemoembolization for unresectable hepatocellular carcinoma[J]. Hepatology, 2002, 35(5): 1164-1171. DOI: 10.1053/jhep.2002.33156. [10] KIRSTEIN MM, VOIGTLÄNDER T, SCHWEITZER N, et al. Transarterial chemoembolization versus sorafenib in patients with hepatocellular carcinoma and extrahepatic disease[J]. United European Gastroenterol J, 2018, 6(2): 238-246. DOI: 10.1177/2050640617716597. [11] RAOUL JL, FORNER A, BOLONDI L, et al. Updated use of TACE for hepatocellular carcinoma treatment: How and when to use it based on clinical evidence[J]. Cancer Treat Rev, 2019, 72: 28-36. DOI: 10.1016/j.ctrv.2018.11.002. [12] WANG Q, XIA D, BAI W, et al. Development of a prognostic score for recommended TACE candidates with hepatocellular carcinoma: A multicentre observational study[J]. J Hepatol, 2019, 70(5): 893-903. DOI: 10.1016/j.jhep.2019.01.013. [13] KUDO M, UESHIMA K, IKEDA M, et al. Randomised, multicentre prospective trial of transarterial chemoembolisation (TACE) plus sorafenib as compared with TACE alone in patients with hepatocellular carcinoma: TACTICS trial[J]. Gut, 2020, 69(8): 1492-1501. DOI: 10.1136/gutjnl-2019-318934. [14] PRIETO J, MELERO I, SANGRO B. Immunological landscape and immunotherapy of hepatocellular carcinoma[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(12): 681-700. DOI: 10.1038/nrgastro.2015.173. [15] MONTASSER A, BEAUFRÈRE A, CAUCHY F, et al. Transarterial chemoembolisation enhances programmed death-1 and programmed death-ligand 1 expression in hepatocellular carcinoma[J]. Histopathology, 2021, 79(1): 36-46. DOI: 10.1111/his.14317. [16] JOHN BV, SCHWARTZ K, LEVY C, et al. Impact of obeticholic acid exposure on decompensation and mortality in primary biliary cholangitis and cirrhosis[J]. Hepatol Commun, 2021, 5(8): 1426-1436. DOI: 10.1002/hep4.1720. [17] SUZUKI H, MORI M, KAWAGUCHI C, et al. Serum vascular endothelial growth factor in the course of transcatheter arterial embolization of hepatocellular carcinoma[J]. Int J Oncol, 1999, 14(6): 1087-1090. DOI: 10.3892/ijo.14.6.1087. [18] NOMAN MZ, DESANTIS G, JANJI B, et al. PD-L1 is a novel direct target of HIF-1α, and its blockade under hypoxia enhanced MDSC-mediated T cell activation[J]. J Exp Med, 2014, 211(5): 781-790. DOI: 10.1084/jem.20131916. [19] ZHENG L, FANG S, WU F, et al. Efficacy and safety of TACE combined with sorafenib plus immune checkpoint inhibitors for the treatment of intermediate and advanced TACE-refractory hepatocellular carcinoma: A retrospective Study[J]. Front Mol Biosci, 2021, 7: 609322. DOI: 10.3389/fmolb.2020.609322. [20] LENCIONI R, DE BAERE T, SOULEN MC, et al. Lipiodol transarterial chemoembolization for hepatocellular carcinoma: A systematic review of efficacy and safety data[J]. Hepatology, 2016, 64(1): 106-116. DOI: 10.1002/hep.28453. [21] HEIMBACH JK, KULIK LM, FINN RS, et al. AASLD guidelines for the treatment of hepatocellular carcinoma[J]. Hepatology, 2018, 67(1): 358-380. DOI: 10.1002/hep.29086. [22] European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma[J]. J Hepatol, 2018, 69(1): 182-236. DOI: 10.1016/j.jhep.2018.03.019. [23] Bureau of Medical Administration, National Health Commission of the People's Republic of China. Guidelines for diagnosis and treatment of primary liver cancer in China (2019 edition)[J]. J Clin Hepatol, 2020, 36(2): 277-292. DOI: 10.3969/j.issn.1001-5256.2020.02.007.中华人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗规范(2019年版)[J]. 临床肝胆病杂志, 2020, 36(2): 277-292. DOI: 10.3969/j.issn.1001-5256.2020.02.007. [24] KUDO M. Targeted and immune therapies for hepatocellular carcinoma: Predictions for 2019 and beyond[J]. World J Gastroenterol, 2019, 25(7): 789-807. DOI: 10.3748/wjg.v25.i7.789. [25] FINN RS, QIN S, IKEDA M, et al. Atezolizumab plus Bevacizumab in unresectable hepatocellular carcinoma[J]. N Engl J Med, 2020, 382(20): 1894-1905. DOI: 10.1056/NEJMoa1915745. -


 PDF下载 ( 2633 KB)
PDF下载 ( 2633 KB)


 下载:
下载: